高考化学真题重组卷 7+4专题冲刺 专题1 与化学计量有关的计算
试卷更新日期:2023-02-21 类型:三轮冲刺
一、单选题
-
1. 设为阿伏加德罗常数的值。下列说法正确的是( )A、中含有的中子数为 B、分子中含有的键数目为 C、标准状况下,气体中数目为 D、的溶液中数目为2. 在2.8gFe中加入100mL3mol/LHCl,Fe完全溶解。NA代表阿伏加德罗常数的值,下列说法正确的是( )A、反应转移电子为0.1mol B、HCl溶液中数为3NA C、含有的中子数为1.3NA D、反应生成标准状况下气体3.36L3. 为阿伏加德罗常数的值,下列说法正确的是( )A、中含有个阳离子 B、乙烷和丙烯的混合气体中所含碳氢键数为 C、含有中子数为 D、和于密闭容器中充分反应后,分子总数为4. 甲基丙烯酸甲酯是合成有机玻璃的单体。
旧法合成的反应:
新法合成的反应:
下列说法错误的是(阿伏加德罗常数的值为 )( )
A、 的电子式为 B、新法没有副产物产生,原子利用率高 C、 的 溶液中 的微粒数小于 D、 的作用是降低反应的活化能,使活化分子数目增多,百分数不变5. 我国科学家进行了如图所示的碳循环研究。下列说法正确的是( )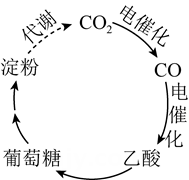 A、淀粉是多糖,在一定条件下能水解成葡萄糖 B、葡萄糖与果糖互为同分异构体,都属于烃类 C、 中含有 个电子 D、 被还原生成6. 为阿伏加德罗常数的值,下列说法正确的是( )A、 , 下,氢气中质子的数目为 B、溶液中,的数目为 C、苯甲酸完全燃烧,生成的数目为 D、电解熔融 , 阴极增重 , 外电路中通过电子的数目为7. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、在25℃时,1LpH为12的Ba(OH)2溶液中含有OH-数目为0.01NA B、1.8g重水(D2O)中所含质子数为NA C、足量的浓盐酸与8.7gMnO2反应,转移电子的数目为0.4NA D、32g甲醇的分子中含有C—H键的数目为4NA
A、淀粉是多糖,在一定条件下能水解成葡萄糖 B、葡萄糖与果糖互为同分异构体,都属于烃类 C、 中含有 个电子 D、 被还原生成6. 为阿伏加德罗常数的值,下列说法正确的是( )A、 , 下,氢气中质子的数目为 B、溶液中,的数目为 C、苯甲酸完全燃烧,生成的数目为 D、电解熔融 , 阴极增重 , 外电路中通过电子的数目为7. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、在25℃时,1LpH为12的Ba(OH)2溶液中含有OH-数目为0.01NA B、1.8g重水(D2O)中所含质子数为NA C、足量的浓盐酸与8.7gMnO2反应,转移电子的数目为0.4NA D、32g甲醇的分子中含有C—H键的数目为4NA二、实验探究题
-
8. 磷酸氢二铵[]常用于干粉灭火剂。某研究小组用磷酸吸收氢气制备 , 装置如图所示(夹持和搅拌装置已省略)。

回答问题:
(1)、实验室用和制备氨气的化学方程式为。(2)、现有浓质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的溶液,则需浓mL(保留一位小数)。(3)、装置中活塞的作用为。实验过程中,当出现现象时,应及时关闭 , 打开。(4)、当溶液pH为8.0~9.0时,停止通 , 即可制得溶液。若继续通入 , 当时,溶液中、和(填离子符号)浓度明显增加。(5)、若本实验不选用pH传感器,还可选用作指示剂,当溶液颜色由变为时,停止通。9. 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3 , 进一步处理得到产品Na2CO3和NH4Cl,实验流程如图: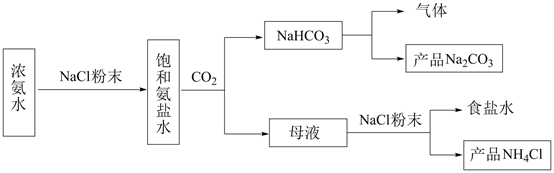
回答下列问题:
(1)、从A~E中选择合适的仪器制备NaHCO3 , 正确的连接顺序是(按气流方向,用小写字母表示)。为使A中分液漏斗内的稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或。A.
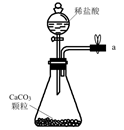 B.
B. 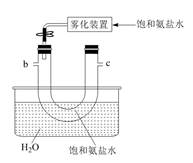 C.
C.  D.
D. 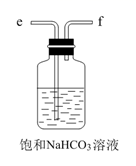 E.
E. 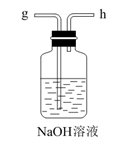 (2)、B中使用雾化装置的优点是 。(3)、生成NaHCO3的总反应的化学方程式为。(4)、反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:
(2)、B中使用雾化装置的优点是 。(3)、生成NaHCO3的总反应的化学方程式为。(4)、反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2 , Na2O2增重0.14g,则固体NaHCO3的质量为g。
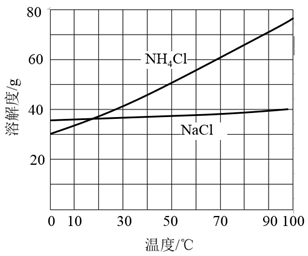
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为、、洗涤、干燥。
 (5)、无水NaHCO3可作为基准物质标定盐酸浓度.称量前,若无水NaHCO3保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果___(填标号)。A、偏高 B、偏低 不变
(5)、无水NaHCO3可作为基准物质标定盐酸浓度.称量前,若无水NaHCO3保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果___(填标号)。A、偏高 B、偏低 不变三、综合题
-
10. 联合生产是化学综合利用资源的有效方法。煅烧石灰石反应:
, 石灰石分解需要的能量由焦炭燃烧提供。将石灰石与焦炭按一定比例混合于石灰窑中,连续鼓入空气,使焦炭完全燃烧生成 , 其热量有效利用率为50%。石灰窑中产生的富含的窑气通入氨的氯化钠饱和溶液中,40%的最终转化为纯碱。已知:焦炭的热值为(假设焦炭不含杂质)。
请回答:
(1)、每完全分解石灰石(含 , 杂质不参与反应),需要投料焦炭。(2)、每生产纯碱,同时可获得(列式计算)。11. 玻璃仪器内壁残留的硫单质可用热KOH溶液洗涤除去,发生如下反应:3S+6KOH 2K2S+K2SO3+3H2O
(x-1)S+K2S K2Sx(x=2~6)
S+ K2SO3 K2S2O3
请计算:
(1)、0.480 g硫单质与V mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3 , 则V=。(2)、2.560 g硫单质与60.0 mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3 , 则x=。(写出计算过程)