重庆市南开名校高三下学期高2023届高三第六次质量检测化学试题(2月)
试卷更新日期:2023-02-20 类型:月考试卷
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 化学在生活生产及科研领域可谓无所不在。下列有关说法中正确的是A、霓虹灯能发出五颜六色的光利用了金属离子的焰色反应 B、某电解质水饮料的配料表中注明“含有钠、钾、维生素、碳水化合物等”,其均属于电解质 C、油脂的“氢化”属于还原反应 D、生铁的含碳量低于普通钢材2. 下列化学用语或化学图谱正确的是A、 乙炔的球棍模型:
 B、
B、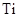 的原子结构示意图:
的原子结构示意图: C、 无水乙醇的核磁共振氢谱图:
C、 无水乙醇的核磁共振氢谱图: D、
D、 水解的离子方程式:
水解的离子方程式: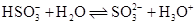 3. 下列各组离子在指定环境中一定能大量共存的一组是A、澄清透明的水溶液中:
3. 下列各组离子在指定环境中一定能大量共存的一组是A、澄清透明的水溶液中: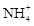 、
、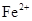 、
、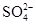 、
、 B、硝酸型酸雨的雨水中:
B、硝酸型酸雨的雨水中: 、
、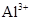 、
、 、
、 C、加入碳铵能产生气体的溶液中:
C、加入碳铵能产生气体的溶液中: 、
、 、
、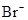 、
、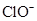 D、
D、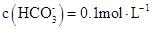 的溶液中:
的溶液中: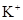 、
、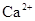 、
、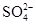 、
、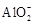 4. 实验室利用下列仪器(不考虑夹持装置和塞子及导管)不能制备的气体是
4. 实验室利用下列仪器(不考虑夹持装置和塞子及导管)不能制备的气体是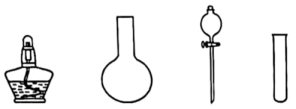 A、
A、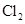 B、
B、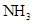 C、
C、 D、
D、 5. 硼氢化合物又称硼烷,其中乙硼烷是能分离出的最简单的硼烷,化学式为
5. 硼氢化合物又称硼烷,其中乙硼烷是能分离出的最简单的硼烷,化学式为 , 其结构如下图所示,遇水发生水解,其化学方程式为:
, 其结构如下图所示,遇水发生水解,其化学方程式为: , 设
, 设 为阿伏加德罗常数的值,下列有关说法正确的是
为阿伏加德罗常数的值,下列有关说法正确的是 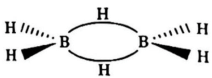 A、乙硼烷属于烃类物质 B、相同条件下,乙硼烷的沸点低于乙烷 C、 1
A、乙硼烷属于烃类物质 B、相同条件下,乙硼烷的沸点低于乙烷 C、 1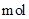
 中含有的共用电子对数目为8
中含有的共用电子对数目为8 D、 2.8g
D、 2.8g 完全水解,转移的电子数目为1.2
完全水解,转移的电子数目为1.2 6. 工业烟气中含有较高浓度的氮氧化物,需进行脱除处理才能排放到大气中。下图是一种利用
6. 工业烟气中含有较高浓度的氮氧化物,需进行脱除处理才能排放到大气中。下图是一种利用 在催化剂条件下脱除
在催化剂条件下脱除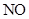 的原理示意图:
的原理示意图:

下列说法错误的是
A、步骤①中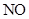 发生氧化反应
B、步骤②中包含有σ键和π键的断裂
C、若参与反应的
发生氧化反应
B、步骤②中包含有σ键和π键的断裂
C、若参与反应的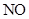 和
和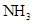 的物质的量相等,则该过程的总反应化学方程式为4NH3+4NO+O24N2+6H2O
D、当消耗a
的物质的量相等,则该过程的总反应化学方程式为4NH3+4NO+O24N2+6H2O
D、当消耗a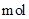
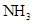 和b
和b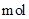
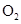 时,消耗
时,消耗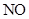 的物质的量为
的物质的量为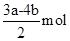 7. 某有机物的结构简式如下图所示,是合成抗菌药物的重要中间体。下列说法中正确的是
7. 某有机物的结构简式如下图所示,是合成抗菌药物的重要中间体。下列说法中正确的是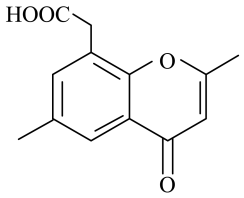 A、该有机物含有3种官能团 B、 该有机物的分子式为
A、该有机物含有3种官能团 B、 该有机物的分子式为 C、 1
C、 1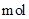 该有机物最多能与5
该有机物最多能与5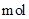
 发生加成反应
D、 该分子中只有3个采取
发生加成反应
D、 该分子中只有3个采取 杂化的原子
8. V、W、X、Y、Z是原子序数依次增大的前四周期元素,其中V的一种原子不含中子,W和Z分别是第二和第四周期中未成对电子数最多的元素,X元素无正价,Y的原子序数等于W和X的原子序数之和,下列说法中错误的是A、 原子半径:
杂化的原子
8. V、W、X、Y、Z是原子序数依次增大的前四周期元素,其中V的一种原子不含中子,W和Z分别是第二和第四周期中未成对电子数最多的元素,X元素无正价,Y的原子序数等于W和X的原子序数之和,下列说法中错误的是A、 原子半径: B、 第一电离能:
B、 第一电离能: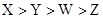 C、W与V或X均能形成三角锥形分子
D、可用铝热反应冶炼Z的单质
9. 硫酸亚铁铵晶体,又称摩尔盐,是分析化学中重要的基准物质,其化学式可表示为
C、W与V或X均能形成三角锥形分子
D、可用铝热反应冶炼Z的单质
9. 硫酸亚铁铵晶体,又称摩尔盐,是分析化学中重要的基准物质,其化学式可表示为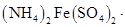
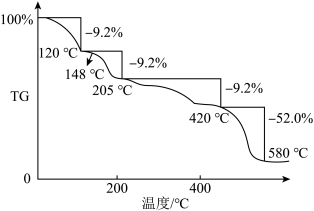
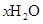 。为测定其结晶水含量并进一步探究其在惰性气体氛围中的热分解反应过程,现取一定质量的摩尔盐晶体做热重分析,绘制出如下的热重曲线。
。为测定其结晶水含量并进一步探究其在惰性气体氛围中的热分解反应过程,现取一定质量的摩尔盐晶体做热重分析,绘制出如下的热重曲线。 已知:①

②摩尔盐在580℃下完全分解,得到红棕色固体
则下列说法正确的是
 A、 用
A、 用 溶液检验摩尔盐中的金属阳离子
B、
溶液检验摩尔盐中的金属阳离子
B、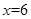 C、用湿润的红色石蕊试纸检验205~420℃间分解产生的气体,试纸变蓝
D、 0~580℃发生的化学方程式为:
C、用湿润的红色石蕊试纸检验205~420℃间分解产生的气体,试纸变蓝
D、 0~580℃发生的化学方程式为:
 10. 尽管计算机模拟实验已经有相当广泛的应用,但化学仍然是一门以实际操作并进行相应探究的学科。下列实验操作、现象与相应结论或解释相对应的一组是
10. 尽管计算机模拟实验已经有相当广泛的应用,但化学仍然是一门以实际操作并进行相应探究的学科。下列实验操作、现象与相应结论或解释相对应的一组是选项
实验操作
实验现象
结论或解释
A
在葡萄糖溶液中滴入少量酸性
 溶液
溶液 溶液褪色
溶液褪色醛基具有还原性
B
在
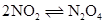 平衡体系中保持恒温恒容条件继续充入一定量
平衡体系中保持恒温恒容条件继续充入一定量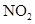
体系颜色变浅
反应物浓度增大,平衡向正向移动
C
在
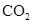 气体氛围中点燃金属钠
气体氛围中点燃金属钠产生浓烟并有黑色颗粒生成
单质还原性:
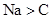
D
取适量
 溶液于试管中,测定pH值,然后加热一段时间,冷却至原温度,再次测定该溶液pH值
溶液于试管中,测定pH值,然后加热一段时间,冷却至原温度,再次测定该溶液pH值加热后pH值变小
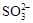 的水解为吸热过程A、A B、B C、C D、D11. 实验室利用环己酮和乙二醇反应可以制备环己酮缩乙二醇,反应原理及实验装置如下图所示:
的水解为吸热过程A、A B、B C、C D、D11. 实验室利用环己酮和乙二醇反应可以制备环己酮缩乙二醇,反应原理及实验装置如下图所示:
下列有关说法错误的是
A、管口A是冷凝水的进水口 B、当观察到分水器中苯层液面高于支管口时,必须打开旋塞B将水放出 C、反应中加入苯的作用是:作反应溶剂,同时与水形成共沸物便于蒸出水 D、 若将反应物改为苯乙酮(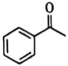 )和乙二醇,则得到
)和乙二醇,则得到 有机产物为
有机产物为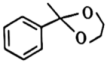 12. 锂离子电池及其迭代产品依然是目前世界上主流
12. 锂离子电池及其迭代产品依然是目前世界上主流 手机电池。近期研发的一种
手机电池。近期研发的一种 可充电电池的原理示意图如下,电池反应为
可充电电池的原理示意图如下,电池反应为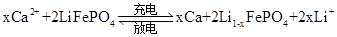 , 下列说法错误的是
, 下列说法错误的是  A、 充电时,
A、 充电时, 脱嵌并移向钙电极
B、 放电时,正极反应为
脱嵌并移向钙电极
B、 放电时,正极反应为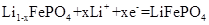 C、 锂离子导体膜
C、 锂离子导体膜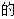 作用是允许
作用是允许 和水分子通过,同时保证
和水分子通过,同时保证 定向移动以形成电流
D、 充电时,当转移0.2
定向移动以形成电流
D、 充电时,当转移0.2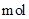 电子时,理论上阴极室中电解质的质量减轻2.6g
13. 在一恒温恒容的2L密闭容器中充入0.2
电子时,理论上阴极室中电解质的质量减轻2.6g
13. 在一恒温恒容的2L密闭容器中充入0.2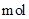 X、0.2
X、0.2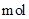 Y和0.1
Y和0.1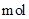 Z,发生如下两个反应:
Z,发生如下两个反应: ①
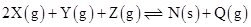

②
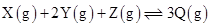
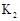
5min时反应达到平衡,测得体系的压强减少20%,此时剩余的X和Y浓度相同。
下列说法错误的是
A、 平衡后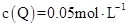 B、 0~5min内用Z表示的平均反应速率
B、 0~5min内用Z表示的平均反应速率 C、 该温度下
C、 该温度下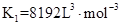 D、 平衡后,向容器中再充入0.1
D、 平衡后,向容器中再充入0.1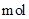 Q和0.05
Q和0.05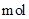 Z,反应①不移动
14. 甘氨酸(
Z,反应①不移动
14. 甘氨酸(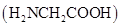 )在水溶液中存在如下两个平衡过程:
)在水溶液中存在如下两个平衡过程: ①

②

常温下用0.1
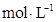 稀盐酸和0.1
稀盐酸和0.1
 溶液调节100
溶液调节100 0.1
0.1 的甘氨酸溶液的pH值,测得溶液pH值与甘氨酸的存在形式分布分数(α)如下图所示。
的甘氨酸溶液的pH值,测得溶液pH值与甘氨酸的存在形式分布分数(α)如下图所示。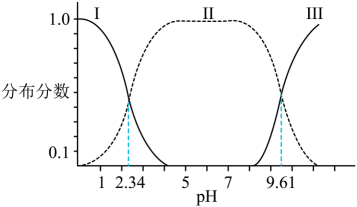
下列说法不正确的是
A、 图中Ⅲ代表的是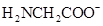 的分布分数曲线
B、甘氨酸溶液呈酸性
C、 反应
的分布分数曲线
B、甘氨酸溶液呈酸性
C、 反应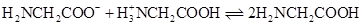 K , 则常温下
K , 则常温下 D、 在
D、 在 时,加入盐酸,
时,加入盐酸, 不变
不变
二、非选择题:共58分。
-
15. 以下为一种制取铜的新工艺,原料利用率较高。
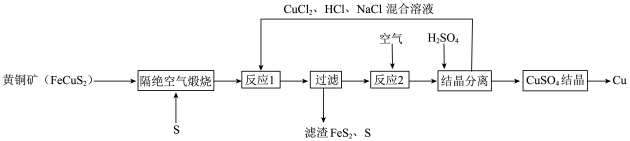
请回答下列问题:
(1)、为使隔绝空气煅烧充分进行,工业可采取的措施是(填写合理的一种即可)。(2)、隔绝空气煅烧后固体为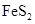 、
、 , 反应1为溶浸反应,则反应1的离子方程式为(已知:
, 反应1为溶浸反应,则反应1的离子方程式为(已知: )。 (3)、反应2发生的主要反应的离子方程式为 , 一定温度下,在反应2所得的溶液中加入硫酸,能析出硫酸铜晶体,其可能的原因是。(4)、滤渣中的
)。 (3)、反应2发生的主要反应的离子方程式为 , 一定温度下,在反应2所得的溶液中加入硫酸,能析出硫酸铜晶体,其可能的原因是。(4)、滤渣中的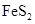 是黄铁矿的主要成分,其晶体结构类似
是黄铁矿的主要成分,其晶体结构类似 , 如图所示:
, 如图所示:

①
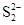 的电子式为。
的电子式为。②晶体结构中离
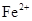 最近的
最近的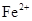 有个,
有个,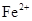 的电子排布式为。
的电子排布式为。③若晶胞边长为x
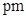 , 则此晶体密度为
, 则此晶体密度为 (用
(用 表示阿伏加德罗常数)。16.
表示阿伏加德罗常数)。16.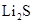 (易潮解)是一种潜在的锂电池的电解质材料。某小组用粗锌(含少量
(易潮解)是一种潜在的锂电池的电解质材料。某小组用粗锌(含少量 和
和 )和稀硫酸反应制备
)和稀硫酸反应制备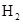 , 利用纯化后的氢气还原硫酸锂制备硫化锂并对产品纯度进行分析。
, 利用纯化后的氢气还原硫酸锂制备硫化锂并对产品纯度进行分析。 请回答下列问题:
 (1)、利用上述装置制备
(1)、利用上述装置制备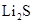 , 按气流从左至右,装置的连接顺序是A→(填字母,装置可重复使用)。 (2)、其他条件相同,粗锌与稀硫酸反应比纯锌(填“快”或“慢”),B中反应的化学方程式为 , C中现象是。(3)、探究
, 按气流从左至右,装置的连接顺序是A→(填字母,装置可重复使用)。 (2)、其他条件相同,粗锌与稀硫酸反应比纯锌(填“快”或“慢”),B中反应的化学方程式为 , C中现象是。(3)、探究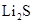 产品的成分
产品的成分 实验
操作与现象
结论
Ⅰ
取少量
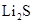 样品,滴加足量稀盐酸,将气体通入品红溶液中,溶液褪色
样品,滴加足量稀盐酸,将气体通入品红溶液中,溶液褪色样品含
 杂质
杂质Ⅱ
在实验Ⅰ的溶液中滴加( ),产生白色沉淀
样品含
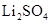 杂质
杂质由上述实验Ⅱ中滴加试剂为 , 产品中含有
 、
、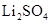 杂质的原因可能是。(4)、定量测定
杂质的原因可能是。(4)、定量测定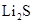 的含量
的含量 ①取
 g
g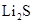 样品加入
样品加入


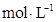 稀硫酸(过量)
稀硫酸(过量)②充分反应后,煮沸溶液以除去残留的酸性气体
③滴加酚酞溶液作指示剂,用

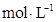 标准
标准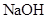 溶液滴定过量的硫酸,消耗
溶液滴定过量的硫酸,消耗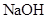 溶液
溶液
 , 产品含
, 产品含 杂质,但不影响上述实验方案的科学性,理由是 , 若产品中
杂质,但不影响上述实验方案的科学性,理由是 , 若产品中 杂质含量为10%(质量分数),则
杂质含量为10%(质量分数),则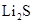 样品的纯度为(用含
样品的纯度为(用含 、
、 、
、 、
、 、m的代数式表示)。17.(1)、Ⅰ.碳热还原
、m的代数式表示)。17.(1)、Ⅰ.碳热还原 过程中可能发生下列反应。
过程中可能发生下列反应。 ⅰ.


ⅱ.


ⅲ.


 ;温度升高,
;温度升高, 平衡常数K将(填“增大”、“减小”、“不变”)。(2)、Ⅱ.乙炔的加成反应是众多科研工作者的研究对象。
平衡常数K将(填“增大”、“减小”、“不变”)。(2)、Ⅱ.乙炔的加成反应是众多科研工作者的研究对象。不同温度下,1.2
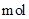
 与1
与1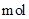
 制氯乙烯(
制氯乙烯( ),在1L刚性容器中反应3h,实验数据如下图。
),在1L刚性容器中反应3h,实验数据如下图。
①135℃时,3h内
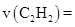 (保留两位小数,下同)。
(保留两位小数,下同)。②该反应最适宜温度下平衡常数
 。(3)、《自然》杂志发表的一篇文章中,提出在催化剂
。(3)、《自然》杂志发表的一篇文章中,提出在催化剂 作用下上述反应的反应历程如图所示。“2→3”的化学方程式可表示为:
作用下上述反应的反应历程如图所示。“2→3”的化学方程式可表示为: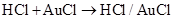

①“4→5”的化学方程式为。
②反应物在催化剂表面经历过程“扩散→吸附(活性位点)→表面反应→脱附”。若保持体系中
 分压不变,
分压不变, 分压过高时反应催化效率降低的可能原因是。(4)、西北工业大学的张健教授、德累斯顿工业大学的冯新亮院士等人报道了一种电催化半氢化策略,在室温条件下,水溶液介质中可选择性地将
分压过高时反应催化效率降低的可能原因是。(4)、西北工业大学的张健教授、德累斯顿工业大学的冯新亮院士等人报道了一种电催化半氢化策略,在室温条件下,水溶液介质中可选择性地将 还原为
还原为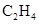 , 其原理示意图如下:
, 其原理示意图如下: 
①阴极的电极反应式为:。
②同温同压下,相同时间内,若进口处气体物质的量为a
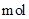 , 出口处气体的总体积为进口处的x倍,则
, 出口处气体的总体积为进口处的x倍,则 转化率为。18. 洛索洛芬钠对急性上呼吸道炎患者具有一定的解热和阵痛作用。化合物M是合成洛索洛芬钠的重要中间体,其结构简式为
转化率为。18. 洛索洛芬钠对急性上呼吸道炎患者具有一定的解热和阵痛作用。化合物M是合成洛索洛芬钠的重要中间体,其结构简式为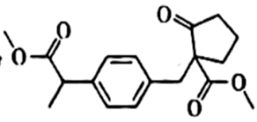 , 它的其中一种合成路线如下:
, 它的其中一种合成路线如下:
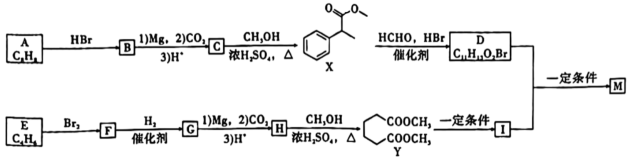
已知:①

②
 R′OH
R′OH回答下列问题:
(1)、M所含官能团名称为 , 含有的手性碳原子数目为。(2)、F的名称是 , 由I和D生成M的反应类型为。(3)、D的结构简式为 , I的分子式为。(4)、写出由C生成X的化学方程式:。(5)、有机物N是F的同系物,其相对分子质量比F小14,则N的结构有种。(6)、 和乙二醇在一定条件下可以生成高聚物,写出该反应的化学方程式:。
和乙二醇在一定条件下可以生成高聚物,写出该反应的化学方程式:。