浙江省2018-2022年科学中考真题汇编22:常见的盐
试卷更新日期:2023-02-19 类型:二轮复习
一、单选题
-
1. 在5.6g铁粉中,先逐滴加入一定量的Cu(NO3)2溶液, 充分反应后再逐滴加入AgNO3溶液,剩余固体质量与所加溶液总质量的关系如图所示。下列说法正确的是( )
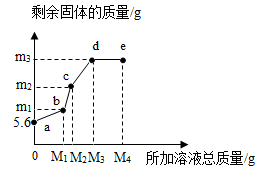 A、所加溶液质量为M1g时,生成Cu的质量为m1g B、bc段发生的是Cu和AgNO3溶液的反应 C、m3的值为21.6 D、e点溶液中不含Cu(NO3)22. 如图所示为小嘉构建的甲、乙、丙,丁四种不同物质的关系图,“---”表示相邻的两种物质能发生反应。若甲为铁, 乙、丙、丁分别是稀H2SO4、CuCl2溶液、NaOH溶液中的任意一种, 则下列判断错误的是( )
A、所加溶液质量为M1g时,生成Cu的质量为m1g B、bc段发生的是Cu和AgNO3溶液的反应 C、m3的值为21.6 D、e点溶液中不含Cu(NO3)22. 如图所示为小嘉构建的甲、乙、丙,丁四种不同物质的关系图,“---”表示相邻的两种物质能发生反应。若甲为铁, 乙、丙、丁分别是稀H2SO4、CuCl2溶液、NaOH溶液中的任意一种, 则下列判断错误的是( )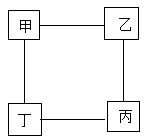 A、乙可能是CuCl2溶液 B、丙一定是NaOH溶液 C、丁一定是稀H2SO4 D、丙不可能是稀H2SO43. 小金完成了图示实验①②③,下列判断正确的是( )
A、乙可能是CuCl2溶液 B、丙一定是NaOH溶液 C、丁一定是稀H2SO4 D、丙不可能是稀H2SO43. 小金完成了图示实验①②③,下列判断正确的是( )
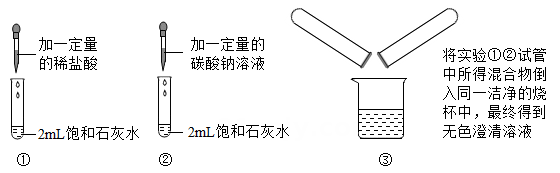 A、实验①中石灰水有剩余 B、实验②中有气泡产生 C、实验③中没有明显现象 D、实验③所得溶液中一定含CaCl2和NaCl4. 现有4种试剂:①紫色石蕊试液;②稀硫酸;③碳酸钾溶液;④氯化钡溶液。能用来一次性鉴别稀盐酸、氢氧化钡溶液、碳酸钠溶液的试剂有( )A、② B、②③ C、①②③ D、②③④5. 小柯给校园里植株矮小、叶色发黄的植物施用尿素CO(NH2)2 , 尿素是一种( )A、复合肥 B、氮肥 C、磷肥 D、钾肥
A、实验①中石灰水有剩余 B、实验②中有气泡产生 C、实验③中没有明显现象 D、实验③所得溶液中一定含CaCl2和NaCl4. 现有4种试剂:①紫色石蕊试液;②稀硫酸;③碳酸钾溶液;④氯化钡溶液。能用来一次性鉴别稀盐酸、氢氧化钡溶液、碳酸钠溶液的试剂有( )A、② B、②③ C、①②③ D、②③④5. 小柯给校园里植株矮小、叶色发黄的植物施用尿素CO(NH2)2 , 尿素是一种( )A、复合肥 B、氮肥 C、磷肥 D、钾肥二、填空题
-
6. 《天工开物》中记载了许多我国古代劳动人民对物质的认识和应用的事例,如:
硝石:“硝质与盐同母,大地之下潮气蒸成,现于地面。”
石灰:“凡石灰经火焚炼为用。……用以砌墙、石,则筛去石块,水调黏合。”
(1)、硝石(硝酸钾)与食盐同属于类物质(选填“酸”“碱”或“盐”)。(2)、文中石灰指氧化钙,可通过CaCO3 CaO+CO2↑反应制备,此反应属于反应(填写反应的基本类型):水调黏合过程中,氧化钙和水发生反应的化学方程式为。7. 无土栽培是用营养液代替土壤提供植物生长所需的水和无机盐。(1)、硝酸钾(KNO3)是营养液中的一种常见成分。硝酸钾属于 ;A、酸 B、碱 C、盐 D、氧化物(2)、配制100克含硝酸钾质量分数为3%的营养液,需要硝酸钾的质量为克。8. 向一定质量的CaCl2和HCl的混合溶液中逐滴加入Na2CO3溶液,并振荡。如图表示反应过程中溶液质量随加入Na₂CO3溶液质量的变化情况。图线AB段对应的实验现象是 , 在C点时溶液中的溶质是。 9. 厨房里有两瓶白色固体,分别为食盐(NaCl) 和纯碱(Na2CO3)。(1)、可用于腌制肉类和蔬菜,使食物不易腐败的是。(2)、为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
9. 厨房里有两瓶白色固体,分别为食盐(NaCl) 和纯碱(Na2CO3)。(1)、可用于腌制肉类和蔬菜,使食物不易腐败的是。(2)、为鉴别这两种物质,某同学取少量白色固体,进行如下实验。方案一:分别滴加少量食醋,有气泡产生的是。
方案二:加水溶解,分别滴加溶液,有沉淀产生的是纯碱。
三、实验探究题
-
10. 某种粗盐水中有少量含SO42-、K+的杂质,小金用这种粗盐水经过下列实验流程制取纯净氯化钠晶体。
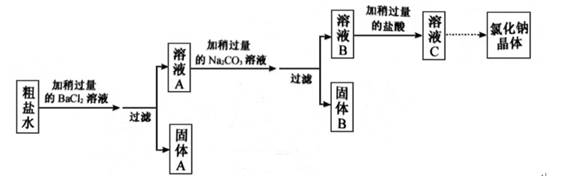 (1)、固体A是。(填化学式)(2)、加碳酸钠溶液时发生反应的化学方程式。(3)、若将溶液C蒸发至出现大量固体时停止加热,利用余热将溶液蒸干得到晶体,所得体仍不是纯净的氯化钠,理由是。11. 为探究一瓶久置的氢氧化钠固体样品是否全部变质,小柯取少量样品配制成溶液,再取少量溶液分别装入两支试管中,进行了如甲、乙两图所示实验。(注:BaCl2溶液呈中性)
(1)、固体A是。(填化学式)(2)、加碳酸钠溶液时发生反应的化学方程式。(3)、若将溶液C蒸发至出现大量固体时停止加热,利用余热将溶液蒸干得到晶体,所得体仍不是纯净的氯化钠,理由是。11. 为探究一瓶久置的氢氧化钠固体样品是否全部变质,小柯取少量样品配制成溶液,再取少量溶液分别装入两支试管中,进行了如甲、乙两图所示实验。(注:BaCl2溶液呈中性)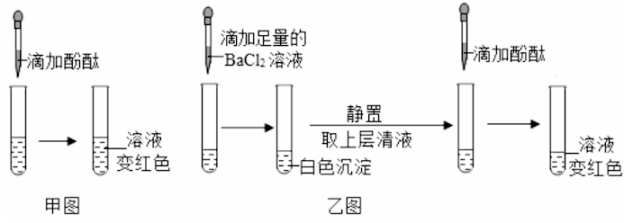 (1)、小柯认为“甲图实验说明了氢氧化钠固体部分变质”。你认为小柯的观点是否正确,并说明理由。(2)、分析乙图实验的现象,可以确定样品的变质情况为。(3)、进一步探究:另取少量样品溶液,加入一定质量分数的稀盐酸,直至过量。请在丙图中画出“生成CO2的质量随加入稀盐酸质量变化”的大致图像。
(1)、小柯认为“甲图实验说明了氢氧化钠固体部分变质”。你认为小柯的观点是否正确,并说明理由。(2)、分析乙图实验的现象,可以确定样品的变质情况为。(3)、进一步探究:另取少量样品溶液,加入一定质量分数的稀盐酸,直至过量。请在丙图中画出“生成CO2的质量随加入稀盐酸质量变化”的大致图像。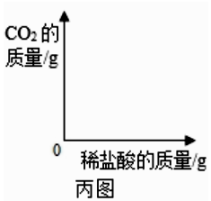
四、解答题
-
12. “庄稼一枝花, 全靠肥当家”。有一种新型化肥——硝酸铵钙, 其有效成分为NH4NO3和Ca(NO3)2 , 进入土壤后,都成为可吸收的离子,不会引起土壤板结,且钙离子可提高农作物对病害的抵抗力。
小宁利用某品牌的硝酸铵钙化肥, 进行以下实验:取化肥样品8.0g, 与足量的NaOH固体充分混合, 加热到固体质量不再减少,生成0.17g氨气(NH3) 。把反应所得固体溶于适量
水中,再加入足量的Na2CO3溶液充分反应,过滤得到沉淀和滤液,测得沉淀质量为4.0g。
(已知:NH4NO3+NaOH NaNO3+NH3↑+H2O;化肥中的其它成分不含Ca、N元素,且不参加反应)
(1)、作为氮肥,硝酸铵钙在植物生活中的主要作用是 。A、促进细胞分裂和生长,使枝叶长得繁茂 B、促进幼苗的生长发育和开花,使果实、种子的成熟提早 C、使茎杆健壮,促进淀粉的形成(2)、计算样品中NH4NO3的质量分数。(3)、计算滤液中NaNO3的质量。13. 举重前运动员常常会抓一把“镁粉”在手里搓,以起到防滑效果。某种“镁粉”中只含有MgO、Mg(OH)2、MgCO3中的一种或几种固体。某兴趣小组对其成分展开了探究:分别取4.2克MgO、Mg(OH)2、MgCO3和“镁粉”置于烧杯中,逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。四种固体消耗稀盐酸的质量如表所示,且烧杯③和烧杯④中产生了大量气泡。请结合实验现象和数据回答问题。
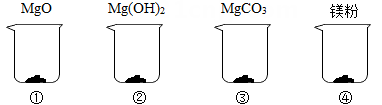
物质
MgO
Mg(OH)2
MgCO3
“镁粉”
消耗稀盐酸的质量/克
121.8
m
58.0
61.9
(1)、烧杯③中产生的气体是。(2)、“镁粉”中不只含有MgCO3一种物质,理由是。(3)、表格中m的值为多少?(请写出计算过程)(4)、为确定“镁粉”的具体成分,兴趣小组补充了如下实验:取“镁粉”和MgCO3各4.2克,加入足量稀盐酸,生成相同条件下的气体体积分别为952毫升和1120毫升。由此可知该种“镁粉”的成分是。14. 开春以来,为提高水稻产量,某农场积极做好科学施肥、精准防治病虫害等工作。(1)、水稻不同生长期需要不同的肥料。如在水稻抽穗、开花时期,为促进穗数增多、籽粒饱满,需要多施磷肥。下列属于磷肥的是 。A、碳酸钾(K2CO3) B、尿素[CO(NH2)2] C、磷酸二氢钙[Ca(H2PO4)2](2)、氮肥能促进水稻幼苗生长。一百亩水稻需要施3950千克碳酸氢铵(NH4HCO3),这些碳酸氢铵用氨气、水和二氧化碳反应来合成,需要氨气(NH3)多少千克?(3)、井冈霉素是防治水稻纹枯病的常用药。要为一百亩水稻喷洒该农药,需要配制溶质质量分数为0.01%的药液7500千克,应购买溶质质量分数为5%的井冈霉素药液多少千克?15. 钙是生物体骨骼的重要组成元素。鱼骨中含有碳酸钙、现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。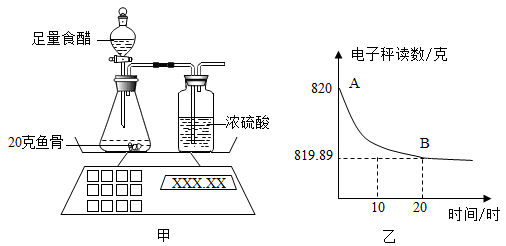
提示:①食醋的主要成分是醋酸(HAc)。醋酸和碳酸钙反应的化学方程式为:
CaCO3+2HAc=CaAc2+H2O+CO2
②鱼骨中其它成分与食醋反应生成的气体可忽略不计
(1)、该实验中浓硫酸的作用是。(2)、由图乙中的AB曲线,可知锥形瓶中反应速率的变化情况是(选填“变大”、“变小”或“不变”)。(3)、根据图中的数据计算鱼骨中碳酸钙的质量分数。(4)、生活中,用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。请你结合实验结果加以说明。16. 小宁用稀盐酸和石灰石反应制取二氧化碳(石灰石中的杂质既不溶于水也不和酸反应),为了探究反应后溶液的成分,他又进行如下实验:取反应后的溶液50g于烧杯中,逐滴滴入碳酸钠溶液,发现先有气泡产生,后生成白色沉淀。下表为产生的气体总质量、沉淀总质量与滴入碳酸钠溶液总质量的关系。碳酸钠溶液总质量/g
25.0
50.0
75.0
100.0
125.0
150.0
175.0
200.0
气体总质量/g
1.1
2.2
2.2
2.2
2.2
2.2
2.2
2.2
沉淀总质量/g
0
0
2.5
5.0
m
n
9.0
9.0
(1)、表中n=。(2)、所取的反应后50g溶液中溶质是 。(3)、所用碳酸钠溶液中溶质的质量分数是多少?17. 草木灰(主要成分为K2CO3)是一种常见的肥料。烧制草木灰是我国传统农耕方式,但会造成一定的环境污染。为护卫蓝天白云,我市发布通告,禁止露天烧制草木灰。(1)、从化学肥料分类角度分析,碳酸钾属于 (填“氮肥”、“磷肥"或“钾肥");(2)、要确认草木灰浸出液中含有 ,需用到的试剂是;(3)、为测定草木灰中碳酸钾的质量分数,小科进行以下实验:①取50克样品加入足量的蒸馏水,充分搅拌静置后,将浸出液全部转移到烧杯中;
②在烧杯中加入足量的CaCl2溶液,得到沉淀;
③将沉淀过滤、洗涤、烘干后得到5克固体。
求该样品中碳酸钾的质量分数。(杂质不发生化学反应,K2CO3+CaCl2=2KCl+CaCO3↓ )
18. 将12.9克NaCl和Na2CO3固体混合物完全溶于水中形成溶液,再将75克CaCl2溶液分5次加入到该溶液中,充分反应,测得的实验数据如下表。实验序号
1
2
3
4
5
加入CaCl2溶液质量/克
15
15
15
15
15
生成沉淀的总质量/克
3
m
9
10
10

求:
(1)、表格中m的数值是。(2)、溶液中Na2CO3完全反应是在第次实验。(3)、固体混合物Na2CO3的质量分数。(精确到0.1%)(4)、请画出上述过程中溶液中NaCl质量的变化图。19. 复方碳酸氢钠片是一种常用的抗酸剂药物,口服后能迅速中和胃酸,用于缓解胃酸过多引起的胃痛等症状。复方碳酸氢钠片的主要成分是碳酸氢钠(其他成分可溶于水但不参与反应),碳酸氢钠与盐酸反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑。
某科学兴趣小组为了测定药片中碳酸氢钠的含量做了以下实验:先将复方碳酸氢钠片制成粉末,取10克分多次放入盛有100克稀盐酸的烧杯中充分反应。测出加入的粉末质量和反应后的溶液质量,两者质量关系如图所示。
(1)、实验后,兴趣小组又往烧杯中加入少量粉末,观察到 , 说明上述实验结束时稀盐酸过量。(2)、计算复方碳酸氢钠片中碳酸氢钠的含量。(3)、计算10克粉末与稀盐酸反应后所得氯化钠溶液的溶质质量分数。(计算结果精确到0.1%)20. 为了探究氢氧化钡溶液和硫酸钠溶液反应后所得滤液X的成分,同学们做了以下实验;取50克滤液于烧杯中,天向烧杯中滴加溶质质量分数为6%的硫酸镁溶液20克,接着烧杯中滴加稀硫酸。加入溶液的质量与烧杯内沉淀的质量关系如图所示。 (1)、滤液X的pH7(选填“大于”、“等于”或“小于”)(2)、CD段发生反应的化学方程式为。(3)、滤液X中含有的溶质是。(4)、滴加入30克稀硫酸时,烧杯中沉淀的质量m2的值为多少?(写出计算过程)
(1)、滤液X的pH7(选填“大于”、“等于”或“小于”)(2)、CD段发生反应的化学方程式为。(3)、滤液X中含有的溶质是。(4)、滴加入30克稀硫酸时,烧杯中沉淀的质量m2的值为多少?(写出计算过程)