陕西省渭南市韩城市新城区2022-2023学年九年级上学期期末化学试题
试卷更新日期:2023-02-17 类型:期末考试
一、单选题
-
1. 我国神舟载人飞船供氧系统中含有下列物质,其中属于氧化物的是( )A、O2 B、CO2 C、NaOH D、Na2CO32. 下列历史典故中发生了化学变化的是( )A、铁杵磨成针 B、司马光砸缸 C、火烧赤壁 D、刻舟求剑3. 下列图示实验操作中,正确的是( )A、加固体药品
 B、添加酒精
B、添加酒精 C、加热液体
C、加热液体 D、检查气密性
D、检查气密性 4. 下列关于水的三态变化,说法正确的是( )A、水分子大小发生变化 B、水分子质量变小 C、变成了新分子 D、水分子间的间隔发生改变5. 下列关于碳和碳的氧化物说法正确的是( )A、金刚石、C60都是由碳元素组成的单质,物理性质相同 B、空气中CO2含量过多,会产生温室效应 C、CO2和CO都有毒 D、CO2气体中混有少量的CO气体,可用点燃的方法除去CO6. 下列关于H2O2、CO2、SO2三种物质的说法中正确的是( )A、都含有氧分子 B、都含有氧离子 C、氧元素的质量分数不同 D、H2O2、CO2、SO2可分别由氧气与H2、C、S通过化合反应生成7. 建立模型是学习化学的重要方法,下列化学模型表示中正确的是( )A、原子的构成
4. 下列关于水的三态变化,说法正确的是( )A、水分子大小发生变化 B、水分子质量变小 C、变成了新分子 D、水分子间的间隔发生改变5. 下列关于碳和碳的氧化物说法正确的是( )A、金刚石、C60都是由碳元素组成的单质,物理性质相同 B、空气中CO2含量过多,会产生温室效应 C、CO2和CO都有毒 D、CO2气体中混有少量的CO气体,可用点燃的方法除去CO6. 下列关于H2O2、CO2、SO2三种物质的说法中正确的是( )A、都含有氧分子 B、都含有氧离子 C、氧元素的质量分数不同 D、H2O2、CO2、SO2可分别由氧气与H2、C、S通过化合反应生成7. 建立模型是学习化学的重要方法,下列化学模型表示中正确的是( )A、原子的构成 B、地壳中元素含量模型
B、地壳中元素含量模型 C、石墨结构模型
C、石墨结构模型 D、灭火方法
D、灭火方法 8. 下列关于溶液的说法正确的是( )A、溶液一定是均一、稳定的混合物 B、溶液都是无色透明的 C、饱和溶液都比不饱和溶液浓度大 D、长期放置后不会分层的液体一定是溶液9. 利用催化剂可消除室内装修材料释放的甲醛,如图所示为该反应的微观示意图。下列说法错误的是( )
8. 下列关于溶液的说法正确的是( )A、溶液一定是均一、稳定的混合物 B、溶液都是无色透明的 C、饱和溶液都比不饱和溶液浓度大 D、长期放置后不会分层的液体一定是溶液9. 利用催化剂可消除室内装修材料释放的甲醛,如图所示为该反应的微观示意图。下列说法错误的是( ) A、甲醛的化学式为CH2O B、生成物丙由1个碳原子和2个氧原子构成 C、反应中分子发生了改变,而原子未发生改变 D、参加反应的甲和生成的丁分子个数比为1:110. 下列现象不能用质量守恒定律解释的是( )A、铁丝在空气中不能燃烧,而在纯氧中能燃烧 B、铁生锈后质量变大 C、高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小 D、蜡烛燃烧后变短11. 下列物质在氧气中燃烧,产生黑色固体的是( )A、硫粉 B、木炭 C、红磷 D、铁丝12. 用如图所示密闭装置进行实验,使固体与液体接触,能够观察到气球先变鼓,过一段时间又恢复到原状的一组固体和液体是( )
A、甲醛的化学式为CH2O B、生成物丙由1个碳原子和2个氧原子构成 C、反应中分子发生了改变,而原子未发生改变 D、参加反应的甲和生成的丁分子个数比为1:110. 下列现象不能用质量守恒定律解释的是( )A、铁丝在空气中不能燃烧,而在纯氧中能燃烧 B、铁生锈后质量变大 C、高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小 D、蜡烛燃烧后变短11. 下列物质在氧气中燃烧,产生黑色固体的是( )A、硫粉 B、木炭 C、红磷 D、铁丝12. 用如图所示密闭装置进行实验,使固体与液体接触,能够观察到气球先变鼓,过一段时间又恢复到原状的一组固体和液体是( )选项
固体
液体

A
硝酸铵
水
B
氢氧化钠
水
C
镁条
稀盐酸
D
氯化钠
水
A、A B、B C、C D、D13. 实验室制取一氧化碳发生的化学反应是。用如图所示的装置制取一氧化碳并还原氧化铁,下列说法正确的是( ) A、实验过程中应先加热氧化铁后将甲酸滴加到热的浓硫酸中 B、反应过程中a处黑色粉末逐渐变成红色 C、理论上a中减少的质量等于b处增加的质量 D、大气球的作用是收集一氧化碳,防止其污染空气14. 某同学取一定质量的锌粒和铜片放入烧杯中,再逐渐加入稀硫酸。加入稀硫酸的质量与其他量的变化关系如图所示,下列图像中正确的是( )A、
A、实验过程中应先加热氧化铁后将甲酸滴加到热的浓硫酸中 B、反应过程中a处黑色粉末逐渐变成红色 C、理论上a中减少的质量等于b处增加的质量 D、大气球的作用是收集一氧化碳,防止其污染空气14. 某同学取一定质量的锌粒和铜片放入烧杯中,再逐渐加入稀硫酸。加入稀硫酸的质量与其他量的变化关系如图所示,下列图像中正确的是( )A、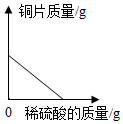 B、
B、 C、
C、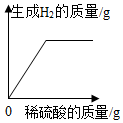 D、
D、 15. 下表中有关化学知识的整理和归纳有错误的一组是( )
15. 下表中有关化学知识的整理和归纳有错误的一组是( )A.化学实验中的先与后
B.化学与环境
①给固体加热时:先预热后集中加热
②可燃性气体燃烧:先验纯后点燃
①用淘米水浇花——节约用水
②回收利用废金属——减少对环境的污染
C.化学与安全
D.物质的性质与用途
①进入久未开启的菜窖,应先做灯火实验
②煤炉上放一盆水可防止CO中毒
①N2化学性质稳定——填充食品包装袋
②液氧具有助燃性——用于火箭发射
A、A B、B C、C D、D二、填空题
-
16. 含义丰富的化学符号是独特的化学语言。根据下列符号回答问题:
①2H2 ②Na+ ③4H ④ ⑤N2
(1)、能表示宏观物质的是(填序号,下同)。(2)、能表示“4个氢原子”的是。(3)、由②和④构成的物质的化学式为。(4)、⑤中数字“2”的含义是。17. 化学与生活密不可分。(1)、莲子富含碳水化合物、蛋白质、维生素还含有钙、镁、磷、钾等多种(填“单质”或“元素”)。(2)、某品牌加碘盐中添加的是碘酸钾(KIO3),KIO3中I元素的化合价为。(3)、森林着火,消防员用水灭火的原理是。(4)、医用酒精常用于伤口消毒,医用酒精中的溶质为。(5)、氢气是一种高能燃料,可由电解水得到氢气。请写出电解水的化学方程式。18. 建立宏观、微观和符号之间的相互联系是化学学科的特点。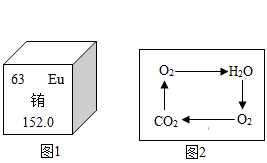
 (1)、铕是激光及原子能应用的重要材料。由图1可知,铕原子的核电荷数为。(2)、图2表示水、二氧化碳和氧气的循环图。从宏观角度看,图中三种物质的组成中都含有;从微观角度看,图中三种物质都是由(填“分子”、“原子”或“离子”)构成的。(3)、图3中,①表示的粒子符号为 , ①和②化学性质相似的原因是 , ①和③形成化合物的化学式为。19. 金属从古至今在人类生活中都扮演着重要的角色。(1)、山西“手撕钢”是一种厚度只有0.02毫米的不锈钢箱材料,钢材能够被轧压成“手撕钢”,说明金属材料具有良好的性。(2)、生活中为防止厨房的菜刀生锈,一般可采用的方法。(3)、新型铁锂合金可用于制造火星车的车结构,镁锂合金的硬度比纯锂的硬度(填“大”或“小”)。生铁和钢是常见的两种铁合金,其在本质上的区别是。(4)、用下图所示实验研究金属的性质。
(1)、铕是激光及原子能应用的重要材料。由图1可知,铕原子的核电荷数为。(2)、图2表示水、二氧化碳和氧气的循环图。从宏观角度看,图中三种物质的组成中都含有;从微观角度看,图中三种物质都是由(填“分子”、“原子”或“离子”)构成的。(3)、图3中,①表示的粒子符号为 , ①和②化学性质相似的原因是 , ①和③形成化合物的化学式为。19. 金属从古至今在人类生活中都扮演着重要的角色。(1)、山西“手撕钢”是一种厚度只有0.02毫米的不锈钢箱材料,钢材能够被轧压成“手撕钢”,说明金属材料具有良好的性。(2)、生活中为防止厨房的菜刀生锈,一般可采用的方法。(3)、新型铁锂合金可用于制造火星车的车结构,镁锂合金的硬度比纯锂的硬度(填“大”或“小”)。生铁和钢是常见的两种铁合金,其在本质上的区别是。(4)、用下图所示实验研究金属的性质。
①试管I中发生反应的化学方程式为。
②Ⅱ中的试管(填“有”或“没有”)气泡产生。
③试管III中可观察到的实验现象为。
20. 水及溶液在生产、生活中有着广泛的用途。(1)、将混有泥沙的天然水净化成生活用的自来水,应选用的方法和顺序为(填序号)。①蒸馏 ②加明矾沉降 ③杀菌 ④吸附 ⑤过滤
(2)、配制60g5%NaCl溶液时,玻璃棒的作用是。(3)、硝酸钾和氯化钾两种固体物质的溶解度曲线如图所示,请回答下列问题: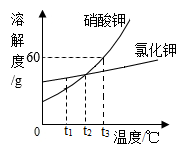
①t1℃时,将等质量的硝酸钾和氯化钾固体完全溶解配成饱和溶液,需要水的质量关系为:KNO3(填“>”“<”或“=”)KCl。
②t3℃时,硝酸钾饱和溶液的溶质质量分数为。
③饱和KNO3溶液中混有少量KCl,可以采用的方法提纯KNO3。
④根据图中信息判断,以下说法错误的是(填字母)。
A.t2℃时,硝酸钾和氯化钾的溶解度相等
B.t3℃时,将20g硝酸钾放入50g水中,可形成饱和溶液
C.t1℃时,氯化钾的饱和溶液升温至t2℃溶质质量不变
三、综合题
-
21. 实验是进行科学探究的重要方式,根据下图实验回答问题。
 (1)、实验一:探究二氧化碳的性质。实验过程中观察到试管内液面上升且溶液变浑浊,原因是(用化学方程式表示)。(2)、实验二:探究燃烧条件。现有如下实验事实:
(1)、实验一:探究二氧化碳的性质。实验过程中观察到试管内液面上升且溶液变浑浊,原因是(用化学方程式表示)。(2)、实验二:探究燃烧条件。现有如下实验事实:①不通氧气时,冷水中的白磷不燃烧
②通氧气时,冷水中的白磷不燃烧
③不通氧气时,热水中的白磷不燃烧
④通氧气时,热水中的白磷燃烧
能证明可燃物需要接触氧气才能燃烧的实验事实是(填序号,下同);能证明温度必须达到可燃物的着火点才能燃烧的实验事实是。
(3)、实验三:验证质量守恒定律。称量镁条和石棉网的质量后,点燃镁条,反应结束,将所得物质与石棉网一起再次称量,发现质量减轻了,其原因是。如果要用该实验验证质量守恒定律,改进的措施是。22. 请根据下列各图中提供的信息回答问题: (1)、写出图中有标号仪器的名称:①;②。(2)、请写出用装置B制取氧气的化学方程式:。(3)、比较用过氧化氢溶液和用氯酸钾固体制取O2的方法,两者的共同点是(填字母)。
(1)、写出图中有标号仪器的名称:①;②。(2)、请写出用装置B制取氧气的化学方程式:。(3)、比较用过氧化氢溶液和用氯酸钾固体制取O2的方法,两者的共同点是(填字母)。a.发生装置相同 b.都可用MnO2做催化剂利 c.完全反应后剩余的固体成分相同
(4)、装置B,C都可用来制取二氧化碳,装置C与装置B相比,优点是。(5)、装置G中观察到蜡烛自下而上依次熄灭,说明二氧化碳具有的性质是。23. 全世界每年因锈蚀造成浪费的金属高达产量的20%以上,但铁锈蚀原理却在日常生活中被广泛应用,例如暖宝宝、食品脱氧剂等。小组同学对暖宝宝发热产生兴趣,展开探究。【资料卡片】某品牌暖宝宝的使用说明如图。
成分:铁粉、蛭石(保温)、高分子吸水树脂(供水)氯化钠、活性炭
内袋材料:微孔透气无纺布
注意事项:不使用时请勿拆开密封包装
(1)、暖宝宝“不使用时请勿拆开密封包装”的原因是。(2)、【猜想与假设】暖宝宝成分中氯化钠、活性炭可能加快铁锈蚀速率,使反应在短时间内放出大量的热。【实验方案】小组同学通过反应过程中温度的变化,探究氯化钠、活性炭及两者共同存在对铁锈蚀速率的影响,设计完成如下4组实验。(实验在密闭容器中进行)
实验编号
铁粉/g
水/mL
活性炭/g
氯化钠/g
测得10min内温度上升值/℃
1
2
5
0
0
0.1
2
2
5
m
0.1
3.1
3
2
5
0.2
0
22.0
4
2
5
0.2
0.1
56.3
【解释与结论】
对比实验1和2,可探究氯化钠对铁锈蚀速率的影响,表中m=。
(3)、为探究活性炭对铁锈蚀速率的影响,应选择的实验组合是(填实验编号)。(4)、综合以上4组实验得出结论:。(5)、【拓展与应用】小组同学运用该原理设计如下对比实验测定空气中氧气的含量。
装置B中发生反应的化学方程式为。
(6)、反应结束后,测得的数据如下表:装置
集气瓶内空气体积/mL
实验前烧杯内水的体积/mL
实验后烧杯内水的体积/mL
空气中氧气的体积百分含量
A
200.0
100.0
59.6
n%
B
200.0
100.0
66.0
17.0%
(7)、用装置B测得空气中氧气含量小于五分之一,产生该偏差的原因可能是____(填字母)。A、使用红磷的量太少 B、弹簧夹没有夹紧中间的乳胶管 C、点燃红磷后,缓慢将燃烧匙伸入瓶内(8)、结合反应原理和结果分析装置A的优点:、。四、计算题
-
24. 化学兴趣小组整理药品时,发现一瓶标签受损的稀盐酸。为测定该稀盐酸的溶质质量分数,同学们进行了下图的实验(所选石灰石中的杂质不溶于水,也不与其他物质反应;生成气体全部逸出)。

请完成下列问题:
(1)、生成二氧化碳的质量为g:(2)、计算稀盐酸的溶质质量分数(写出计算过程)。