山西省太原市2022-2023学年高三上学期期末考试化学试题
试卷更新日期:2023-02-17 类型:期末考试
一、单选题
-
1. 党的二十大报告中提出:“我们要推进生态优先、节约集约、绿色低碳发展”。下列做法不符合这一理念的是A、使用纤维素作为具有强吸湿性的可再生材料 B、积极推动大型风电、光伏、制氢等可再生能源基地建设 C、使用聚乙烯制作的塑料包装袋、塑料胶带、一次性塑料编织袋等 D、采用高比表面积和小粒径的制备的作为吸收材料2. 氮气储粮是指利用制氮设备,通过人为调节,使氮气浓度上升至95%~98%,从而有效保持粮食新鲜度,减少损失的一项储粮技术。下列说法错误的是A、由于粮堆中氧气浓度的减少,粮食中油脂的氧化速率减缓 B、这项技术与工业合成氨均属于氮的固定 C、标准状况下,11.2L氮气中含有的共用电子对数目为 D、与低温储粮、二氧化碳气调相比,氮气储粮的经济优势更加显着3. 吸湿性强,常被用作气体和液体的干燥剂,它甚至可以使硝酸脱水:。下列说法正确的是A、第一电离能: B、电负性: C、离子半径: D、沸点:4. 下列化学用语表示正确的是A、乙酸的分子式: B、氧原子的轨道表示式:
 C、质量数为23的钠原子:
D、的电子式:
C、质量数为23的钠原子:
D、的电子式: 5. 部分含铁物质的分类与相应化合价的关系如图所示。下列推断不合理的是
5. 部分含铁物质的分类与相应化合价的关系如图所示。下列推断不合理的是 A、a可与e反应生成b B、b既可被氧化,也可被还原 C、a与稀硝酸恰好反应,生成只含e的溶液 D、可存在b→c→d→e→b的循环转化关系6. “宏观辨识与微观探析”是化学学科核心素养之一,下列反应事实与所给方程式相符的是A、用硫酸锌溶液电镀锌的阴极反应: B、碳酸氢钠溶液中加入过量氢氧化钡溶液生成白色沉淀: C、溶液中滴加稀硝酸产生气体: D、浓硝酸用棕色瓶保存的原因:7. 核酸检测所用的红色液体学名叫病毒保存液,其主要成分为盐类、氨基酸、维生素、葡萄糖等,可以有效保护病毒蛋白不被破坏,有利于提高检测的准确性。下列说法正确的是A、检验病毒保存液中是否含有钠盐,用洁净的铂丝蘸取病毒保存液灼烧,观察焰色 B、检验病毒保存液中是否含有蛋白质,加热后,向其中滴加浓硝酸,观察颜色变化 C、为检验葡萄糖分子中是否含有羟基,向盛有葡萄糖溶液的烧杯中加入一小粒金属钠 D、为探究维生素C的还原性,向盛有2mL黄色氯化铁溶液的试管中滴加浓的鲜橙汁,观察颜色变化8. 二氧化碳加氢制甲醇的总反应可表示为: , 该反应一般认为通过如下步骤来实现:
A、a可与e反应生成b B、b既可被氧化,也可被还原 C、a与稀硝酸恰好反应,生成只含e的溶液 D、可存在b→c→d→e→b的循环转化关系6. “宏观辨识与微观探析”是化学学科核心素养之一,下列反应事实与所给方程式相符的是A、用硫酸锌溶液电镀锌的阴极反应: B、碳酸氢钠溶液中加入过量氢氧化钡溶液生成白色沉淀: C、溶液中滴加稀硝酸产生气体: D、浓硝酸用棕色瓶保存的原因:7. 核酸检测所用的红色液体学名叫病毒保存液,其主要成分为盐类、氨基酸、维生素、葡萄糖等,可以有效保护病毒蛋白不被破坏,有利于提高检测的准确性。下列说法正确的是A、检验病毒保存液中是否含有钠盐,用洁净的铂丝蘸取病毒保存液灼烧,观察焰色 B、检验病毒保存液中是否含有蛋白质,加热后,向其中滴加浓硝酸,观察颜色变化 C、为检验葡萄糖分子中是否含有羟基,向盛有葡萄糖溶液的烧杯中加入一小粒金属钠 D、为探究维生素C的还原性,向盛有2mL黄色氯化铁溶液的试管中滴加浓的鲜橙汁,观察颜色变化8. 二氧化碳加氢制甲醇的总反应可表示为: , 该反应一般认为通过如下步骤来实现:①
②
若反应①为慢反应,下图中能体现上述反应能量变化的是( )
A、 B、
B、 C、
C、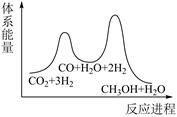 D、
D、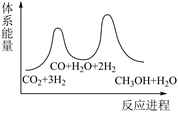 9. 设为阿伏加德罗常数的值,下列说法正确的是A、120 g晶体中含有的离子数为 B、1L 盐酸与足量反应转移电子数为 C、标准状况下,22.4L氯气溶于足量水转移电子数为 D、常温下,碳酸钠溶液中含有的阴离子数大于10. 镁、海水、溶解氧可构成原电池,为水下小功率设备长时间供电,其原理如下图所示。但该电池负极存在析氢副反应和负极活性衰减等问题。下列说法错误的是
9. 设为阿伏加德罗常数的值,下列说法正确的是A、120 g晶体中含有的离子数为 B、1L 盐酸与足量反应转移电子数为 C、标准状况下,22.4L氯气溶于足量水转移电子数为 D、常温下,碳酸钠溶液中含有的阴离子数大于10. 镁、海水、溶解氧可构成原电池,为水下小功率设备长时间供电,其原理如下图所示。但该电池负极存在析氢副反应和负极活性衰减等问题。下列说法错误的是 A、由于溶解氧浓度低,故需增大电极与海水的接触面积 B、该电池使用时,需要定期补充正极和负极反应物 C、负极活性衰减的可能原因是生成的覆盖了电极 D、析氢副反应可以表示为11. 阿魏酸(结构如图)存在于蔬菜和坚果中,在化妆品中主要作为收敛剂、抗炎剂。下列说法错误的是
A、由于溶解氧浓度低,故需增大电极与海水的接触面积 B、该电池使用时,需要定期补充正极和负极反应物 C、负极活性衰减的可能原因是生成的覆盖了电极 D、析氢副反应可以表示为11. 阿魏酸(结构如图)存在于蔬菜和坚果中,在化妆品中主要作为收敛剂、抗炎剂。下列说法错误的是 A、分子式为 , 碳原子有两种杂化方式 B、可以使的溶液、酸性高锰酸钾溶液褪色 C、阿魏酸最多可与发生反应 D、分子中所有碳原子一定处于同一平面内12. 有机小分子X通过选择性催化聚合可分别得到聚合物Y和Z
A、分子式为 , 碳原子有两种杂化方式 B、可以使的溶液、酸性高锰酸钾溶液褪色 C、阿魏酸最多可与发生反应 D、分子中所有碳原子一定处于同一平面内12. 有机小分子X通过选择性催化聚合可分别得到聚合物Y和Z
下列说法错误的是
A、X的结构简式是 B、Y和Z中均含有酯基
C、Y和Z均通过加聚反应制得
D、Y和Z的链节中C、H、O的原子个数比相同
13. 乙烯催化氧化制乙醛的一种反应机理如下图(部分产物已略去),下列叙述错误的是
B、Y和Z中均含有酯基
C、Y和Z均通过加聚反应制得
D、Y和Z的链节中C、H、O的原子个数比相同
13. 乙烯催化氧化制乙醛的一种反应机理如下图(部分产物已略去),下列叙述错误的是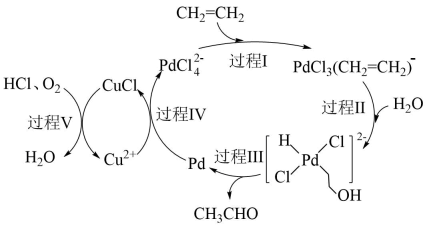 A、在反应中是中间产物 B、反应过程伴随非极性键的断裂和极性键的形成 C、过程Ⅴ可表示为 D、以上过程的总反应为14. 用如图装置(相关试剂、夹持、防倒吸和加热装置已略)进行实验,其中②中现象不能证明①中产物生成或反应的是
A、在反应中是中间产物 B、反应过程伴随非极性键的断裂和极性键的形成 C、过程Ⅴ可表示为 D、以上过程的总反应为14. 用如图装置(相关试剂、夹持、防倒吸和加热装置已略)进行实验,其中②中现象不能证明①中产物生成或反应的是
选项
①中反应
②中检测试剂及现象
A
浓硝酸分解生成
淀粉-KI溶液变蓝
B
将铁粉、炭粉和溶液的混合物放置一段时间
导管中倒吸一段水柱
C
加热冰醋酸、无水乙醇和浓硫酸的混合物
饱和溶液的上方有无色油状液体产生
D
与乙醇溶液生成丙烯
溴水褪色
A、A B、B C、C D、D15. 高铁酸钾是高效多功能的新型非氯绿色消毒剂,主要用于饮用水处理。工业上制备的一种方法是向溶液中通入氯气,然后再加入溶液:①(未配平);
②。
下列说法错误的是
A、在杀菌消毒过程中还可以净水 B、反应①中每消耗 , 吸收标准状况下22.4L(忽略和水的反应) C、若反应①中 , 则还原产物与氧化产物的物质的量之比为 D、若反应①的氧化产物只有 , 则得到时最少消耗16. 向碘水中加入KI溶液,发生反应: , 充分反应达平衡后,测得微粒浓度如下:微粒
浓度
下列说法错误的是( )
A、向所得溶液中加入 , 振荡静置,水层降低 B、向所得溶液中加入等体积水, C、该温度下,反应的 D、配制碘水时,加入少量KI,可促进的溶解17. X、Y、Z、W是原子序数依次增大的前20号元素,由它们组成的化合物的结构式如图,其中X在宇宙中含量最丰富,Y与Z位于相邻主族,下列说法正确的是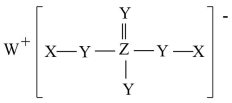 A、W与Y形成的二元化合物不可能具有强氧化性 B、Z的最高价氧化物对应的水化物可能为强酸 C、上述阴离子中的所有原子可能均为8电子稳定结构 D、X和Y组成的化合物可用于实验室制取Y的单质18. 已知常温下,。用的氨水滴定的一元酸HA的溶液,滴定过程中加入氨水的体积(V)与溶液中的关系如图所示。下列说法错误的是
A、W与Y形成的二元化合物不可能具有强氧化性 B、Z的最高价氧化物对应的水化物可能为强酸 C、上述阴离子中的所有原子可能均为8电子稳定结构 D、X和Y组成的化合物可用于实验室制取Y的单质18. 已知常温下,。用的氨水滴定的一元酸HA的溶液,滴定过程中加入氨水的体积(V)与溶液中的关系如图所示。下列说法错误的是 A、HA为强酸,a=10 B、水的电离程度:M点>N点 C、常温下,反应的平衡常数 D、当滴入氨水时,溶液中存在:
A、HA为强酸,a=10 B、水的电离程度:M点>N点 C、常温下,反应的平衡常数 D、当滴入氨水时,溶液中存在:二、综合题
-
19. 胡粉在中国古代曾用于药物和化妆品等行业,主要成分为2PbCO3·Pb(OH)2 , 常含有铁、银、铜、锡等金属的氧化物杂质。某同学设计了如下三个实验方案测定胡粉的纯度:(1)、方案Ⅰ.称取一定质量样品,加入足量的稀硫酸,测定实验前后装置丙的增重来确定胡粉的纯度。

写出装置乙中2PbCO3·Pb(OH)2发生反应的离子方程式(已知生成白色沉淀):。
(2)、仪器接口的连接顺序为(装置可以重复使用)a→ , 装置丁的作用是。(3)、实验前后均需要打开止水夹,通入一段时间空气,实验结束时通入空气的目的是。(4)、方案Ⅱ.实验原理:实验步骤:①称取胡粉样品a g;②将样品充分煅烧,冷却后称量;③重复操作②,测得剩余固体质量为b g。
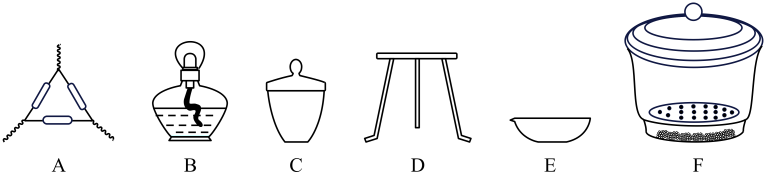
下列仪器,方案Ⅱ不需要使用的是(用对应仪器的字母填空)。
 (5)、如何确定样品已完全分解?(6)、方案Ⅲ.实验步骤为:
(5)、如何确定样品已完全分解?(6)、方案Ⅲ.实验步骤为:①如图所示,连接好装置并检查气密性;
②向量气管中注入饱和NaHCO3溶液,并调节两侧液面相平,称取胡粉样品m g于锥形瓶中,打开分液漏斗活塞,将稀硫酸滴入锥形瓶中;
③待反应完全后, , 调节B与C中液面相平,平视读数,测得气体体积为VmL。
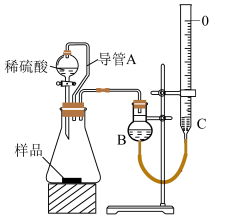
③中所留空的操作为 , 导管A的作用为。
20. 工业上以黄铁矿和纯碱为原料制备无水和焦亚硫酸钠()的主要流程如图。
已知电离常数:
回答下列问题:
(1)、黄铁矿的主要成分是(填化学式)。(2)、若“吸收”过程中有气体生成,该反应的化学方程式为。(3)、产品1是 , 常温下其水溶液的7(填“>”、“<”或“=”);“气流干燥”湿料时温度不宜过高的原因是。(4)、①生产 , 通常是由过饱和溶液经结晶脱水制得。写出该过程的化学方程式:。②可用作食品的抗氧化剂。在测定某葡萄酒中残留量时,取葡萄酒样品,用的碘标准液滴定至终点,消耗。滴定反应的离子方程式为 , 该样品中的残留量为(以计)。
21. 以、为原料合成涉及的主要反应过程中物质的能量变化如图1所示,回答下列问题: (1)、已知:Ⅰ.
(1)、已知:Ⅰ.Ⅱ.
Ⅲ.
Ⅳ. 。
则:。
(2)、0.1MPa时向密闭容器中充入和 , 发生以上反应,温度对催化剂性能影响如图2所示,已知的选择性。
①工业生产综合各方面的因素,反应选择800℃的主要原因是。
②已知对可逆反应存在如下关系:(其中R为常数),结合具体反应说明的转化率随着温度的升高始终高于转化率的原因可能是。
③采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高的选择性。在773K,乙烷平衡转化率为9.1%,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到11.0%。结合具体反应说明选择性膜吸附提高的选择性的可能原因是。
④在800℃时, , 充入一定容积的密闭容器中,在一定催化剂存在的条件下只发生反应Ⅲ,初始压强为 , 一段时间达到平衡,产物的物质的量之和与剩余反应物的物质的量之和相等,该温度下平衡时体系的压强为(用含的代数式表示,下同),反应Ⅲ的平衡常数(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,列出计算式)。
22. 氧化镓是一种新型超宽窄带半导体材料,由于自身的优异性能,在紫外探测、高频功率器件等领域吸引了越来越多的关注和研究,中国科技部将其列入“十四五研发计划”,让第四代半导体获得更广泛的关注。回答下列问题:(1)、基态原子最外层电子排布式为。(2)、①氧化镓的熔点为1740℃,氧化钙的熔点为2613℃,但有的离子晶体如(硝酸乙基铵)的熔点只有12℃。中N原子的杂化轨道类型是 , 离子的空间结构为 , 该物质中所含化学键类型:(填字母)。A.金属键 B.离子键 C.共价键 D.范德华力 E.σ键
②第一电离能:AlMg(填“>”或“<”),其原因是。
(3)、锑化物是一种超窄禁带半导体材料,可用于红外探测其晶胞结构如图所示。若该晶体的密度为 , 设Ga和Sb的原子半径分别为和 , 则原子的空间占有率为(列出计算表达式,的摩尔质量为 , 阿伏加德罗常数的值为)。 23. 乙肝新药的中间体化合物J的一种合成路线如图:
23. 乙肝新药的中间体化合物J的一种合成路线如图:
已知:

(重氮甲烷)
回答下列问题:
(1)、A的化学名称为。(2)、D中含氧官能团的名称为。(3)、已知反应②中还有生成,则M的结构简式为。(4)、写出反应③的化学方程式:。E→F的反应类型是。(5)、由G生成J的过程中,设计反应④和⑤的目的是。(6)、化合物Q是A的同系物,相对分子质量比A的多14;Q的同分异构体中,同时满足下列条件(不考虑立体异构):a.能与溶液发生显色反应;
b.能发生银镜反应;
c.苯环上的取代基数目小于4。
其中核磁共振氢谱有五组峰,且峰面积之比为的结构简式为。