山东省青岛市胶州市2022-2023学年高三上学期期末学业水平检测化学试题
试卷更新日期:2023-02-17 类型:期末考试
一、单选题
-
1. 2022年第53个世界地球日主题是珍爱地球人与自然和谐共生,引导全社会树立尊重自然、顺应自然、保护自然的生态文明理念。下列相关说法或做法正确的是A、聚氯乙烯塑料易造成环境污染,可采用焚烧法处理 B、研发催化剂将还原为甲醇是促进碳中和的有效途径 C、对废旧电池必须进行分类回收,并集中进行深埋处理 D、减少及碳氢化合物的排放以防止温室效应和酸雨的形成
-
2. 下列有关主要应用不涉及氧化还原反应的是A、和混合液可用于除铁锈 B、溶液可用于制作铜印刷电路板 C、可用于天然水的杀菌消毒和净化 D、可用于呼吸面具和潜水艇中的氧气的供给
-
3. 下列实验原理与装置能达到实验目的的是
 A、用装置Ⅰ测定化学反应速率 B、用装置Ⅱ可制得NaHCO3晶体 C、用装置Ⅲ可验证丙烯醛中含有碳碳双键 D、用装置Ⅳ所示方法可检验该装置的气密性
A、用装置Ⅰ测定化学反应速率 B、用装置Ⅱ可制得NaHCO3晶体 C、用装置Ⅲ可验证丙烯醛中含有碳碳双键 D、用装置Ⅳ所示方法可检验该装置的气密性 -
4. 化学与生产、生活密切相关。下列说法正确的是A、含碘盐中的仅用淀粉KI溶液就可检验 B、人体所需的营养物质糖类、油脂、蛋白质都属于高分子 C、核电站反应堆所用铀棒中含有的与互为同素异形体 D、食品包装袋内的“干燥剂”CaO是碱性氧化物,其水化物属于强电解质
-
5. 对羟基肉桂酸甲酯M具有高光敏性和强效导电性等优良特性,是一种优良的触摸屏和高端光纤材料,结构简式如图所示。下列有关说法错误的是
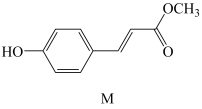 A、M的分子式为 B、M能发生取代、加成、氧化等反应 C、1 mol M一定条件下能被5 mol 还原 D、M所含所有碳原子可能处于同一平面内
A、M的分子式为 B、M能发生取代、加成、氧化等反应 C、1 mol M一定条件下能被5 mol 还原 D、M所含所有碳原子可能处于同一平面内 -
6. 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子最高能级有3个未成对电子,Z与X形成的化合物常用于汽车的安全气囊,Y、W处于同一主族,下列说法错误的是A、原子的半径:Z>W>X>Y B、简单氢化物的还原性、水溶液的酸性:W>Y C、化合物中存在离子键、非极性共价键 D、同周期中第一电离能小于X的元素有4种
-
7. 已知CuCl为白色粉末,不溶于乙醇,微溶于水,溶于浓盐酸或NaCl浓溶液,露置在空气中易生成绿色。向溶液中加入、NaCl可制得CuCl,CuCl产率与NaCl的用量有如图所示关系,下列说法错误的是
 A、属于碱式盐,称作碱式氯化铜 B、CuCl生成反应中氧化剂与还原剂物质的量比为1:2 C、一定范围内,CuCl产率随增大而增大,与其溶解平衡移动有关 D、分离所得CuCl需立即醇洗的目的是快速除去水的同时防止其被空气氧化
A、属于碱式盐,称作碱式氯化铜 B、CuCl生成反应中氧化剂与还原剂物质的量比为1:2 C、一定范围内,CuCl产率随增大而增大,与其溶解平衡移动有关 D、分离所得CuCl需立即醇洗的目的是快速除去水的同时防止其被空气氧化 -
8. (光气)、(亚硫酰氯)、均为稳定结构的氯化试剂,可与反应制备 , 下列说法错误的是A、和分子的空间构型相同 B、上述三个制备反应均为非氧化还原反应 C、、中C原子和S原子的杂化方式相同 D、与基态Ti原子同周期且未成对电子数相同的元素有3种
-
9. 硫化钠可广泛用于染料、医药行业。工业常用芒硝()和煤粉在高温下生产硫化钠,所得硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。实验室中常用95%乙醇重结晶纯化硫化钠粗品,溶解回流装置如图所示(夹持装置略去)。已知硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。下列说法正确的是
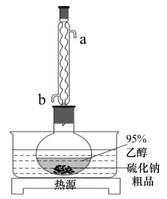 A、球形冷凝管应a口进水,b口出水 B、回流加热前必须先加入碎瓷片以防止暴沸 C、回流时间过长会导致溶剂减少及被氧化 D、回流结束后需先停止通入冷凝水,再关闭热源开关
A、球形冷凝管应a口进水,b口出水 B、回流加热前必须先加入碎瓷片以防止暴沸 C、回流时间过长会导致溶剂减少及被氧化 D、回流结束后需先停止通入冷凝水,再关闭热源开关 -
10. 工业上以软锰矿(主要成分为)为主要原料制备高锰酸钾()的方法如下:
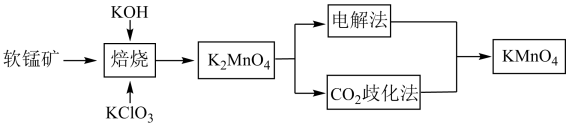
已知:①熔烧时有和KCl生成。
②歧化法:调溶液pH至弱碱性,歧化生成和
下列说法正确的是
A、熔烧时所用坩锅的材质可以选用 B、熔烧时理论上每生成1 mol 转移个电子 C、电解法与歧化法的理论产率之比为3:2 D、采用歧化法时,可将滤液蒸发结晶得到固体 -
11. 由下列实验操作、现象得不出相应结论的是
选项
实验操作
现象
结论
A
将固体加入酸性溶液中,充分振荡
溶液变为紫红色
氧化性:
B
用pH计测定室温下溶液pH:① ②
pH值①<②
碳酸酸性弱于醋酸
C
石蜡油加强热、产生的气体通入的溶液
溶液橙红色褪去
气体中含有不饱和烃
D
向NaClO溶液中滴加酚酞试液
溶液先变红后褪色
NaClO发生水解反应
A、A B、B C、C D、D -
12. 电位滴定是利用溶液电位突变指示终点的滴定法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。常温下,用盐酸标准溶液测定V mL某纯碱样品溶液中的含量(其它杂质不参与反应),电位滴定曲线如图所示。下列说法错误的是
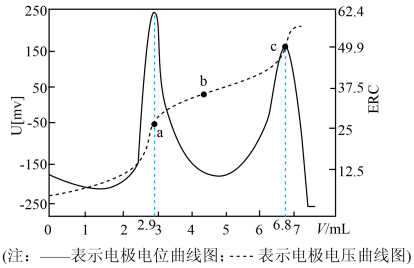 A、水的电离程度: B、a点溶液中存在关系: C、V mL该纯碱样品溶液中含有的质量为0.084c g D、c点指示的是第二滴定终点,b到c过程中存在
A、水的电离程度: B、a点溶液中存在关系: C、V mL该纯碱样品溶液中含有的质量为0.084c g D、c点指示的是第二滴定终点,b到c过程中存在
二、多选题
-
13. 环己甲醇常用作有机合成的中间体,环己甲酸戊酯(X)经如下反应可生成环己甲醇(Y)。
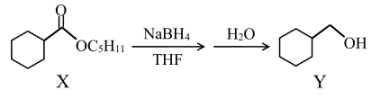
下列说法正确的是
A、X和Y均有对映异构体 B、Y的核磁共振氢谱会出现6组峰 C、X属于环己甲酸酯结构的同分异构体共有8种(不考虑立体异构) D、比Y多1个碳的Y的同系物共有3种结构 -
14. 我国科学家研究化合物M(s)催化氢化机理,其中由化合物M(s)生成化合物N(s)过程的机理和相对能量曲线如下图所示(已知:)。TS1、TS2均为过渡态。下列说法正确的是
 A、过程P→N为化合物M生成化合物N的决速步骤 B、降温、使用高效催化剂可以提高氢化的平衡转化率 C、化合物M催化氢化反应过程中一定有Fe-O键的生成和断裂 D、该过程的热化学方程式为:
A、过程P→N为化合物M生成化合物N的决速步骤 B、降温、使用高效催化剂可以提高氢化的平衡转化率 C、化合物M催化氢化反应过程中一定有Fe-O键的生成和断裂 D、该过程的热化学方程式为: -
15. 应对新冠肺炎疫情时所采取的措施是对环境进行彻底消毒,二氧化氯( , 黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备的原理如图所示,下列说法错误的是
 A、装置工作时,a与电源的正极连接,b极附近溶液pH逐渐减小 B、a极上发生的电极反应为 C、发生器内发生反应 D、当有0.3 mol阴离子通过离子交换膜时,理论上产生2.24 L(STP)
A、装置工作时,a与电源的正极连接,b极附近溶液pH逐渐减小 B、a极上发生的电极反应为 C、发生器内发生反应 D、当有0.3 mol阴离子通过离子交换膜时,理论上产生2.24 L(STP)
三、综合题
-
16. 铜是人类广泛使用的一种金属,含铜物质有着广泛应用。回答下列问题:(1)、一种由Cu、In、Te组成的高熵合金具有优良的热电性能,四方晶系的晶胞结构如图1所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,1号Cu原子的分数坐标为(0,0,0)。

①基态Cu原子的价电子排布式为 , Te在元素周期表中位置为。
②;2号Te原子的分数坐标为;晶体中与单个In键合的Te有个;空间构型为正四面体的体心原子为。
(2)、邻氨基吡啶的铜配合物(结构简式如图2甲)在有机不对称合成中起催化诱导效应。
①邻氨基吡啶(结构简式如图2乙)中N原子的价层孤电子对占据。
a.sp杂化轨道 b.杂化轨道 c.杂化轨道 d.杂化轨道
②邻氨基吡啶的铜配合物中的配位数是。
-
17. 磷化铝是一种广谱性熏蒸杀虫剂,与水反应产生高毒的气体,可用于粮食熏蒸杀虫。实验室可采用以下装置测定粮食中残留的磷化物含量:

已知:①易自然,具有强还原性;
②焦性没食子酸学名连苯三酚,白色固体,溶于水,易被氧化,在空气中易变色;
③食品安全标准规定:粮食中磷化物(以计)的含量低于时合格。
回答下列问题:
(1)、仪器a的名称是;打开前,需先打开 , 用抽气泵抽一段时间空气,主要目的是。(2)、装置C中反应的化学方程式为。(3)、装置B的作用是;多孔玻璃泡的作用是。(4)、装置D中被氧化为磷酸,发生反应的离子方程式为。(5)、实验结束,将D中溶液及D的洗涤液转移至锥形瓶中,用 标准溶液进行滴定,滴定达终点时,共消耗标准溶液10.00 mL。①该滴定达终点的判断方法是;
②该原粮中磷化物的含量是。
-
18. 草酸钴在化学中应用广泛,可以用于制取催化剂和指示剂。以铜钴矿石[主要成分为CoO(OH)、、和 , 还有少量、NiO]为原料制取草酸钴晶体(化学式 , 式量为183)的工艺流程如下:

已知:部分物质的溶度积常数见下表(离子浓度c≤10-5mol/L视为该离子沉淀完全)。
物质
FeS
CuS
回答下列问题:
(1)、“浸泡”前,对铜钴矿石进行粉碎处理的目的是;“滤渣1”的成分是。(2)、“浸泡”过程中CoO(OH)发生氧化还原反应的离子方程式为。(3)、“滤液1”中加入FeS的作用是。(4)、“滤液2”中加入的作用是调节pH,若 , 则应调节pH的范围是。(5)、加入萃取剂萃取分离和 , 原理为。萃取剂与溶液的体积比()对溶液中和的萃取率影响如图所示,则的萃取率对应曲线(填标号),在强酸性介质中“反萃取”能使有机相中再生。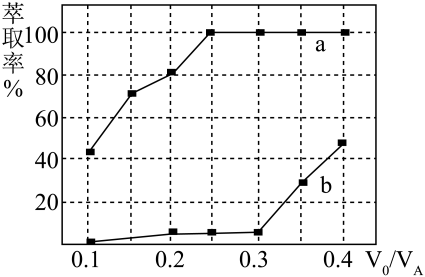 (6)、钴的氧化物常用作颜料或反应催化剂,可以由草酸钴晶体在空气中加热制取,取36.6 g草酸钴晶体,在空气中加热至恒重,得到CoO与的混合物15.8 g,该混合物中CoO与的物质的量之比为。
(6)、钴的氧化物常用作颜料或反应催化剂,可以由草酸钴晶体在空气中加热制取,取36.6 g草酸钴晶体,在空气中加热至恒重,得到CoO与的混合物15.8 g,该混合物中CoO与的物质的量之比为。 -
19. 褪黑素是由松果体产生的一种胺类激素,在调节昼夜节律及睡眠-觉醒方面发挥重要作用。某研究小组以乙炔为原料,设计合成路线如下(部分反应条件已省略):

已知:
①褪黑素结构为:
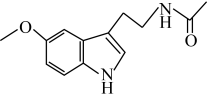
②

③无水乙酸钠在碱石灰作用下发生反应:
回答下列问题:
(1)、A的名称为;B→C的反应类型为。(2)、D中所含官能团的名称为;E的结构简式为。(3)、写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式。ⅰ.含有3个六元环,其中1个是苯环;
ⅱ.含有
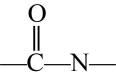 结构,不含N—H键;
结构,不含N—H键;ⅲ.含有4种不同化学环境的氢原子。
(4)、I→J反应的化学方程式为。(5)、已知: , 综合上述信息,写出由二氯甲烷和乙醇制备 的合成路线(无机试剂、有机溶剂任选)。
的合成路线(无机试剂、有机溶剂任选)。 -
20. 的排放主要来自于汽车尾气,研究处理对环境保护有着重要的意义。
回答下列问题:
(1)、有人利用反应 , 对NO进行处理。1050K、 , 1050K、 , 1200K、三种条件下,加入足量的活性炭和一定量的NO气体,测得NO的转化率随时间t变化关系如图所示。
①1200K、条件对应的曲线为(填字母标号),平衡时的体积分数为。
②b、c两条曲线最终重合的原因是。
③用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作)。在1050K、时,该反应的化学平衡常数(已知:气体分压=气体总压×体积分数)。
(2)、在汽车尾气的净化装置中CO和NO发生反应:。实验测得, , (、强为速率常数,只与温度有关)。①温度低,尾气的平衡转化率更高,则该反应的0(填“>”或“<”)。
②下图中(表示速率常数的负对数;T表示温度)所示①、②、③、④四条斜线中,能表示随变化关系的是斜线。
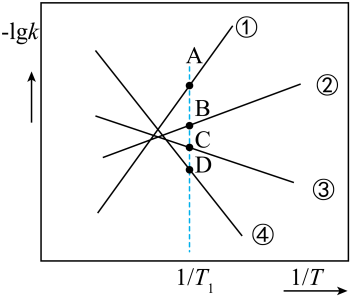
③图中A、B、C、D点的纵坐标分别为a+80、a+20、a-20、a-40,则温度时化学平衡常数。
