湖南省长沙市2022-2023学年高三上学期1月期末考试化学试题
试卷更新日期:2023-02-17 类型:期末考试
一、单选题
-
1. 湖南省有众多国家级非物质文化遗产,如湘绣、醴陵彩瓷、苗银锻造工艺、安化黑茶等。下列说法错误的是A、技艺精湛的湘绣,绣线分为丝线、线线、织花线、金银线等,其中丝线的主要成分是蛋白质 B、陶瓷的生产以黏土和石灰石为主要原料 C、苗族银饰锻制工艺需要使用较多的银质材料,银质材料在常温下化学性质比较稳定 D、安化黑茶制作中的发酵工序涉及了氧化还原反应2. 下列化学用语或图示表达错误的是A、原子核内中子数为20的氯原子: B、H2O的VSEPR模型
 C、二氧化碳的电子式:
C、二氧化碳的电子式: D、p-pπ键电子云轮廓图
D、p-pπ键电子云轮廓图 3. 下列实验装置、试剂选用或操作正确的是
3. 下列实验装置、试剂选用或操作正确的是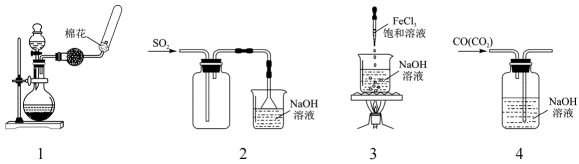 A、用图1所示装置制备并干燥收集 B、用图2所示装置收集 C、用图3所示装置制备氢氧化铁胶体 D、用图4所示装置除去气体中的4. 下列各组离子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式正确的是
A、用图1所示装置制备并干燥收集 B、用图2所示装置收集 C、用图3所示装置制备氢氧化铁胶体 D、用图4所示装置除去气体中的4. 下列各组离子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式正确的是选项
离子组
加入试剂
加入试剂后发生的离子反应
、、
、、
少量
、、
通入少量
、、
少量
A、A B、B C、C D、D5. 某农药杀虫剂中含有的成分如图。已知X、Y、Z、N、M为原子序数依次增大的短周期元素,已知Y、Z位于同一个周期,X、N位于同一主族。则下列说法错误的是 A、电负性大小排序: B、该化合物难溶于水,不能与水形成氢键 C、该化合物可与、等形成配合物 D、M的最高价氧化物的水化物形成的浓溶液能与M的气态氢化物反应6. 二甲基亚砜分子式为 , 常温下为无色无臭的有毒的透明液体,能溶于水、乙醇、丙醇、苯和氯仿等大多数有机物,被誉为“万能溶剂”。工业上常采用甲醇和硫化氢在-氧化铝作用下生成二甲基硫醚;二甲基硫醚再与二氧化氮反应生成二甲基亚砜。下列说法错误的是A、甲醇和硫化氢制二甲基硫醚的方程式为 B、二氧化氮可采用硫酸与亚硝酸钠反应制得,其中硫酸作还原剂 C、制二甲基亚砜的过程中二甲基硫醚中的硫元素失电子,被氧化 D、二甲基亚砜[(CH3)2SO]分子中存在键7. 五倍子是一种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。下列说法错误的是
A、电负性大小排序: B、该化合物难溶于水,不能与水形成氢键 C、该化合物可与、等形成配合物 D、M的最高价氧化物的水化物形成的浓溶液能与M的气态氢化物反应6. 二甲基亚砜分子式为 , 常温下为无色无臭的有毒的透明液体,能溶于水、乙醇、丙醇、苯和氯仿等大多数有机物,被誉为“万能溶剂”。工业上常采用甲醇和硫化氢在-氧化铝作用下生成二甲基硫醚;二甲基硫醚再与二氧化氮反应生成二甲基亚砜。下列说法错误的是A、甲醇和硫化氢制二甲基硫醚的方程式为 B、二氧化氮可采用硫酸与亚硝酸钠反应制得,其中硫酸作还原剂 C、制二甲基亚砜的过程中二甲基硫醚中的硫元素失电子,被氧化 D、二甲基亚砜[(CH3)2SO]分子中存在键7. 五倍子是一种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。下列说法错误的是 A、不能用酸性鉴别X和Y B、Y可以和水形成氢键 C、Z中所有碳原子不一定在同一平面上 D、与溶液反应时,最多可消耗8. 医学上利用碳酸锌 (ZnCO3)为原料,通过热分解来制备氧化锌,同时产生。氧化锌有六边纤锌矿和立方闪锌矿两种常见晶体结构,晶胞结构如图所示。下列说法正确的是
A、不能用酸性鉴别X和Y B、Y可以和水形成氢键 C、Z中所有碳原子不一定在同一平面上 D、与溶液反应时,最多可消耗8. 医学上利用碳酸锌 (ZnCO3)为原料,通过热分解来制备氧化锌,同时产生。氧化锌有六边纤锌矿和立方闪锌矿两种常见晶体结构,晶胞结构如图所示。下列说法正确的是 A、碳酸锌的组成元素在元素周期表中属于同区元素 B、晶体碳化硅与立方闪锌矿的晶胞结构相似,晶体中粒子之间的作用力也相同 C、六边纤锌矿和立方闪锌矿两种氧化锌晶体中,锌原子周围配位的氧原子数目不相同 D、六边纤锌矿和立方闪锌矿两种氧化锌晶体的空间利用率相同,晶胞密度也相同9. 钠碱脱硫液 (NaOH+Na2SO3)吸收一定量气体后,可通过如图装置实现再生,下列说法正确的是
A、碳酸锌的组成元素在元素周期表中属于同区元素 B、晶体碳化硅与立方闪锌矿的晶胞结构相似,晶体中粒子之间的作用力也相同 C、六边纤锌矿和立方闪锌矿两种氧化锌晶体中,锌原子周围配位的氧原子数目不相同 D、六边纤锌矿和立方闪锌矿两种氧化锌晶体的空间利用率相同,晶胞密度也相同9. 钠碱脱硫液 (NaOH+Na2SO3)吸收一定量气体后,可通过如图装置实现再生,下列说法正确的是 A、电极a应接电源的正极 B、膜应为阳离子交换膜 C、出液2的pH大于进液的pH D、电路中每通过2mol电子,阳极区域会产生11.2L的气体10. 从废旧铅蓄电池铅膏(主要含和等,还有少量的盐或氧化物等)中回收铅的工艺流程如下:
A、电极a应接电源的正极 B、膜应为阳离子交换膜 C、出液2的pH大于进液的pH D、电路中每通过2mol电子,阳极区域会产生11.2L的气体10. 从废旧铅蓄电池铅膏(主要含和等,还有少量的盐或氧化物等)中回收铅的工艺流程如下:
下列说法正确的是
A、和溶液反应的离子方程式: B、的主要作用是作氧化剂,氧化 C、对于离子,其中心原子的杂化方式为 D、电解时,阳极、阴极材料可分别用石墨、铅11. 25℃时,往溶液中滴入溶液,体系中、、溶液的体积与溶液pH的关系如图所示。下列说法正确的是 A、曲线②表示与溶液pH的关系 B、a点对应的溶液中: C、b点对应的溶液中: D、25℃时,HA的电离平衡常数的数量级为
A、曲线②表示与溶液pH的关系 B、a点对应的溶液中: C、b点对应的溶液中: D、25℃时,HA的电离平衡常数的数量级为二、多选题
-
12. 偶联反应(布赫瓦尔德-哈特维希反应)是合成芳胺的重要方法,反应机理如图(图中Ar表示芳香烃基,
 表示为副反应)。下列说法正确的是
表示为副反应)。下列说法正确的是 A、该变化过程中涉及到的有机反应类型仅限于取代和加成反应 B、该体系中3、5和8都是中间体 C、理论上
A、该变化过程中涉及到的有机反应类型仅限于取代和加成反应 B、该体系中3、5和8都是中间体 C、理论上 最多能消耗
最多能消耗 D、若原料用
D、若原料用 和
和 , 则可能得到的产物为
, 则可能得到的产物为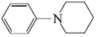 、
、 和
和 13. 一定温度和压强下,在两个容积均为1L的密闭容器中,充入一定量的A和B,发生反应:。相关反应数据如下表所示(已知在、下,A、B、C、D都是气态)
13. 一定温度和压强下,在两个容积均为1L的密闭容器中,充入一定量的A和B,发生反应:。相关反应数据如下表所示(已知在、下,A、B、C、D都是气态)容器编号
压强
温度
起始物质的量/mol
10s时物质的量/mol
A
B
C
Ⅰ
0.2
0.2
0.05
Ⅱ
0.2
0.2
0.05
Ⅲ
0.2
0.2
0.05
下列说法正确的是
A、该反应的 B、在容器Ⅲ中,A,B中至少有一种呈非气态 C、10s时,容器Ⅱ中的反应一定处于平衡状态 D、若起始时,向容器II中充入、、和 , 反应将向正反应方向进行14. 实验室可在硝酸铁晶体的催化下,用液氨与钠制备氨基钠(NaNH2)。如图装置(夹持、搅拌、尾气处理装置已省略)。已知:几乎不溶于液氨,易与水、氧气等反应。下列说法正确的是 A、加入钠之前向装置A中通入氨气的目的是增大液氨的量,提高钠的转化率 B、装置B的可以防止外界氧气和水蒸气进入装置 C、钠与液氨的反应方程式为 D、从反应后A的混合液中提纯氨基钠的操作方法是蒸发结晶
A、加入钠之前向装置A中通入氨气的目的是增大液氨的量,提高钠的转化率 B、装置B的可以防止外界氧气和水蒸气进入装置 C、钠与液氨的反应方程式为 D、从反应后A的混合液中提纯氨基钠的操作方法是蒸发结晶三、综合题
-
15. 碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是 , 还含有、、CuO等杂质)制取碳酸锰的流程如下图所示:

已知:①还原焙烧的主反应为
②氧化能力
可能用到的数据如下:
氢氧化物
开始沉淀pH
1.5
6.5
4.2
8.3
沉淀完全pH
3.7
9.7
7.4
9.8
根据要求回答下列问题:
(1)、基态锰原子的价层电子排布式为 , 中存在过氧键(—O—O—),请问中S的化合价为。(2)、在实验室进行步骤A操作时,可能用到的主要仪器为____。A、坩埚 B、蒸发皿 C、烧杯(3)、步骤E中调节 , 其目的是。(4)、步骤G发生的离子方程式为 , 若恰好沉淀完全时测得溶液中的浓度为 , 则。(5)、实验室可以用溶液来检验是否完全发生反应,请写出对应的离子方程式。16. 2021年中国政府工作报告中提出碳中和目标:在2030年前达到最高值,2060年前达到碳中和。因此对二氧化碳的综合利用显得尤为重要。(1)、通过电解的方式可实现对二氧化碳的综合利用。2022年7月香港中文大学王莹教授研发新型电解槽实现二氧化碳回收转化效率达到60%以上。双金属催化剂在某介质中催化转化为转化示意图如图所示,请写出其电极反应方程式:。
 (2)、在席夫碱(含“”有机物)修饰的纳米金催化剂上,直接催化加氢成甲酸。其反应历程如下图所示,其中吸附在催化剂表面上的物质用*标注。
(2)、在席夫碱(含“”有机物)修饰的纳米金催化剂上,直接催化加氢成甲酸。其反应历程如下图所示,其中吸附在催化剂表面上的物质用*标注。
该历程中起决速步骤的化学方程式是;
(3)、通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚 (CH3OCH3)也有广泛的应用。反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
①
②起始压强为4.0MPa、恒压条件下,通入氢气和二氧化碳的的情况下,不同温度下的平衡转化率和产物的选择性(选择性是指生成某物质消耗的占消耗总量的百分比)如下图所示:

当温度超过290℃,的平衡转化率随温度升高而增大的原因是。在上图中,在200℃时,若经过0.2s该平衡体系即达到平衡。计算分压的平均变化速率为;此时对于反应Ⅰ的(保留三位有效数字)
17. 某化学兴趣小组为了探究在相同条件下,草酸根()的还原性是否强于 , 进行了如下三个实验。【实验1】通过和在溶液中的反应比较和的还原性强弱。实验操作与现象如下:
在避光处,向溶液中缓慢加入溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤后得到翠绿色溶液和翠绿色晶体,并留存翠绿色溶液a待用。
已知:Ⅰ.草酸 ()为二元弱酸。
Ⅱ.三水三草酸合铁酸钾[]为翠绿色晶体,光照易分解。其水溶液中存在: 请回答:
(1)、实验室配制溶液时若不加盐酸一起进行配制,常常得到红褐色的溶液,请用离子方程式说明原因。(2)、取实验1中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是。(3)、经检验,翠绿色晶体为。为了确认实验1中是否发生了氧化还原反应,取少量翠绿色溶液a,向其中滴加(填序号)末见明显现象。A.少量KSCN溶液 B.少量溶液 C.少量HCl溶液
该小组据此判断氧化还原没有发生。请简述未发生氧化还原反应的原因。
(4)、【实验2】通过比较与、反应的难易,判断二者还原性的强弱。实验操作与现象如下:①向溶液中加入溶液,过滤,立即产生黄色沉淀;
②洗涤①中的黄色沉淀(已知:为黄色固体,微溶于水,可溶于强酸),向其中加入过量的溶液,振荡,静置,反应剧烈放热,产生大量的红褐色沉淀和无色气体;
③待充分反应后,向其中加入稀硫酸,调节pH约为4,得到翠绿色溶液。请回答:
证明被氧化的实验现象是。
(5)、以上现象能否说明没有被氧化。请判断并说明理由:。(6)、【实验3】利用电化学装置进行实验,其装置如图:
用溶液、溶液和其他试剂,设计图的装置进行实验比较和的还原性强弱,一段时间的实验后,该小组依据实验所观察到的现象做出了比还原性强的实验结论。则下列实验现象描述能支持这一结论的有:____。(填序号)
A、电流表指针发生偏转 B、取左侧烧杯内溶液滴加氢氧化钠溶液,出现红褐色沉淀 C、取左侧烧杯内溶液滴加溶液,有蓝色沉淀生成 D、右侧烧杯的电极附近有无色气泡生成,经实验,该气体能使澄清石灰水变浑浊。18. 布洛芬为非甾体抗炎药,可用于缓解疼痛,其合成路线如图:请回答下列问题: (1)、A的名称是 , B生成C的反应类型为 , D中所含官能团的名称是。(2)、D中含有手性碳原子的个数为。(3)、试剂X是新制的氢氧化铜悬浊液,请写出E与试剂X反应的化学方程式(4)、G是比F少5个的芳香族化合物,G的同分异构体中,同时满足如下条件的有种(不考虑立体异构)。其中核磁共振氢谱有四组峰,峰面积之比为的结构简式为。
(1)、A的名称是 , B生成C的反应类型为 , D中所含官能团的名称是。(2)、D中含有手性碳原子的个数为。(3)、试剂X是新制的氢氧化铜悬浊液,请写出E与试剂X反应的化学方程式(4)、G是比F少5个的芳香族化合物,G的同分异构体中,同时满足如下条件的有种(不考虑立体异构)。其中核磁共振氢谱有四组峰,峰面积之比为的结构简式为。条件:(a)苯环上的取代基无环状结构;
(b)能与自身2倍物质的量的反应。
(5)、根据上述信息和所学知识,写出以 、、为原料合成
、、为原料合成 的路线(其他试剂任选)。
的路线(其他试剂任选)。