河北省邯郸市2022-2023学年高三上学期期末考试化学试题
试卷更新日期:2023-02-17 类型:期末考试
一、单选题
-
1. 衡水老白干已有1900多年的酿造历史,是一种采用“小麦中温大曲、地缸发酵、续茬配料、混蒸混烧”等工艺生产的白酒。下列说法错误的是A、小麦中含有的淀粉是基本营养物质之一 B、“曲”中含有“淀粉→乙醇”转化过程的催化剂 C、葡萄糖是酿酒发酵过程中的一种中间产物 D、可用分液的方法将酒中的水分离出去以提高酒精浓度2. 芳樟醇具有铃兰香气,可从香菜中提取,是目前世界上用量最大的香料,其结构简式如图。关于该化合物,下列说法正确的是
 A、芳樟醇分子结构中含有手性碳原子 B、分子中C原子有sp、sp2、sp3三种杂化方式 C、与Br2的CCl4溶液反应可能得到2种加成产物(不考虑立体异构) D、既可发生加聚反应也可发生缩聚反应3. 商周青铜器由铜、锡、铅合金制成,出土的青铜器表面会有蓝绿色锈斑[主要成分为Cu(OH)2·xCuCO3],下列说法错误的是A、青铜的熔点比纯铜低、更易铸造 B、“红斑绿锈”的形成过程中有O2和CO2参与 C、铜器上嵌金或银更为美观且耐腐蚀 D、使用稀硫酸可以溶解青铜器表面的绿锈4. 配制一定物质的量浓度的NaOH溶液并用来滴定白醋样品,下列图示操作不能达到实验目的的是
A、芳樟醇分子结构中含有手性碳原子 B、分子中C原子有sp、sp2、sp3三种杂化方式 C、与Br2的CCl4溶液反应可能得到2种加成产物(不考虑立体异构) D、既可发生加聚反应也可发生缩聚反应3. 商周青铜器由铜、锡、铅合金制成,出土的青铜器表面会有蓝绿色锈斑[主要成分为Cu(OH)2·xCuCO3],下列说法错误的是A、青铜的熔点比纯铜低、更易铸造 B、“红斑绿锈”的形成过程中有O2和CO2参与 C、铜器上嵌金或银更为美观且耐腐蚀 D、使用稀硫酸可以溶解青铜器表面的绿锈4. 配制一定物质的量浓度的NaOH溶液并用来滴定白醋样品,下列图示操作不能达到实验目的的是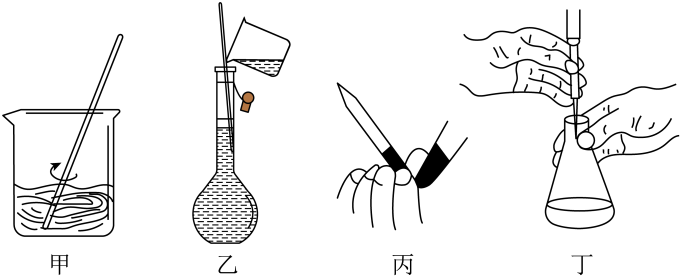 A、操作甲:用玻璃棒搅拌以加速NaOH固体溶解 B、操作乙:配制NaOH溶液时向容量瓶中加水至刻度线 C、操作丙:弯曲并挤压胶管中玻璃珠以排除滴定管尖端气泡 D、操作丁:滴定时滴入液体和摇动锥形瓶同时进行5. 科学家用高速轰击获得 , 核反应为+→(未配平),下列说法错误的是A、Ca位于元素周期表中的s区 B、基态Ca原子中没有未成对电子 C、和互为同位素 D、表示有1个质子、没有中子的H原子6. 如图某化合物(结构如图)水解所得产物可用于制备医用橡胶,其中X、Y、Z、W是原子序数依次增大的四种短周期主族元素,X与W不在同一主族。下列说法错误的是
A、操作甲:用玻璃棒搅拌以加速NaOH固体溶解 B、操作乙:配制NaOH溶液时向容量瓶中加水至刻度线 C、操作丙:弯曲并挤压胶管中玻璃珠以排除滴定管尖端气泡 D、操作丁:滴定时滴入液体和摇动锥形瓶同时进行5. 科学家用高速轰击获得 , 核反应为+→(未配平),下列说法错误的是A、Ca位于元素周期表中的s区 B、基态Ca原子中没有未成对电子 C、和互为同位素 D、表示有1个质子、没有中子的H原子6. 如图某化合物(结构如图)水解所得产物可用于制备医用橡胶,其中X、Y、Z、W是原子序数依次增大的四种短周期主族元素,X与W不在同一主族。下列说法错误的是 A、该化合物中Y、Z、W均满足最外层8电子稳定结构 B、X元素和Y元素可组成多种分子晶体 C、简单氢化物的稳定性:Y<Z D、该化合物水解时有HCl产生7. 用软锰矿(主要成分是MnO2)制备纯净MnO2的工艺流程如下:
A、该化合物中Y、Z、W均满足最外层8电子稳定结构 B、X元素和Y元素可组成多种分子晶体 C、简单氢化物的稳定性:Y<Z D、该化合物水解时有HCl产生7. 用软锰矿(主要成分是MnO2)制备纯净MnO2的工艺流程如下:
下列说法错误的是
A、“浸出”过程中参与反应的n(FeSO4):n(MnO2)为1:2 B、“沉锰”过程涉及:2HCO+Mn2+=MnCO3↓+H2O+CO2↑ C、“沉锰”过程中产物过滤后所得滤液可制造化肥 D、“沉锰”和“热解、煅烧”过程生成的CO2可用来制备NH4HCO38. 利用太阳能电池电解水制H2是一种“绿氢"制备方案。采用固体氧化还原调节剂作为离子交换体系,实现H2、O2分离,工作原理如图。下列说法正确的是 A、溶液X可以是稀硫酸,也可以是烧碱溶液 B、b电极的电极反应式:NiOOH+H2O+e-=Ni(OH)2+OH- C、导线中电子由太阳能电池流向d电极 D、电解一段时间后,将b、c电极对调,可实现镍元素的循环利用9. 设NA是阿伏加德罗常数的值。下列说法正确的是A、1.7gNH3与足量HCl反应,生成物的配位键数目为0.2NA B、78g由Na2S和Na2O2组成的固体混合物,含有的阴离子数为NA C、1molCu分别与足量的Cl2和S反应,转移电子数均为2NA D、标准状况下,4.48LH2O2完全分解,生成O2的数目为0.1NA10. 酸碱质子理论认为,在反应过程中能给出质子(H+)的分子或离子都是酸,凡是能接受质子的分子或离子都是碱。例如:CH3COOH+HCl⇌CH3COOH+Cl-中,CH3COOH为碱,HCl为酸。已知某温度下,几种酸在液态醋酸中电离常数的负对数pKa(pKa=-lgKa)如下表所示:
A、溶液X可以是稀硫酸,也可以是烧碱溶液 B、b电极的电极反应式:NiOOH+H2O+e-=Ni(OH)2+OH- C、导线中电子由太阳能电池流向d电极 D、电解一段时间后,将b、c电极对调,可实现镍元素的循环利用9. 设NA是阿伏加德罗常数的值。下列说法正确的是A、1.7gNH3与足量HCl反应,生成物的配位键数目为0.2NA B、78g由Na2S和Na2O2组成的固体混合物,含有的阴离子数为NA C、1molCu分别与足量的Cl2和S反应,转移电子数均为2NA D、标准状况下,4.48LH2O2完全分解,生成O2的数目为0.1NA10. 酸碱质子理论认为,在反应过程中能给出质子(H+)的分子或离子都是酸,凡是能接受质子的分子或离子都是碱。例如:CH3COOH+HCl⇌CH3COOH+Cl-中,CH3COOH为碱,HCl为酸。已知某温度下,几种酸在液态醋酸中电离常数的负对数pKa(pKa=-lgKa)如下表所示:酸
HClO4
H2SO4
HCl
HNO3
pKa
5.8
8.2
8.8
9.4
下列说法错误的是
A、部分元素的电负性:Cl>S>H B、在液态醋酸中,酸性:HClO4>H2SO4>HCl>HNO3 C、在液态醋酸中,H2SO4给出质子 D、HNO3在液态醋酸中的电离方程式为HNO3=H++NO11. 一氧化氮的氢化还原反应为2NO(g)+2H2(g) N2(g)+2H2O(g) ΔH=-664kJ·mol-1 , 其正反应速率方程为v=kca(NO)·cb(H2),T℃时,实验得到的一组数据如下表所示:实验组别
c(NO)/(mol·L-1)
c(H2)/(mol·L-1)
正反应速率/(mol·L-1·s-1)
I
6.00×10-3
2.00×10-3
2.16×10-3
II
1.20×10-2
2.00×10-3
8.64×10-3
III
6.00×10-3
4.00×10-3
4.32×10-3
下列说法正确的是
A、平衡常数:K(I)<K(II) B、a=1,b=2 C、升高温度,k的值减小 D、增大NO浓度比增大H2浓度对正反应速率影响大12. 下列各项实验操作和现象推出的结论正确的是选项
实验操作
现象
结论
A
①向某溶液中加入Ba(NO3)2溶液
②再加足量盐酸
①产生白色沉淀②仍有白色沉淀
原溶液中有SO
B
取5mL0.1mol·L-1FeCl3溶液,滴加5~6滴0.1mol·L-1KI溶液,充分反应后,再滴加KSCN溶液
溶液变红
FeCl3和KI的反应是可逆反应
C
将足量SO2通入Na2CO3溶液中逸出的气体先通入足量的酸性KMnO4溶液,再通入澄清石灰水中
酸性高锰酸钾溶液颜色变浅,澄清石灰水变浑浊
Ka1(H2SO3)>Ka1(H2CO3)
D
向蔗糖溶液中加入适量稀硫酸,水浴加热,冷却后向溶液中滴加新制Cu(OH)2悬浊液,加热
未出现砖红色沉淀
蔗糖未水解
A、A B、B C、C D、D13. 我国科学家最近实现CoOx/MnO2与氨水直接将醇氧化氰化生成腈,如图所示:
下列说法错误的是
A、苯甲醇、苯甲醛都能使酸性KMnO4溶液褪色 B、苯甲醇、苯甲醛的分子间氢键会影响它们的稳定性 C、a、b、c、d都能发生加成反应和取代反应 D、苯甲醇分子中所有原子不可能共平面14. 氢卤酸和AgNO3溶液反应可生成卤化银,已知AgCl、AgBr、AgI的溶解度依次减小,AgI的立方晶胞如图所示。下列说法错误的是 A、推测AgF的溶解度比AgCl的大 B、1个AgI晶胞中平均含有4个I- C、晶胞中I-的配位数是2 D、该晶体密度为g·cm-3
A、推测AgF的溶解度比AgCl的大 B、1个AgI晶胞中平均含有4个I- C、晶胞中I-的配位数是2 D、该晶体密度为g·cm-3二、综合题
-
15. 测定杀菌剂[Cu(NH3)x]SO4·yH2O样品组成的实验方法如下:(1)、I.[Cu(NH3)x]SO4·yH2O中氨的测定
向mg样品中加入过量的NaOH溶液。用盐酸将生成的气体吸收,然后滴定,实验装置如图:

装置图中a为冷凝水的(填“进”或“出”)水口,仪器b的名称为。
(2)、三颈烧瓶中,杀菌剂中的铜元素最终以CuO形式存在,反应的离子方程式为。(3)、通入N2的作用是。(4)、Ⅱ.[Cu(NH3)x]SO4·yH2O中铜元素含量的测定将实验I后三颈烧瓶中所得物过滤,向滤渣中滴加6mol·L-1H2SO4溶液,搅拌使滤渣充分溶解,向溶解后的溶液中加入2gKI(过量)固体,搅拌,充分反应后用Na2CO3溶液将溶液pH调节为8~9,用0.2000mol·L-1Na2S2O3溶液滴定。
已知:①CuSO4和KI反应:2Cu2++4I-=2CuI↓+I2
②Na2S2O3和I2反应:2+I2⇌ +2I-
滴定前必须用Na2CO3溶液将溶液pH调节为8~9,pH过大或过小都会导致实验误差过大,原因分别是:若pH过大,;若pH过小,。
(5)、实验Ⅱ滴定操作中指示剂的名称为 , 滴定终点时溶液的颜色变化为。(6)、若反应消耗Na2S2O3溶液的体积为16.00mL,则样品中n(Cu2+)=。16. 以含钒石煤(含有铁、硅、铝、钙、镁等元素的氧化物)为原料制备催化剂V2O5 , 工艺流程如下:
已知:i.含钒石煤中的钒大部分是难溶的V(Ⅲ)化合物。
ⅱ.常温下,几种金属氢氧化物的溶度积常数如表所示:
物质
Fe(OH)3
Ca(OH)2
Al(OH)3
Mg(OH)2
Ksp
2.8×10-39
5.5×10-6
1.3×10-33
1.0×10-11
回答下列问题:
(1)、含钒石煤需要先粉碎再焙烧,粉碎的目的是;“氧化焙烧”时氧化剂是。(2)、“酸浸渣”经“水洗”返回“浸出”的目的是。(3)、已知“酸浸液"中加入H2O2将V2O转化为VO , 该反应的离子方程式为;欲使"酸浸液”中的Mg2+完全沉淀(通常认为溶液中离子浓度小于10-5mol·L-1为沉淀完全),应加入NaOH将溶液pH调至以上,此时VO已转化成VO , 分离“净化液I”所得的滤渣中除Mg(OH)2外一定还含有(填化学式)。(4)、“沉钒”获得NH4VO3而不是将“净化液ⅱ”直接蒸干可以防止产品V2O5中混入Na和(填元素符号)等金属元素。(5)、“锻烧"NH4VO3过程中,固体残留率与温度变化如图所示,A点对应物质的化学式为。 17. 开发氢能等绿色能源是实现“碳中和”目标的重要举措。利用甲烷制取氢气的总反应:CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH,该反应可通过如下过程来实现:
17. 开发氢能等绿色能源是实现“碳中和”目标的重要举措。利用甲烷制取氢气的总反应:CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH,该反应可通过如下过程来实现:反应I:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+206.3kJ·mol-1
反应II:CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1
(1)、总反应的ΔH=kJ·mol-1 , 该反应在(填“较高温度”或“较低温度”)下可自发进行。(2)、在恒温、恒压条件下进行反应I,调整不同进气比[n(CH4):n(H2O)]测定相应的CH4平衡转化率。①当n(CH4):n(H2O)=1:2时,CH4平衡转化率为50%,则平衡混合物中H2的体积分数为。
②当n(CH4):n(H2O)=1:1时,CH4平衡转化率为20%,总压强为pMPa,此时分压平衡常数Kp为(MPa)2(用平衡分压代替浓度计算,分压=总压×物质的重分数)。
(3)、反应体系中存在的CO对后续工业生产不利。欲减少体系中CO的体积分数,可适当(填“升高”或“降低”)反应温度,理由是。(4)、除去H2中存在的微量CO的电化学装置如图所示:
①a为电源极。
②与b相连电极的反应式为。
18. 药物Q能阻断血栓形成,其合成路线之一如下:
已知:i.

ii.

iii.R′CHOR′CH=NR″
iv.


回答下列问题:
(1)、 的化学名称为。 (2)、A→B反应的化学方程式为。B→D的反应类型为。(3)、设计
的化学名称为。 (2)、A→B反应的化学方程式为。B→D的反应类型为。(3)、设计 →A、B→D两步转化的目的是。 (4)、写出一种能同时满足下列条件的E的芳香族同分异构体的结构简式。
→A、B→D两步转化的目的是。 (4)、写出一种能同时满足下列条件的E的芳香族同分异构体的结构简式。①红外光谱显示苯环上直接连有—NH2;
②核磁共振氢谱有四组峰,峰面积比为2:2:3:6。
(5)、G+J反应的化学方程式为。(6)、药物Q中官能团的名称是。(7)、参照题给流程和信息,设计以 和
和 为原料制备
为原料制备 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。