浙江省2018-2022年科学中考真题汇编14:水和溶液
试卷更新日期:2023-02-15 类型:二轮复习
一、单选题
-
1. 40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,此过程中不发生变化的是( )A、 溶剂的质量 B、溶质的质量 C、溶液中溶质的质量分数 D、食盐的溶解度2. 下表是氯化钠和硝酸钾的溶解度表,下列叙述中,错误的是( )
氯化钠和硝酸钾在不同温度下的溶解度
温度(℃)
0
20
40
60
80
100
氯化钠(克)
35.7
36.0
36.6
37.3
38.4
39.8
硝酸钾(克)
13.3
31.6
63.9
110
169
246
A、氯化钠和硝酸钾的溶解度随温度的升高而增大 B、在20℃时,要溶解36克氯化钠至少需要100克水 C、若硝酸钾中混有少量的氯化钠,可采用冷却热饱和溶液的方法来提纯硝酸钾 D、将80℃的氯化钠饱和溶液和80℃的硝酸钾饱和溶液各100克降温至20℃,析出晶体的质量分别是2.4克和137.4克3. 20℃时,将45g氯化钠均分成五份,依次加入到盛有100g水的烧杯中,充分溶解。实验数据如下表:实验序号
①
②
③
④
⑤
氯化钠质量/g
9
18
27
36
45
溶液质量/g
109
118
127
136
136
下列分析正确的是( )
A、实验③所得溶液的溶质质量分数最大 B、实验④所得溶液是氯化钠的不饱和溶液 C、20℃时,氯化钠的溶解度为36g/100g水 D、将实验①所得溶液蒸发50g水,冷却到20℃,溶液达到饱和4. 已知(1)20℃时,溶解度在10克以上的物质称为易溶物质,溶解度在1~10克的物质为可溶物质,溶解度在0.01~1克为微溶物质,溶解度小于0.01克的物质为难溶物质。(2)20℃时几种物质的溶解度如下:物质名称
氯化钠
氢氧化钙
氯酸钾
硝酸钾
溶解度(克)
36.0
0.165
7.4
31.6
下列说法正确的是( )
A、20℃时氢氧化钙是难溶物质 B、20℃时可以配制出20%的硝酸钾溶液 C、20℃时氯酸钾是易溶物质 D、20℃时硝酸钾的溶解度比氯化钠大5. 日本政府拟将核污水排入太平洋的计划引起了全球关注。若该计划实施,不仅会导致海洋污染,某些污染物还可能通过水循环环节进入到大气,从而造成大气污染。下列水循环环节中,与污染物进入大气密切相关的是( )A、降水 B、下渗 C、蒸发 D、径流6. 20℃时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分到溶解,实验过程如图所示。下列分析正确的是( ) A、甲烧杯中,硝酸钾溶液是不饱和溶液 B、丁烧杯中,硝酸钾溶液是不饱和溶液 C、乙→丙过程中,硝酸钾溶液的溶质质量分数变大 D、丙→丁过程中,硝酸钾溶液的溶质质量分数变大7. 一杯热硝酸钾溶液放在桌面上,一段时间后观察到烧杯底部有少量的晶体析出,如图所示。忽略水的蒸发,下列关于硝酸钾及其溶液的分析正确的是( )
A、甲烧杯中,硝酸钾溶液是不饱和溶液 B、丁烧杯中,硝酸钾溶液是不饱和溶液 C、乙→丙过程中,硝酸钾溶液的溶质质量分数变大 D、丙→丁过程中,硝酸钾溶液的溶质质量分数变大7. 一杯热硝酸钾溶液放在桌面上,一段时间后观察到烧杯底部有少量的晶体析出,如图所示。忽略水的蒸发,下列关于硝酸钾及其溶液的分析正确的是( )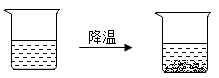 A、溶液质量不变 B、溶液的溶质质量分数变小 C、硝酸钾的溶解度变大 D、原溶液一定是饱和溶液8. 现有编号为①、②、③的三个烧杯中均分别盛有100克水,20℃时向三个烧杯中分别加入36克、56克、76克的同种物质,充分溶解,实验结果如图所示。下列判断正确的是( )
A、溶液质量不变 B、溶液的溶质质量分数变小 C、硝酸钾的溶解度变大 D、原溶液一定是饱和溶液8. 现有编号为①、②、③的三个烧杯中均分别盛有100克水,20℃时向三个烧杯中分别加入36克、56克、76克的同种物质,充分溶解,实验结果如图所示。下列判断正确的是( )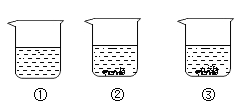 A、①中所得溶液一定是不饱和溶液 B、②③中所得溶液溶质的质量分数相等 C、若②中溶液升温到30℃,溶液的质量一定不变 D、若③中溶液恒温蒸发,溶质的质量分数一定变大9. 人类的生产和生活都离不开水,地球上的水通过水循环不断地被利用。下列描述正确的是( )
A、①中所得溶液一定是不饱和溶液 B、②③中所得溶液溶质的质量分数相等 C、若②中溶液升温到30℃,溶液的质量一定不变 D、若③中溶液恒温蒸发,溶质的质量分数一定变大9. 人类的生产和生活都离不开水,地球上的水通过水循环不断地被利用。下列描述正确的是( ) A、水循环的环节只有蒸发、凝结和降水 B、海洋水可以通过水循环转化为湖泊水 C、地表径流水量一定与植物蒸腾量相等 D、人类直接利用最多的水资源是海洋水10. 水是生命之源,有关水说法不正确的是( )A、流水是影响地形的外力作用之一 B、海洋水是地球上最大的水体 C、水循环的环节只有蒸发和降水 D、人类需合理开发和利用水资源11. 某兴趣小组分别用加溶质和恒温蒸发溶剂的方法,将一定质量的硝酸钾不饱和溶液转化为饱和溶液。实验过程中,硝酸钾溶解度的变化情况分别是( )A、变大 不变 B、变大 变小 C、不变 变大 D、不变 不变12. 小金在配硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
A、水循环的环节只有蒸发、凝结和降水 B、海洋水可以通过水循环转化为湖泊水 C、地表径流水量一定与植物蒸腾量相等 D、人类直接利用最多的水资源是海洋水10. 水是生命之源,有关水说法不正确的是( )A、流水是影响地形的外力作用之一 B、海洋水是地球上最大的水体 C、水循环的环节只有蒸发和降水 D、人类需合理开发和利用水资源11. 某兴趣小组分别用加溶质和恒温蒸发溶剂的方法,将一定质量的硝酸钾不饱和溶液转化为饱和溶液。实验过程中,硝酸钾溶解度的变化情况分别是( )A、变大 不变 B、变大 变小 C、不变 变大 D、不变 不变12. 小金在配硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )序号
温度/℃
水的质量/克
加入硝酸钾的质量/克
所得溶液的质量/克
①
10
100
40
120.9
②
60
100
40
140
A、10℃时硝酸钾的溶解度为40克 B、②所得溶液一定是60℃时硝酸钾的饱和溶液 C、若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致 D、若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小13. 某容器中装有盐水若干,老师让小科倒入质量分数1%的盐水100克以配成质量分数2%的盐水,但小科却错误的倒入100克水,老师发现后说你再将第三种盐水40克倒入水中就可得到2%的盐水了,那么第三种盐水的质量分数为( )A、2.5% B、4.5% C、5% D、7%14. 如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是( ) A、砂糖水颜色很深 B、砂糖水味道很甜 C、砂糖溶解得很快 D、砂糖固体有剩余15. 如图所示为蒸发氯化钠溶液的过程,其中①→②一③为恒温过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( )
A、砂糖水颜色很深 B、砂糖水味道很甜 C、砂糖溶解得很快 D、砂糖固体有剩余15. 如图所示为蒸发氯化钠溶液的过程,其中①→②一③为恒温过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( ) A、在①→②过程中,氯化钠的质量分数保持不变 B、在②→③过程中,氯化钠的溶解度不断增大 C、在③→④过程中,水的质量分数不断增大 D、在②→④过程中,氯化钠的质量分数先不变后增大16. 如图是教材中用来表示电解水过程的示意图(其中“
A、在①→②过程中,氯化钠的质量分数保持不变 B、在②→③过程中,氯化钠的溶解度不断增大 C、在③→④过程中,水的质量分数不断增大 D、在②→④过程中,氯化钠的质量分数先不变后增大16. 如图是教材中用来表示电解水过程的示意图(其中“ )分析示意图,可作出的正确判断是( )
)分析示意图,可作出的正确判断是( )  A、常温常压下水可以发生分解反应 B、电解水的最终产物是H、O原子 C、H原子是图示微粒中的最小微粒 D、O原子只有在通电条件下才能转化为O2分子17. 20℃时,把36克氯化钠放入64克水中,使其充分溶解(20℃时氯化钠的溶解度为36克)。对所得溶液的有关说法错误的是( )A、 该溶液是饱和溶液 B、溶液中Na=和Cl-个数一定相等 C、溶液质量为100克 D、溶质与溶剂质量比为9:2518. 甲是60℃的蔗糖溶液,按如图所示进行操作。以下分析错误的是( )
A、常温常压下水可以发生分解反应 B、电解水的最终产物是H、O原子 C、H原子是图示微粒中的最小微粒 D、O原子只有在通电条件下才能转化为O2分子17. 20℃时,把36克氯化钠放入64克水中,使其充分溶解(20℃时氯化钠的溶解度为36克)。对所得溶液的有关说法错误的是( )A、 该溶液是饱和溶液 B、溶液中Na=和Cl-个数一定相等 C、溶液质量为100克 D、溶质与溶剂质量比为9:2518. 甲是60℃的蔗糖溶液,按如图所示进行操作。以下分析错误的是( )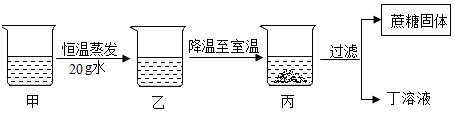 A、甲一定是不饱和溶液 B、丙和丁一定是饱和溶液 C、乙的溶质质量分数一定比甲大 D、甲和丙的溶质质量分数一定不相等19. 20℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表:
A、甲一定是不饱和溶液 B、丙和丁一定是饱和溶液 C、乙的溶质质量分数一定比甲大 D、甲和丙的溶质质量分数一定不相等19. 20℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表:实验小组
第一组
第二组
第三组
第四组
水的质量/g
50
50
50
50
所取NaCl的质量/g
15
20
25
30
剩余NaCl的质量/g
0
2
7
12
下列说法错误的是( )
A、20℃时,50gNaCl饱和溶液中含有18gNaCl B、用蒸发的方法可以使不饱和溶液变成饱和溶液 C、第二组所得溶液的溶质与溶剂的质量比为9:25 D、相同温度下,NaCl在水里的溶解度与水的质量无关20. 下列操作均在室温下进行,且不考虑水分的蒸发。则溶液中溶质的溶解度和溶质质量分数都发生变化的是( )A、将一定量硝酸钾不饱和溶液升温 10℃ B、将一定量饱和石灰水升温 10℃ C、取一定量蔗糖不饱和溶液向其中加入少量蔗糖 D、取一定量氯化钠饱和溶液向其中加入少量水21. 硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( )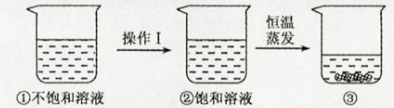 A、操作Ⅰ一定是降温 B、①与②的溶液质量一定相等 C、①与③的溶质质量一定相等 D、②与③的溶质质量分数一定相等22. 2018年5月,台州南部湾区引水工程开工,以级解台州雨部地区的用水紧张状况。该工程通过管道,将台州北部水资源向南部输送。该工程改变的水循环环节是( )
A、操作Ⅰ一定是降温 B、①与②的溶液质量一定相等 C、①与③的溶质质量一定相等 D、②与③的溶质质量分数一定相等22. 2018年5月,台州南部湾区引水工程开工,以级解台州雨部地区的用水紧张状况。该工程通过管道,将台州北部水资源向南部输送。该工程改变的水循环环节是( )
A、降水 B、地表径流 C、海水蒸发 D、水汽输送23. 某“天气瓶"通过樟脑在酒精溶液中的结晶情况反映气温变化。如图为该“天气瓶”在三种不同气温下的状况,则瓶内溶液一定为相应气温下樟脑饱和溶液的是( )
 A、甲、乙 B、甲、丙 C、乙、丙 D、甲、乙、丙24. 20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是( )
A、甲、乙 B、甲、丙 C、乙、丙 D、甲、乙、丙24. 20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是( )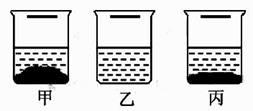 A、所得溶液可能都是饱和溶液 B、20℃时,乙溶液的溶质质量最小 C、溶液溶质的质量分数:甲>丙>乙 D、升高温度,溶液溶质的质量分数一定变大
A、所得溶液可能都是饱和溶液 B、20℃时,乙溶液的溶质质量最小 C、溶液溶质的质量分数:甲>丙>乙 D、升高温度,溶液溶质的质量分数一定变大二、填空题
-
25. 学习《物质的溶解》时小科同学进行了如下实验:往A、B、C三只烧杯中分别装入等质量的水,在相同温度下,向三只烧杯中分别加入50g、25g、5g同种固体物质,充分溶解后,静置,现象如图所示。

回答下列问题:
(1)、小科认为,A烧杯中的溶液一定是饱和溶液。他的判断依据是;(2)、A,B,C三只烧杯中,溶液的溶质质量分数大小关系是。26. 下表是氢氧化钠溶液的密度与其质量分数对照表(20℃)。回答下列问题:质量分数(%)
10
20
30
40
50
密度(克/厘米3)
1.11
1.22
1.33
1.43
1.53
(1)、20℃时,随着溶质质量分数增大、氢氧化钠溶液的密度逐渐。(2)、配制100克10%的氢氧化钠溶液。需要氢氧化钠固体。(3)、10%的氢氧化钠溶液,体积为100毫升时的质量为。27. 常温下,取100克质量分数为5%的NaCl溶液,先按实验1将NaCl溶液分成两等份,再进行实验2操作,如图所示。
完成下列问题:
(1)、配置100克质量分数为5%的NaCl溶液,不需要用到的仪器是 ;A、集气瓶 B、烧杯 C、玻璃棒 D、量筒(2)、完成实验2操作后,比较甲、乙两只烧杯中溶液的溶质质量分数,其大小关系是(选填“大于”“等于”或“小于”)。28. 物质的溶解度不同,用途也不同。请据表回答:表一 物质的溶解度(20℃)
物质
NaOH
Ca(OH)2
CaCO3
CaSO3
溶解度(克)
109
0.165
0.0014
0.0043
表二物质在水中的溶解性等级
200C时的溶解度(克)
>10
1-10
0.01-1
<0.01
等级
易溶
可溶
微溶
难溶
(1)、实验中一般用氢氧化钠溶液吸收二氧化碳而不用澄清石灰水来吸收二氧化碳主要原因是氢氧化钙于水,吸收效果不好。(2)、实验中一般用澄清石灰水检验二氧化碳,但是根据上表可知能使澄清石灰水变浑浊的不一定是二氧化碳,也可能是二氧化硫,请用化学方程式说明 。(3)、20℃时,饱和氢氧化钠溶液的溶质质量分数为。(精确到0.1%)29. 台州甘蔗制糖有着悠久的历史。甘蔗制糖的部分环节为:清洗甘蔗→压榨甘蔗→分离渣汁 →蒸发浓缩→…… (1)、甘蔗在压榨过程中发生的变化属于。(2)、渣汁的分离与图中的(选填“A”、“B”或“C”)实验原理相同。(3)、糖汁在蒸发浓缩过程中,溶液的溶质质量分数将怎么变化?30. 水循环是指地球上不同水体进行水分交换的过程。通过水循环,地球上的水、大气、岩石和生物发生了密切的联系。(1)、陆地和海洋中的水以蒸发的形式转化为大气水,其蒸发的快慢与液体的表面积、温度和等因素有关。(2)、水体在陆地和海洋之间输送的环节主要是水汽输送和。31. 水的循环示意图中,序号①②③④表示水循环的主要环节(如图),据图完成下列问题:
(1)、甘蔗在压榨过程中发生的变化属于。(2)、渣汁的分离与图中的(选填“A”、“B”或“C”)实验原理相同。(3)、糖汁在蒸发浓缩过程中,溶液的溶质质量分数将怎么变化?30. 水循环是指地球上不同水体进行水分交换的过程。通过水循环,地球上的水、大气、岩石和生物发生了密切的联系。(1)、陆地和海洋中的水以蒸发的形式转化为大气水,其蒸发的快慢与液体的表面积、温度和等因素有关。(2)、水体在陆地和海洋之间输送的环节主要是水汽输送和。31. 水的循环示意图中,序号①②③④表示水循环的主要环节(如图),据图完成下列问题: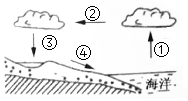 (1)、序号②表示水循环中的环节;(2)、下列三个地区,水循环最活跃的是 (填字母)。A、冰川广布的南极大陆 B、地表裸露的沙漠地区 C、森林覆盖良好的水库区32. 下表是A、B、C三种固体物质在不同温度下(t1<t2<t3)的溶解度,请回答:
(1)、序号②表示水循环中的环节;(2)、下列三个地区,水循环最活跃的是 (填字母)。A、冰川广布的南极大陆 B、地表裸露的沙漠地区 C、森林覆盖良好的水库区32. 下表是A、B、C三种固体物质在不同温度下(t1<t2<t3)的溶解度,请回答:温度(℃)
t1
t2
t3
物质A(克)
36.0
36.2
37.3
物质B(克)
31.6
36.2
110.0
物质C(克)
0.165
0.135
0.076
(1)、 ℃时,A、B两种物质的溶解度相同。(2)、t1℃时,分别取等量的B、C饱和溶液于试管甲、乙中(如图)。将试管放入盛有水的烧杯中,向烧杯中加入一定量硝酸铵(不考虑试管中水的变化),有固体析出的试管为(选填“甲”或“乙”)。 (3)、t2℃时,将10克A固体放入40克水中,充分搅拌后,所得溶液中溶质的质量分数为。33. 甲烧杯中盛有30℃、溶质质量分数为20%的饱和硫酸铜溶液100克,进行如图所示实验(不考虑水分蒸发)。
(3)、t2℃时,将10克A固体放入40克水中,充分搅拌后,所得溶液中溶质的质量分数为。33. 甲烧杯中盛有30℃、溶质质量分数为20%的饱和硫酸铜溶液100克,进行如图所示实验(不考虑水分蒸发)。 (1)、乙中溶液(填“是”、“不是”或“可能是”)饱和溶液。(2)、丙中溶液的溶质质量分数为%(结果保留一位小数)。
(1)、乙中溶液(填“是”、“不是”或“可能是”)饱和溶液。(2)、丙中溶液的溶质质量分数为%(结果保留一位小数)。三、实验探究题
-
34. 为了解决人们在野外生活和工作时的饮水问题,小金开展了便携式野外净水器的设计和制作。(1)、(一)设计方案如图甲所示(其中箭头表示预设的水流方向)

⑴为了确保水流按预设方向,原水进口和净水出口需要安装单向阀,单向阀类似于人体心脏中心房和心室之间的(填写结构名称)。
⑵为了使水质符合饮用水标准,小金选择了三种滤料去除原水中的杂质,三种滤料的用途如表所示,则滤料甲、乙、丙分别为(按序填写编号)
滤料编号 用途 ① 去除水中的泥沙、悬浮物等大颗粒污染物 ② 去除大分子有机物、重金属离子和细菌等 ③ 去除残留的细菌、小分子有机物、重金属离子和异味等 ⑶为了使净水器出水快,需要通过加压装置吸水和压水。下列设计中手柄均可带动活塞做直线往复运动,其中能达到人推拉手柄省力这一目的的是(选填字母)
 (2)、小金按其设计方案完成了净水器的制作,并对净水器的净水500,效果进行检测已知随着滤料内污染物增加净水流速会降低,当其低于250mL/mn时,需对滤料进行处理。图乙为净水器对三种地表水体进行净水实验,得到的净水流速随净水量变化的图像据此判断,在不处理滤料的情况下,此净水器(选填“能或“不能”)从以上三种地表水体中获取30L净水。
(2)、小金按其设计方案完成了净水器的制作,并对净水器的净水500,效果进行检测已知随着滤料内污染物增加净水流速会降低,当其低于250mL/mn时,需对滤料进行处理。图乙为净水器对三种地表水体进行净水实验,得到的净水流速随净水量变化的图像据此判断,在不处理滤料的情况下,此净水器(选填“能或“不能”)从以上三种地表水体中获取30L净水。
四、解答题
-
35. 某兴趣小组用硝酸钾进行了图甲所示的实验,硝酸钾溶解度与温度的关系如图乙。
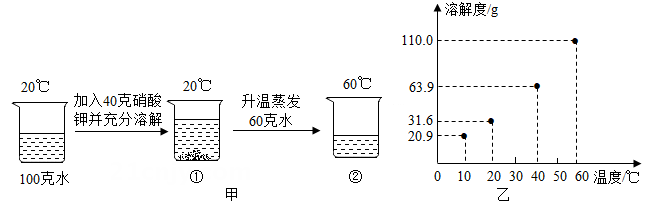 (1)、①中未溶解的硝酸钾质量为克。(2)、②中硝酸钾溶液为(选填“饱和”或“不饱和”)溶液。(3)、计算②中溶液的溶质质量分数。36. 思维模型是依据事物发展内在规律所建立的解决问题的基本框架,能引导有序思维、增进深度理解、促进问题解决。小科建构了“混合物提纯”的思维模型:
(1)、①中未溶解的硝酸钾质量为克。(2)、②中硝酸钾溶液为(选填“饱和”或“不饱和”)溶液。(3)、计算②中溶液的溶质质量分数。36. 思维模型是依据事物发展内在规律所建立的解决问题的基本框架,能引导有序思维、增进深度理解、促进问题解决。小科建构了“混合物提纯”的思维模型: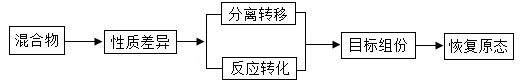 (1)、[初步理解]根据混合物组份的性质差异,获得混合物中目标组份。
(1)、[初步理解]根据混合物组份的性质差异,获得混合物中目标组份。
海水淡化是将海水中的盐与水分开,常压加热蒸馏法是其中的一种:常压下将海水加热形成水蒸气,再液化得到淡水的过程。从建模角度分析,海水加热形成水蒸气属于上述模型中的。(填“分离转移”或“反应转化")。(2)、[探究本质]根据组份的性质差异,选择合适方法,实现物质提纯。从含少量氯化钠的硝酸钾固体中提纯硝酸钾,是通过溶解然发浓缩、冷却结晶、过滤、洗涤、干燥实现的。其中过滤操作将硝酸钾晶体与溶液分离是根据不同。
(3)、[实践应用]根据混合物中某组份发生化学反应,提高混合物中目标组份纯度。小科取10克混有少量硫酸的盐酸溶液滴入氯化钡溶液至不再产生沉淀,经过滤洗涤和干燥得到沉淀0.233克,则原混合溶液中硫酸的溶质质量分数为。
(4)、[融合创新]依据科学原理,融合技术与工程,形成新颖而有价值的解决实际问题方案。常压加热蒸馏法,能耗大、成本高。小科查阅资料获知,现在世界上的许多大型海水淡化工厂,都已经采用低压加热蒸馏法,请解释其蕴含的科学道理。37. 一水硫酸四氨合铜的化学式为[Cu(NH3)4]SO4·H2O,是一种高效、安全的杀菌剂。它在以氧化铜为主要原料合成该物质,他设计的合成路线如图乙所示:
 (1)、溶液A中一定存在的溶质为。(2)、溶液B中含硫酸四氨合铜,“一系列操作”是指向溶液B中加入适量、过滤、洗涤、干燥等。(3)、得到的产物是一种晶体,与非晶体相比,晶体具有一定的和特定的形状。38. 某同学进行硫酸铜晶体(化学式为CuSO4·5H2O)的制备和生长实验,配制了某温度时的硫酸铜热饱和溶液,静置、冷却到室温,观察晶体的生长,如图。
(1)、溶液A中一定存在的溶质为。(2)、溶液B中含硫酸四氨合铜,“一系列操作”是指向溶液B中加入适量、过滤、洗涤、干燥等。(3)、得到的产物是一种晶体,与非晶体相比,晶体具有一定的和特定的形状。38. 某同学进行硫酸铜晶体(化学式为CuSO4·5H2O)的制备和生长实验,配制了某温度时的硫酸铜热饱和溶液,静置、冷却到室温,观察晶体的生长,如图。 (1)、能判断原硫酸铜溶液已饱和的方法是 。A、观察颜色,溶液蓝色较深 B、溶液冷却,有蓝色晶体析出 C、蒸发少量水,有蓝色晶体析出 D、加入硫酸铜晶体,晶体质量不变(2)、现称取49克无水硫酸铜溶于水,配成150克某温度时的热饱和溶液,再冷却到室温,共析出50克硫酸铜晶体,请计算该室温时硫酸铜饱和溶液的溶质质量分数。39. 下表是硝酸钾在不同温度时的溶解度,根据表中数据回答下列问题。
(1)、能判断原硫酸铜溶液已饱和的方法是 。A、观察颜色,溶液蓝色较深 B、溶液冷却,有蓝色晶体析出 C、蒸发少量水,有蓝色晶体析出 D、加入硫酸铜晶体,晶体质量不变(2)、现称取49克无水硫酸铜溶于水,配成150克某温度时的热饱和溶液,再冷却到室温,共析出50克硫酸铜晶体,请计算该室温时硫酸铜饱和溶液的溶质质量分数。39. 下表是硝酸钾在不同温度时的溶解度,根据表中数据回答下列问题。温度/℃
0
10
20
30
40
溶解度/克
13.3
20.9
31.6
45.8
63.9
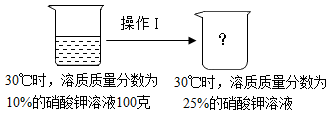 (1)、10℃时,100克水中最多可溶解硝酸钾的质量为克。(2)、20℃时,将10克硝酸钾加入40克水中,所得溶液溶质质量分数为。(3)、如图是硝酸钾溶液的变化情况,请写出一种可采用的操作方法。(写出计算过程)40. 为研究“不同物质在敞口容器久置后的质量变化”,某科学兴趣小组将10.00克下列物质分别盛放于相同的烧杯中,将它们敞口放置在恒温实验室。一段时间后,测得烧杯中物质减小的质量情况见下表。
(1)、10℃时,100克水中最多可溶解硝酸钾的质量为克。(2)、20℃时,将10克硝酸钾加入40克水中,所得溶液溶质质量分数为。(3)、如图是硝酸钾溶液的变化情况,请写出一种可采用的操作方法。(写出计算过程)40. 为研究“不同物质在敞口容器久置后的质量变化”,某科学兴趣小组将10.00克下列物质分别盛放于相同的烧杯中,将它们敞口放置在恒温实验室。一段时间后,测得烧杯中物质减小的质量情况见下表。放置时间(小时)
烧杯中物质减小的质量(克)
水
饱和氯化钠溶液
饱和硝酸钾溶液
7.3%的稀盐酸
24
1.85
0.61
0.72
1.35
48
3.70
?
1.44
2.80
请回答:
(1)、表格中“?”的值是克;(2)、与原饱和硝酸钾溶液相比较,敞口放置24小时的硝酸钾溶液溶质质量分数(填“变大”、“变小”或“不变”);(3)、分析上表中水、饱和硝酸钾溶液和稀盐酸敞口放置后的质量减小程度随时间变化不一样,为进一步研究稀盐酸在敞口容器久置后的溶质质量分数变化,小丽进行了下列操作:取敞口放置时间48小时的稀盐酸5.00克于锥形瓶中,滴入两滴指示剂,用溶质质量分数为8%的氢氧化钠溶液逐滴滴入稀盐酸中,至恰好完全反应,共消耗了5.50克氢氧化钠溶液。通过计算,确定散口放置48小时的稀盐酸溶质质量分数是“变大”、“变小”还是“不变”?并对变化的原因作出解释。
-