从巩固到提高 高考化学二轮微专题28 原电池与电极反应
试卷更新日期:2023-02-13 类型:二轮复习
一、单选题
-
1. 少量与反应生成和。下列说法正确的是( )A、的电子式为
 B、的空间构型为直线形
C、中O元素的化合价为-1
D、仅含离子键
2. 下列符号表征或说法正确的是( )A、电离: B、位于元素周期表p区 C、空间结构:平面三角形 D、电子式:
B、的空间构型为直线形
C、中O元素的化合价为-1
D、仅含离子键
2. 下列符号表征或说法正确的是( )A、电离: B、位于元素周期表p区 C、空间结构:平面三角形 D、电子式: 3. 磷酰三叠氮是一种高能分子,结构简式为。下列关于该分子的说法正确的是( )A、为非极性分子 B、立体构型为正四面体形 C、加热条件下会分解并放出 D、分解产物的电子式为4. 下列化学用语或图示表达错误的是( )A、乙炔的结构简式: B、顺丁烯的分子结构模型:
3. 磷酰三叠氮是一种高能分子,结构简式为。下列关于该分子的说法正确的是( )A、为非极性分子 B、立体构型为正四面体形 C、加热条件下会分解并放出 D、分解产物的电子式为4. 下列化学用语或图示表达错误的是( )A、乙炔的结构简式: B、顺丁烯的分子结构模型: C、基态原子的价层电子的轨道表示式:
C、基态原子的价层电子的轨道表示式: D、的电子式:
D、的电子式: 5. 下列方程式与所给事实不相符的是( )A、加热固体,产生无色气体: B、过量铁粉与稀硝酸反应,产生无色气体: C、苯酚钠溶液中通入 , 出现白色浑浊:
5. 下列方程式与所给事实不相符的是( )A、加热固体,产生无色气体: B、过量铁粉与稀硝酸反应,产生无色气体: C、苯酚钠溶液中通入 , 出现白色浑浊: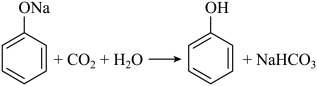 D、乙醇、乙酸和浓硫酸混合加热,产生有香味的油状液体:
6. 、的半衰期很短,自然界中不能稳定存在。人工合成反应如下:;。下列说法正确的是( )A、X的中子数为2 B、X、Y互为同位素 C、、可用作示踪原子研究化学反应历程 D、自然界不存在、分子是因其化学键不稳定7. 下列消毒剂的有效成分属于盐的是( )A、高锰酸钾溶液 B、过氧乙酸溶液 C、双氧水 D、医用酒精8. 某水处理剂由纳米铁粉附着在多孔炭粉的表面复合而成,利用原电池原理处理弱酸性废水中的NO3-时,其表面发生如图所示反应。下列说法正确的是( )
D、乙醇、乙酸和浓硫酸混合加热,产生有香味的油状液体:
6. 、的半衰期很短,自然界中不能稳定存在。人工合成反应如下:;。下列说法正确的是( )A、X的中子数为2 B、X、Y互为同位素 C、、可用作示踪原子研究化学反应历程 D、自然界不存在、分子是因其化学键不稳定7. 下列消毒剂的有效成分属于盐的是( )A、高锰酸钾溶液 B、过氧乙酸溶液 C、双氧水 D、医用酒精8. 某水处理剂由纳米铁粉附着在多孔炭粉的表面复合而成,利用原电池原理处理弱酸性废水中的NO3-时,其表面发生如图所示反应。下列说法正确的是( ) A、电池工作时,H+向负极移动 B、正极附近溶液的酸性增强 C、负极电极式:Fe-3e-=Fe3+ D、与单独使用纳米铁粉相比,该水处理剂能加快NO3-的除去速率9. 某科研小组利用下图装置完成乙炔转化为乙烯的同时为用电器供电。其中锌板处发生的反应有:①;②;③。下列说法错误的是( )
A、电池工作时,H+向负极移动 B、正极附近溶液的酸性增强 C、负极电极式:Fe-3e-=Fe3+ D、与单独使用纳米铁粉相比,该水处理剂能加快NO3-的除去速率9. 某科研小组利用下图装置完成乙炔转化为乙烯的同时为用电器供电。其中锌板处发生的反应有:①;②;③。下列说法错误的是( ) A、电极a的电势高于电极b的电势 B、放电过程中正极区KOH溶液浓度保持不变 C、电极a上发生的电极反应式为 D、电解足量溶液,理论上消耗2.24L(标准状况)时,生成6.4gCu10. 盐酸羟胺(NH2OH·HCl)是一种易溶盐,可用作还原剂和显像剂,其溶于水后完全电离为NH3OH+与Cl-。利用原电池原理制备盐酸羟胺的装置如下图所示。下列说法错误的是( )
A、电极a的电势高于电极b的电势 B、放电过程中正极区KOH溶液浓度保持不变 C、电极a上发生的电极反应式为 D、电解足量溶液,理论上消耗2.24L(标准状况)时,生成6.4gCu10. 盐酸羟胺(NH2OH·HCl)是一种易溶盐,可用作还原剂和显像剂,其溶于水后完全电离为NH3OH+与Cl-。利用原电池原理制备盐酸羟胺的装置如下图所示。下列说法错误的是( ) A、Pt电极作负极,发生氧化反应 B、含Fe催化电极上的反应为: NO+3e- +4H+=NH3OH+ C、该装置工作时,负极区溶液和正极区溶液的pH均保持不变 D、每制取0.1 mol NH2OH·HCl,有3.36L (标准状况) H2参与反应11. 利用假单胞菌分解有机物的电化学原理如图所示。下列说法错误的是( )
A、Pt电极作负极,发生氧化反应 B、含Fe催化电极上的反应为: NO+3e- +4H+=NH3OH+ C、该装置工作时,负极区溶液和正极区溶液的pH均保持不变 D、每制取0.1 mol NH2OH·HCl,有3.36L (标准状况) H2参与反应11. 利用假单胞菌分解有机物的电化学原理如图所示。下列说法错误的是( ) A、该过程将化学能转化为电能 B、电子流向:B电极→用电器→A电极 C、A电极上发生氧化反应,电极反应式为:X-2e-=Y+2H+ D、当外电路通过4NA电子时,消耗标准状况下氧气的体积为22.4L12. 目前固体电解质在制造全固态电池及其它传感器、探测器等方面的应用日益广泛。如晶体,其中迁移的离子全是。利用晶体,可以制成电化学气敏传感器,下图是一种测定含量的气体传感器示意图。被分析的可以透过聚四氟乙烯薄膜,由电池电动势变化可以得知的含量。
A、该过程将化学能转化为电能 B、电子流向:B电极→用电器→A电极 C、A电极上发生氧化反应,电极反应式为:X-2e-=Y+2H+ D、当外电路通过4NA电子时,消耗标准状况下氧气的体积为22.4L12. 目前固体电解质在制造全固态电池及其它传感器、探测器等方面的应用日益广泛。如晶体,其中迁移的离子全是。利用晶体,可以制成电化学气敏传感器,下图是一种测定含量的气体传感器示意图。被分析的可以透过聚四氟乙烯薄膜,由电池电动势变化可以得知的含量。
在气体传感器工作过程中,下列说法错误的是( )
A、含量的变化会引起电位计示数的变化 B、理论上,每0.1mol参与反应,银电极质量就减小43.2g C、多孔石墨电极上的反应可表示为 D、传感器工作时晶体中的量保持不变13. 一种铝—空气电池放电过程如图所示,下列关于该电池放电时的说法正确的是( ) A、a极发生还原反应 B、往b极迁移 C、每转移4mol电子,正极消耗1mol空气 D、负极电极反应式:14. 利用微生物电池去除废水中的 , 装置如下。下列说法正确的是( )
A、a极发生还原反应 B、往b极迁移 C、每转移4mol电子,正极消耗1mol空气 D、负极电极反应式:14. 利用微生物电池去除废水中的 , 装置如下。下列说法正确的是( ) A、A为质子交换膜,从膜的右边向左边移动 B、该系统为化学能转化为电能,再电能转化为化学能 C、两极产生的与的物质的量比为5:1 D、好氧反应器发生反应时,内部溶液的升高15. 氢氧熔融碳酸盐燃料电池是一种高温电池,具有效率高、无污染、燃料多样、余热利用价值高等优点,电池的工作原理如图所示。下列有关说法正确的是( )
A、A为质子交换膜,从膜的右边向左边移动 B、该系统为化学能转化为电能,再电能转化为化学能 C、两极产生的与的物质的量比为5:1 D、好氧反应器发生反应时,内部溶液的升高15. 氢氧熔融碳酸盐燃料电池是一种高温电池,具有效率高、无污染、燃料多样、余热利用价值高等优点,电池的工作原理如图所示。下列有关说法正确的是( )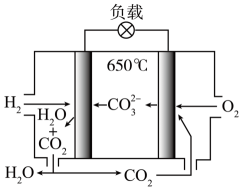 A、该电池在常温下也能正常工作 B、H2通入负极,发生还原反应 C、正极反应式为O2+ 2CO2+4e- =2 D、电池工作时,外电路中流过2 mol电子,消耗22.4L H216. 我国科研人员将单独脱除的反应与的制备反应相结合,实现协同转化。
A、该电池在常温下也能正常工作 B、H2通入负极,发生还原反应 C、正极反应式为O2+ 2CO2+4e- =2 D、电池工作时,外电路中流过2 mol电子,消耗22.4L H216. 我国科研人员将单独脱除的反应与的制备反应相结合,实现协同转化。①单独制备: , 不能自发进行。
②单独脱除: , 能自发进行协同转化装置如下图(在电场作用下,双极膜中间层的解离为和 , 并向两极迁移)。
下列分析错误的是( )
 A、反应②释放的能量可以用于反应① B、产生的电极反应: C、反应过程中不需补加稀 D、协同转化总反应:17. 储量丰富、成本低的新型电池系统引起了科学家的广泛关注。由于K+能够可逆地嵌入/脱嵌石墨电极,开发了基于钾离子电解液(KPF6)的新型双碳电池[碳微球(C)为正极材料,膨胀石墨( )为负极材料],充电时总反应为:+xK++xC+=+xC(PF6),如图所示。下列叙述错误的是( )
A、反应②释放的能量可以用于反应① B、产生的电极反应: C、反应过程中不需补加稀 D、协同转化总反应:17. 储量丰富、成本低的新型电池系统引起了科学家的广泛关注。由于K+能够可逆地嵌入/脱嵌石墨电极,开发了基于钾离子电解液(KPF6)的新型双碳电池[碳微球(C)为正极材料,膨胀石墨( )为负极材料],充电时总反应为:+xK++xC+=+xC(PF6),如图所示。下列叙述错误的是( ) A、放电时,K+在电解液中由A极向B极迁移但并未嵌入碳微球中 B、充电时,B极的电极反应式为xC(PF6)+xe-=xC+ C、放电时,每转移0.2mol电子时,电解液增重36.8g D、充放电过程中,在碳微球电极上可逆地嵌入/脱嵌
A、放电时,K+在电解液中由A极向B极迁移但并未嵌入碳微球中 B、充电时,B极的电极反应式为xC(PF6)+xe-=xC+ C、放电时,每转移0.2mol电子时,电解液增重36.8g D、充放电过程中,在碳微球电极上可逆地嵌入/脱嵌二、综合题
-
18. 氢气是一种清洁能源,绿色环保制氢技术研究具有重要意义。(1)、“热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
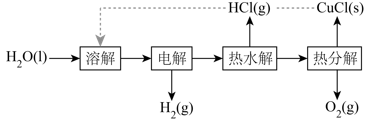
①电解在质子交换膜电解池中进行。阳极区为酸性溶液,阴极区为盐酸,电解过程中转化为。电解时阳极发生的主要电极反应为(用电极反应式表示)。
②电解后,经热水解和热分解的物质可循环使用。在热水解和热分解过程中,发生化合价变化的元素有(填元素符号)。
(2)、“热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收制得的溶液反应,生成、和;再经生物柴油副产品转化为Fe。①实验中发现,在时,密闭容器中溶液与铁粉反应,反应初期有生成并放出 , 该反应的离子方程式为。
②随着反应进行,迅速转化为活性 , 活性是转化为的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为。

③在其他条件相同时,测得Fe的转化率、的产率随变化如题图所示。的产率随增加而增大的可能原因是。
 (3)、从物质转化与资源综合利用角度分析,“热循环制氢和甲酸”的优点是。19. 工业上以氟磷灰石[ , 含等杂质]为原料生产磷酸和石膏,工艺流程如下:
(3)、从物质转化与资源综合利用角度分析,“热循环制氢和甲酸”的优点是。19. 工业上以氟磷灰石[ , 含等杂质]为原料生产磷酸和石膏,工艺流程如下:
回答下列问题:
(1)、酸解时有产生。氢氟酸与反应生成二元强酸 , 离子方程式为。(2)、部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比加入脱氟,充分反应后,;再分批加入一定量的 , 首先转化为沉淀的离子是。(3)、浓度(以计)在一定范围时,石膏存在形式与温度、浓度(以计)的关系如图甲所示。酸解后,在所得、为45的混合体系中,石膏存在形式为(填化学式);洗涤时使用一定浓度的硫酸溶液而不使用水,原因是 , 回收利用洗涤液X的操作单元是;一定温度下,石膏存在形式与溶液中和的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是(填标号)。
A.、、 B.、、
C.、、 D.、、
20. 废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为Culn0.5Ga0.5Se2。某探究小组回收处理流程如图:
已知:①镓(Ga)和铟(In)位于元素周期表ⅢA族,镓与铝元素相邻。
②硒(Se)位于元素周期表ⅥA族。
回答下列问题:
(1)、镓(Ga)原子结构示意图为。(2)、“酸浸氧化”时发生的主要氧化还原反应的离子方程式为。(3)、滤液Ⅰ中所含金属元素名称为。(4)、“滤渣Ⅰ”与SOCl2混合前需要洗涤、干燥,检验滤渣Ⅰ中SO是否洗净的操作:;SOCl2与一定量的水反应能产生两种气体,其中一种气体能使品红溶液褪色,写出SOCl2水解的化学方程式;“加热回流”中SOCl2的作用:一种是将氢氧化物转化为氯化物,另一种是。(5)、浓缩结晶后所得的GaCl3在“高温气相沉积”过程中发生的化学反应方程式为。(6)、如图表示氮化镓与铜组装成的人工光合系统的电池工作原理。电池工作时H+向(填“左”或“右”)池移动;当电路中转移1.6mol电子时,电池中液体质量(填“增重”还是“减轻”)g。 21. 由于油价飙升、能源多样化和能源供应安全需求,以及全球环境问题,使天然气成为一种全球性的能源,也使氢气被视为未来的能源媒介。国际上最为有效的制氢工艺是甲烷水蒸气重整反应,涉及的主要反应如下:
21. 由于油价飙升、能源多样化和能源供应安全需求,以及全球环境问题,使天然气成为一种全球性的能源,也使氢气被视为未来的能源媒介。国际上最为有效的制氢工艺是甲烷水蒸气重整反应,涉及的主要反应如下:反应I:CH4(g)+ H2O(g) CO(g) +3H2(g) △H1=+206 kJ·mol-1
反应II:CH4(g)+ 2H2O(g) CO2(g)+4H2(g) △H2=+165 kJ·mol-1
反应III:CO(g)+ H2O(g) CO2(g)+H2(g) △H3
回答下列问题:
(1)、△H3=。已知(R、C为常数),反应I、II、III的平衡常数与温度T的变化关系如图甲所示,其中表示反应II的是曲线(填标号)。 (2)、不同压强下,将甲烷和水蒸气按照物质的量之比为1:3的比例投料,测得平衡状态下某物质随温度的变化如图乙所示。图中纵坐标可以表示(填“CH4转化率”或“CO2物质的量分数”),压强p1、p2、p3由大到小的顺序是。
(2)、不同压强下,将甲烷和水蒸气按照物质的量之比为1:3的比例投料,测得平衡状态下某物质随温度的变化如图乙所示。图中纵坐标可以表示(填“CH4转化率”或“CO2物质的量分数”),压强p1、p2、p3由大到小的顺序是。 (3)、一定条件下,向恒容容器中以物质的量之比为1:3的比例投入甲烷和水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则H2的物质的量分数x(H2)= , 反应III以物质的量分数表示的平衡常数Kx=。 (可用分数表示)(4)、一种高性能甲烷燃料电池的工作原理如图丙所示,使用特定催化剂只发生反应I,以熔融碳酸盐(MCO3)为电解质,燃料电池负极的电极反应式为 。
(3)、一定条件下,向恒容容器中以物质的量之比为1:3的比例投入甲烷和水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则H2的物质的量分数x(H2)= , 反应III以物质的量分数表示的平衡常数Kx=。 (可用分数表示)(4)、一种高性能甲烷燃料电池的工作原理如图丙所示,使用特定催化剂只发生反应I,以熔融碳酸盐(MCO3)为电解质,燃料电池负极的电极反应式为 。 22. 大气污染物主要有氮的氧化物NOx和硫的氧化物SO2等。请回答下列问题:(1)、NO2有较强的氧化性,能将SO2氧化成SO3 , 自身被还原为NO。已知下列两反应过程中能量变化如图1、图2所示,则NO2氧化SO2生成SO3(g)的热化学方程式为。若上述反应过程中正反应的活化能Ea=112.2 kJ·mol-1 , 则逆反应的活化能Eb= kJ·mol-1。
22. 大气污染物主要有氮的氧化物NOx和硫的氧化物SO2等。请回答下列问题:(1)、NO2有较强的氧化性,能将SO2氧化成SO3 , 自身被还原为NO。已知下列两反应过程中能量变化如图1、图2所示,则NO2氧化SO2生成SO3(g)的热化学方程式为。若上述反应过程中正反应的活化能Ea=112.2 kJ·mol-1 , 则逆反应的活化能Eb= kJ·mol-1。 (2)、研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。已知:4NH3(g) + 6NO(g)5N2(g)+6H2O(g) ΔH=﹣1810kJ·mol-1 , 相同条件下,在2 L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化如图3所示。
(2)、研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。已知:4NH3(g) + 6NO(g)5N2(g)+6H2O(g) ΔH=﹣1810kJ·mol-1 , 相同条件下,在2 L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化如图3所示。
①在A、B、C三种催化剂的作用下,清除氮氧化物反应的活化能分别表示为Ea(A)、Ea(B)、Ea(C) ,根据图3曲线,判断三种催化剂条件下,活化能由小到大的顺序为。
②在氨气足量时,反应在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图4所示,据图可知,在相同的时间内,温度对脱氮率的影响是 , 其可能的原因是(已知A、B催化剂在此温度范围内不失效)。
(3)、NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染。已知:2NO(g) +2CO(g) N2(g) +2CO2(g) ΔH <0. 若一定温度下,向恒容容器中通入等物质的量的NO和CO气体,测得容器中压强随时间的变化关系如下表所示:t/ min
0
1
2
3
4
5
p/kPa
400
370
346
330
320
320
假设反应在恒定温度和标准压强下进行,则= (标准平衡常数 , 其中为标准压强(1 ×105 Pa),和 , 为各组分的平衡分压,如=·p总 , p总为平衡总压,为平衡系统中NO的物质的量分数)。
(4)、用电化学原理可以减少SO2排放,其装置如图5所示。H2O2从口进入,右侧电极的电极反应式为 , 若电路中通过2mol电子时,负极区n(H2SO4)=。