从巩固到提高 高考化学二轮微专题46 化学实验中的制备与收集
试卷更新日期:2023-02-11 类型:二轮复习
一、单选题
-
1. 实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )
 A、装置①常用于分离互不相溶的液体混合物 B、装置②可用于吸收NH3或HCl气体,并防止倒吸 C、装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 D、装置③可用于收集H2、CO2、Cl2、NH3等气体2. 用图装置制取干燥且纯净的气体(a、b表示加入的试剂),能实现的是( )
A、装置①常用于分离互不相溶的液体混合物 B、装置②可用于吸收NH3或HCl气体,并防止倒吸 C、装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 D、装置③可用于收集H2、CO2、Cl2、NH3等气体2. 用图装置制取干燥且纯净的气体(a、b表示加入的试剂),能实现的是( )
选项
气体
a
b
A
Cl2
浓盐酸
KMnO4
B
HI
浓磷酸
KI
C
NH3
浓氨水
CaO
D
SO2
70%浓硫酸
Na2SO3
A、A B、B C、C D、D3. 在实验室采用如图所示装置进行气体的干燥、收集和尾气处理,合理的是( )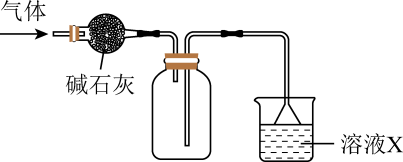
选项
气体
溶液X
A
NO
氢氧化钠溶液
B
NH3
水
C
SO2
氢氧化钠溶液
D
Cl2
饱和食盐水
A、A B、B C、C D、D4. 下列图示不能用于物质分离提纯操作的是( )A、 B、
B、 C、
C、 D、
D、 5. 超酸HSbF6是石油重整中常用的催化剂,实验室常以SbCl3、Cl2和HF为原料通过反应SbCl3+Cl2=SbCl5、SbCl5+6HF=HSbF6+5HCl制备。制备SbCl5的实验装置如图所示。已知:SbCl3的熔点73.4℃,沸点220.3℃,易水解;SbCl5的熔点3.5℃,液态SbCl5在140℃时即发生分解,2.9kPa下沸点为79℃,也易水解。下列说法错误的是( )
5. 超酸HSbF6是石油重整中常用的催化剂,实验室常以SbCl3、Cl2和HF为原料通过反应SbCl3+Cl2=SbCl5、SbCl5+6HF=HSbF6+5HCl制备。制备SbCl5的实验装置如图所示。已知:SbCl3的熔点73.4℃,沸点220.3℃,易水解;SbCl5的熔点3.5℃,液态SbCl5在140℃时即发生分解,2.9kPa下沸点为79℃,也易水解。下列说法错误的是( ) A、装置I中的a为冷凝水的进水口 B、装置II的主要作用是吸收Cl2和空气中的水蒸气 C、SbCl5制备完成后,可直接常压蒸馏分离出SbCl5 D、由SbCl5制备HSbF6时,不能选用玻璃仪器6. 氮化钡( Ba3N2)是一种重要的化学试剂。高温下,向氢化钡(BaH2)中通入氮气反应生成氮化钡,在实验室可用如图装置制备(每个装置只用一次)。已知: Ba3N2遇水反应; BaH2在潮湿空气中能自燃,遇水反应。下列说法错误的是( )
A、装置I中的a为冷凝水的进水口 B、装置II的主要作用是吸收Cl2和空气中的水蒸气 C、SbCl5制备完成后,可直接常压蒸馏分离出SbCl5 D、由SbCl5制备HSbF6时,不能选用玻璃仪器6. 氮化钡( Ba3N2)是一种重要的化学试剂。高温下,向氢化钡(BaH2)中通入氮气反应生成氮化钡,在实验室可用如图装置制备(每个装置只用一次)。已知: Ba3N2遇水反应; BaH2在潮湿空气中能自燃,遇水反应。下列说法错误的是( )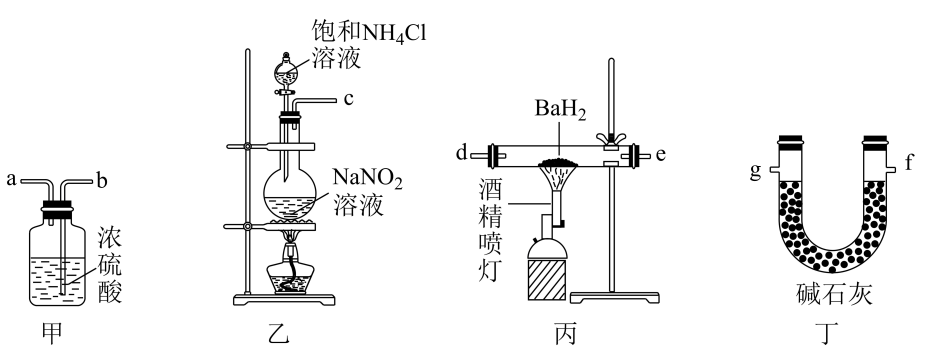 A、实验时,先点燃装置丙中的酒精喷灯,后点燃装置乙中的酒精灯 B、该实验装置中缺少尾气处理装置 C、按气流方向,装置的连接顺序可为c→b→a→d→e→g D、装置甲中的浓硫酸和装置丁中的碱石灰均可防止水蒸气进入装置丙中7. 用下列装置进行相应实验,能达到实验目的的是( )
A、实验时,先点燃装置丙中的酒精喷灯,后点燃装置乙中的酒精灯 B、该实验装置中缺少尾气处理装置 C、按气流方向,装置的连接顺序可为c→b→a→d→e→g D、装置甲中的浓硫酸和装置丁中的碱石灰均可防止水蒸气进入装置丙中7. 用下列装置进行相应实验,能达到实验目的的是( )选项
A
B
C
D
装置
溴乙烷消去反应产生的气体

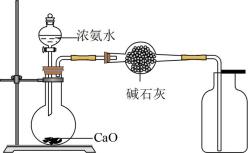


目的
验证溴乙烷消去产物具有还原性
制取并收集干燥的氨气
实验室焙烧硫酸铜晶体
实验室制取乙烯
A、A B、B C、C D、D8. 下列实验中,锥形瓶内均能产生气体。试管内不能产生沉淀的是( )
选项
试剂a
试剂b
试剂c
A
浓盐酸
KClO3
AgNO3溶液
B
浓H2SO4
少量蔗糖
AlCl3溶液
C
浓氨水
CaO
MgCl2溶液
D
稀HCl
CaCO3粉末
饱和Na2CO3溶液
A、A B、B C、C D、D9. 下列装置能达到实验目的的是( ) A、利用甲装置配制一定物质的量浓度的稀硫酸 B、利用乙装置制备并收集少量二氧化氮气体 C、利用丙装置由工业酒精制取无水酒精 D、利用丁装置从氯化镁溶液中获得无水10. 下列实验装置或实验操作正确,且能完成相应实验的是( )
A、利用甲装置配制一定物质的量浓度的稀硫酸 B、利用乙装置制备并收集少量二氧化氮气体 C、利用丙装置由工业酒精制取无水酒精 D、利用丁装置从氯化镁溶液中获得无水10. 下列实验装置或实验操作正确,且能完成相应实验的是( ) A、按照图甲中序号所示顺序向试管中加入试剂,制取乙酸乙酯 B、利用图乙所示装置收集NO气体 C、将通入图丙所示装置中进行尾气吸收 D、利用图丁装置验证碳酸钠和碳酸氢钠的稳定性11. 关于几种非金属元素及其化合物的说法正确的是( )A、C2H4分子中只有极性键 B、可用排空气法收集NO C、H2S燃烧时产生苍白色火焰 D、纯净干燥的Cl2没有漂白性12. 下列有关实验室制取Cl2的装置正确的是( )A、制备Cl2
A、按照图甲中序号所示顺序向试管中加入试剂,制取乙酸乙酯 B、利用图乙所示装置收集NO气体 C、将通入图丙所示装置中进行尾气吸收 D、利用图丁装置验证碳酸钠和碳酸氢钠的稳定性11. 关于几种非金属元素及其化合物的说法正确的是( )A、C2H4分子中只有极性键 B、可用排空气法收集NO C、H2S燃烧时产生苍白色火焰 D、纯净干燥的Cl2没有漂白性12. 下列有关实验室制取Cl2的装置正确的是( )A、制备Cl2 B、净化Cl2
B、净化Cl2 C、收集Cl2
C、收集Cl2 D、尾气处理
D、尾气处理 13. 下列装置能达到实验目的的是 ( )
13. 下列装置能达到实验目的的是 ( )A
B
C
D




实验室制氨气
蒸馏时的接收装置
除去中少量
吸收多余的气体
A、A B、B C、C D、D14. 利用下列仪器(夹持装置略)能完成的实验是( )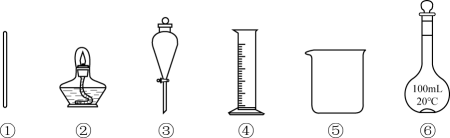 A、用四氯化碳萃取碘水中的碘 B、溶液的浓缩结晶 C、配制100mL的稀硫酸 D、除去苯甲酸晶体中的15. 用下列装置进行实验(部分夹持仪器已省略),不能达到实验目的的是( )
A、用四氯化碳萃取碘水中的碘 B、溶液的浓缩结晶 C、配制100mL的稀硫酸 D、除去苯甲酸晶体中的15. 用下列装置进行实验(部分夹持仪器已省略),不能达到实验目的的是( ) A、用甲装置制备并收集NH3 B、用乙装置进行NH3的喷泉实验 C、用丙装置制取少量乙酸乙酯 D、用丁装置制取氢氧化亚铁16. 三氯乙醛是生产农药、医药的重要中间体,实验室制备三氯乙醛的装置(加热仪器略)如图所示。已知:易溶于水和乙醇,易被HClO氧化生成。下列说法错误的是( )
A、用甲装置制备并收集NH3 B、用乙装置进行NH3的喷泉实验 C、用丙装置制取少量乙酸乙酯 D、用丁装置制取氢氧化亚铁16. 三氯乙醛是生产农药、医药的重要中间体,实验室制备三氯乙醛的装置(加热仪器略)如图所示。已知:易溶于水和乙醇,易被HClO氧化生成。下列说法错误的是( ) A、反应结束后可通过分液法分离出产品 B、反应过程中可能会生成副产物 C、装置c中主反应为 D、在b和c之间、d和e之间均需增加干燥装置
A、反应结束后可通过分液法分离出产品 B、反应过程中可能会生成副产物 C、装置c中主反应为 D、在b和c之间、d和e之间均需增加干燥装置二、多选题
-
17. 根据下列实验操作和现象所得到的实验结论正确的是( )
选项
实验操作和现象
实验结论
A
将废铁屑溶于过量盐酸,滴入KSCN溶液,未见溶液变为红色
而该废铁屑中不含Fe(III)
B
向Na2SO3溶液中先加入少量Ba(NO3)2溶液,生成白色沉淀,过滤、洗涤,然后再向沉淀中加入稀盐酸,沉淀不溶解
Na2SO3溶液已经变质
C
向CuSO4溶液中加入KI溶液,再加入苯,振荡,上层呈紫红色,下层有白色沉淀生成
Cu2+可以氧化I- , 白色沉淀可能为CuI
D
向盛有Ag2O固体的两支试管中分别加入稀硝酸和氨水,Ag2O均溶解
Ag2O是两性氧化物
A、A B、B C、C D、D三、实验探究题
-
18. 高纯度硝酸高铈铵主要用作有机合成的催化剂和氧化剂、集成电路的腐蚀剂等。它的化学式为(NH4)2[Ce(NO3)6] ,是一种橙红色单斜细粒结晶,易溶于水,几乎不溶于浓硝酸。实验室由9.99%的碳酸铈制备硝酸高铈铵时的主要步骤如下:
I.取适量碳酸铈[Ce2(CO3)3]于铂皿中,用硝酸溶解,配成一定浓度的硝酸铈溶液,过滤后待用。在搅拌条件下,向硝酸铈溶液中加入双氧水、氨水进行氧化沉淀,加热后过滤、洗涤、烘干得到Ce(OH)4(黃色难溶物)。
II.将Ce(OH)4于一定温度下加入硝酸加热至浆状,生成H2[Ce(NO3)6],再加入稍过量的NH4NO3晶体,二者反应生成硝酸高铈铵沉淀,经过滤、洗涤、自然烘干后得到产品。
回答下列问题:
(1)、①步骤I中使用铂皿而不使用铁质容器的原因是 , 写出生成Ce(OH)4的离子方程式:。②步骤I中进行“氧化沉淀”时,加热的温度不宜过高,原因是。
(2)、步骤I中的Ce(OH)4在实验室中可由Ce(OH)3制取,某同学设计了如下装置: 。
①装置a圆底烧瓶中盛放的固体药品为(填化学式)。
②当装置b中沉淀完全变为黄色后,停止通Cl2后改通空气(图中框内改为通空气装置)的目的是;将装置b中的反应混合物过滤、洗涤,能说明沉淀已洗涤干净的实验方法是。
(3)、步骤II中H2[Ce(NO3)6]与NH4NO3反应的化学方程式为。19. 亚硫酰氯(SOCl2)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,其熔点-105℃,沸点79℃,140℃以上时易分解。遇水剧烈反应生成SO2和另一种酸性气体,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。实验室合成SOCl2的原理之一为SO2+Cl2+SCl22SOCl2 , 部分装置(夹持、加热装置略去)如图所示。
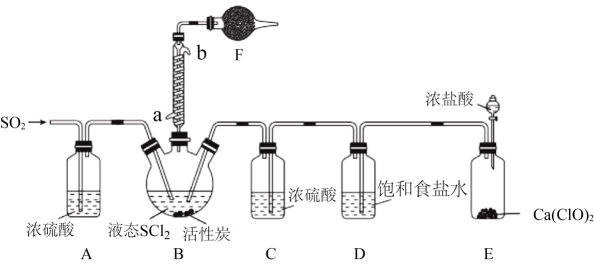 (1)、①仪器F的名称为 , 所盛的试剂是;
(1)、①仪器F的名称为 , 所盛的试剂是;②装置A、C除干燥气体外,另一作用可能是;
如果没有A、C,二氧化硫与氯气在装置B中会有副反应发生,该反应的离子方程式为
③E中反应的化学方程式:。
(2)、甲同学认为SOCl2和FeCl3∙6H2O混合加热可制得无水FeCl3 , 但乙同学认为该实验可能发生副反应使产品不纯。乙同学设计如下实验判断副反应的可能性:取少量FeCl3∙6H2O于试管中,加入足量SOCl2 , 充分反应后向试管中加水溶解,用四支试管各取溶解后的溶液少许,分别进行下列实验,通过现象能验证发生副反应的是(填选项字母)。a.滴加BaCl2溶液 b.滴加K3[Fe(CN)6]溶液
c.滴加酸性KMnO4溶液 d.滴加溴水
(3)、分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液,检验该溶液中存在Cl-的需要用到的试剂是20. 氯化亚铜(CuCl)是一种非常重要的化工原料。查阅资料可知:CuCl为白色固体,微溶于水,不溶于乙醇,在空气中能被迅速氧化。回答下列问题: (1)、I.氯化亚铜的制备
(1)、I.氯化亚铜的制备方案一:SO2还原氯化铜制备CuCl。
装置乙中发生反应的离子方程式为。反应完成后将乙中混合物过滤、洗涤、干燥。“过滤”操作最好选用下列装置中的(填字母),“洗涤”时用乙醇代替蒸馏水的优点是。

方案二:高温加热分解氯化铜晶体(CuCl2·xH2O)制备CuCl,装置如图(加热及夹持仪器省略)。
 (2)、检查装置气密性后加入药品,通入干燥HCl,加热,观察到B中固体由白色变为蓝色,C中试纸的颜色变化为。停止加热,冷却后改通N2.实验中通入HCl的目的是。(3)、Ⅱ.产品纯度的测定
(2)、检查装置气密性后加入药品,通入干燥HCl,加热,观察到B中固体由白色变为蓝色,C中试纸的颜色变化为。停止加热,冷却后改通N2.实验中通入HCl的目的是。(3)、Ⅱ.产品纯度的测定准确称取氯化亚铜产品mg,溶于过量的FeCl3溶液中得V1mL待测液,从中量取V2mL于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用amol·L-l硫酸铈[Ce(SO4)2]标准溶液滴定至终点,消耗Ce(SO4)2溶液bmL。产品中CuCl的质量分数为%。
(已知:CuCl+Fe3+=Cu2++Fe2++Cl- , Fe2++Ce4+=Fe3++Ce3+)
下列有关滴定的说法错误的是(填字母)。
A.未用标准溶液润洗滴定管会使测定结果偏低
B.滴定时要适当控制滴定速度
C.在接近终点时,使用“半滴操作”可提高滴定的准确度
D.滴定前滴定管尖嘴部分有气泡,滴定后无气泡会使测定结果偏低
-