从巩固到提高 高考化学二轮微专题44 化学实验的基本操作
试卷更新日期:2023-02-11 类型:二轮复习
一、单选题
-
1. 下列实验装置及操作均合理的是( )
 A、用装置甲测定污水样品中 B、用装置乙制备乙酸乙酯 C、用装置丙灼烧海带 D、用装置丁测定中和热2. 蒸馏过程中用不到的仪器是( )A、
A、用装置甲测定污水样品中 B、用装置乙制备乙酸乙酯 C、用装置丙灼烧海带 D、用装置丁测定中和热2. 蒸馏过程中用不到的仪器是( )A、 B、
B、 C、
C、 D、
D、 3. 下列说法错误的是( )A、呈粉色的变色硅胶干燥剂(含氯化钴),可通过烘干至蓝色后重新使用 B、如果不慎将苯酚沾到皮肤上,应立即先用酒精洗涤,再用水冲洗 C、测定镀锌铁皮锌镀层厚度时,未及时将铁片从稀硫酸中取出,会导致结果偏高 D、移液管和滴定管均标有使用温度,使用时均应进行检漏、润洗再装液4. 下列说法错误的是( )A、纸层析法可用来分离物理性质和化学性质相似的物质 B、久置的NaOH标准溶液,用来滴定时要重新标定浓度 C、滴定管内粘有油污,可用溶液浸洗,洗用后的放回原瓶 D、烫伤先用冷水洗,若皮肤已破可用溶液消毒5. 下列仪器是分液漏斗的是( )A、
3. 下列说法错误的是( )A、呈粉色的变色硅胶干燥剂(含氯化钴),可通过烘干至蓝色后重新使用 B、如果不慎将苯酚沾到皮肤上,应立即先用酒精洗涤,再用水冲洗 C、测定镀锌铁皮锌镀层厚度时,未及时将铁片从稀硫酸中取出,会导致结果偏高 D、移液管和滴定管均标有使用温度,使用时均应进行检漏、润洗再装液4. 下列说法错误的是( )A、纸层析法可用来分离物理性质和化学性质相似的物质 B、久置的NaOH标准溶液,用来滴定时要重新标定浓度 C、滴定管内粘有油污,可用溶液浸洗,洗用后的放回原瓶 D、烫伤先用冷水洗,若皮肤已破可用溶液消毒5. 下列仪器是分液漏斗的是( )A、 B、
B、 C、
C、 D、
D、 6. 名称为“蒸发皿”的仪器是( )A、
6. 名称为“蒸发皿”的仪器是( )A、 B、
B、 C、
C、 D、
D、 7. 下列装置对应操作正确且能达到实验目的的是( )
7. 下列装置对应操作正确且能达到实验目的的是( )装置
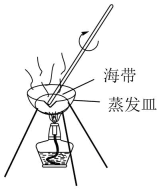


目的
A.将海带灼烧成灰烬
B.将Fe(OH)3胶体与FeCl3溶液分离
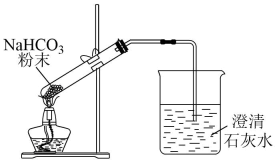
C.验证碳酸氢钠受热易分解
D.排掉碱式滴定管
胶管内的气泡
A、A B、B C、C D、D8. 下列玻璃仪器上未标明使用温度的是( )A、 B、
B、 C、
C、 D、
D、 9. 用下列装置进行相应实验,能达到实验目的的是( )
9. 用下列装置进行相应实验,能达到实验目的的是( )选项
A
B
C
D
装置
溴乙烷消去反应产生的气体



目的
验证溴乙烷消去产物具有还原性
制取并收集干燥的氨气
实验室焙烧硫酸铜晶体
实验室制取乙烯
A、A B、B C、C D、D10. 海带中含有丰富的碘元素,某化学兴趣小组设计的海带提碘实验流程如下图,下列说法中正确的是( ) A、上述流程中各步操作用到的仪器包括:
A、上述流程中各步操作用到的仪器包括: 、
、 、
、 、
、 、
、 B、“氧化”时,试剂可选用O2、H2O2或Br2
C、上述流程包括三个氧化还原反应和三种分离操作
D、“反萃取”时,反应的离子方程式为I2+2OH-=I-+IO+H2O
11. 下列说法正确的是( )A、蒸馏粗溴苯时,温度计的水银球应置于蒸馏烧瓶的支管口处 B、用托盘天平称量4.0gNaOH时,先在左右两盘分别放质量相同的称量纸再称量 C、可用重结晶法除去苯甲酸固体中混有的NaCl,因为苯甲酸在水中的溶解度很大 D、向CH2=CH-CH2-CHO中滴加酸性高锰酸钾溶液,若紫色退去,则证明其分子中含有碳碳双键12. 下列操作正确的是( )A、过滤沉淀时,用玻璃棒搅拌可加快过滤速率 B、可采用蒸发浓缩冷却结晶的方法从溶液中获取[Cu(NH3)4]SO4·H2O C、滴定终点时,发现盛标准液的滴定管尖嘴部分有悬滴,则所测待测液物质的量浓度偏大 D、用标准H2SO4溶液滴定待测NaOH溶液时,需量取25.00mLNaOH溶液于润洗过的锥形瓶中13. 水溶液中存在多种平衡,下列说法正确的是( )A、稀醋酸溶液稀释时,溶液中所有离子的物质的量浓度均减小 B、水溶液中,pH=7时,溶液一定呈中性 C、物质的量浓度相等的和溶液等体积混合,则 D、用已知浓度的NaOH溶液滴定未知浓度的溶液,若选用甲基橙做指示剂,滴定过程中水的电离程度先增大后减小14. 某同学用如图所示的装置(部分)制备乙酸乙酯,操作如下:连接实验装置,检查气密性。向圆底烧瓶中加入无水乙醇、浓硫酸、冰醋酸的混合物,并加入沸石,加热圆底烧瓶。充分反应后将该装置改成蒸馏装置,蒸馏获取粗产品。在获得的粗产品中加入饱和溶液,充分反应至无气泡逸出,将混合液倒入分液漏斗中,振荡、静置,收集下层液体即得粗制乙酸乙酯。该实验操作及制备装置中存在的错误共有几处?( )
B、“氧化”时,试剂可选用O2、H2O2或Br2
C、上述流程包括三个氧化还原反应和三种分离操作
D、“反萃取”时,反应的离子方程式为I2+2OH-=I-+IO+H2O
11. 下列说法正确的是( )A、蒸馏粗溴苯时,温度计的水银球应置于蒸馏烧瓶的支管口处 B、用托盘天平称量4.0gNaOH时,先在左右两盘分别放质量相同的称量纸再称量 C、可用重结晶法除去苯甲酸固体中混有的NaCl,因为苯甲酸在水中的溶解度很大 D、向CH2=CH-CH2-CHO中滴加酸性高锰酸钾溶液,若紫色退去,则证明其分子中含有碳碳双键12. 下列操作正确的是( )A、过滤沉淀时,用玻璃棒搅拌可加快过滤速率 B、可采用蒸发浓缩冷却结晶的方法从溶液中获取[Cu(NH3)4]SO4·H2O C、滴定终点时,发现盛标准液的滴定管尖嘴部分有悬滴,则所测待测液物质的量浓度偏大 D、用标准H2SO4溶液滴定待测NaOH溶液时,需量取25.00mLNaOH溶液于润洗过的锥形瓶中13. 水溶液中存在多种平衡,下列说法正确的是( )A、稀醋酸溶液稀释时,溶液中所有离子的物质的量浓度均减小 B、水溶液中,pH=7时,溶液一定呈中性 C、物质的量浓度相等的和溶液等体积混合,则 D、用已知浓度的NaOH溶液滴定未知浓度的溶液,若选用甲基橙做指示剂,滴定过程中水的电离程度先增大后减小14. 某同学用如图所示的装置(部分)制备乙酸乙酯,操作如下:连接实验装置,检查气密性。向圆底烧瓶中加入无水乙醇、浓硫酸、冰醋酸的混合物,并加入沸石,加热圆底烧瓶。充分反应后将该装置改成蒸馏装置,蒸馏获取粗产品。在获得的粗产品中加入饱和溶液,充分反应至无气泡逸出,将混合液倒入分液漏斗中,振荡、静置,收集下层液体即得粗制乙酸乙酯。该实验操作及制备装置中存在的错误共有几处?( )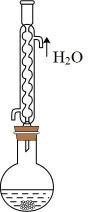 A、2 B、3 C、4 D、515. 用下列装置进行实验,仪器选择正确且能达到实验目的的是( )
A、2 B、3 C、4 D、515. 用下列装置进行实验,仪器选择正确且能达到实验目的的是( )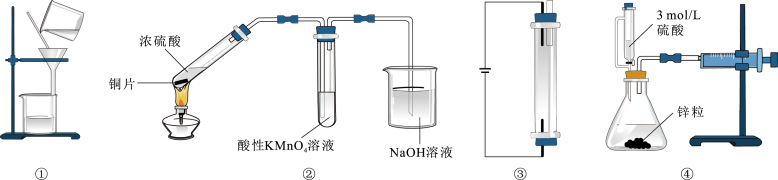 A、图①除去Fe(OH)3胶体中的Na+、Cl- B、图②可证明SO2有漂白性 C、图③用石墨作电极电解饱和食盐水生产NaClO D、图④测量生成氢气的体积16. 图(Ⅰ)和图(Ⅱ)分别为二元酸和乙二胺()溶液中各组分的百分含量随溶液pH的变化曲线(25℃)。
A、图①除去Fe(OH)3胶体中的Na+、Cl- B、图②可证明SO2有漂白性 C、图③用石墨作电极电解饱和食盐水生产NaClO D、图④测量生成氢气的体积16. 图(Ⅰ)和图(Ⅱ)分别为二元酸和乙二胺()溶液中各组分的百分含量随溶液pH的变化曲线(25℃)。
下列说法正确的是( )
A、根据图(Ⅰ),滴定分析时,可用酚酞作指示剂指示滴定终点 B、溶液显碱性 C、pH=4.02时, D、向溶液中通入一定量的HCl气体,则可能增大也可能减小二、实验探究题
-
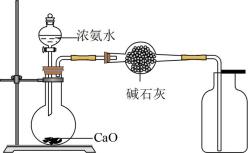
17. 化学工业为疫情防控提供了强有力的物质支撑,氯的许多化合物广泛应用于杀菌、消毒及化工领域。实验室中利用图装置(部分装置省略)制备和NaClO。

回答下列问题:
(1)、A中盛放浓盐酸的仪器名称为 , A中反应的化学方程式为。(2)、B装置的作用是。C中发生反应的离子方程式为 , D中使用冰水冷却的目的是。(3)、E中棉花团应蘸取的溶液是(填化学式),其作用是。(4)、也可用于消毒,则0.1mol的有效氯含量为g。(“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克的氧化能力。)18. 某同学查阅资料得知,在无水三氯化铝的催化作用下,利用乙醇制备乙烯的反应温度为120℃。反应装置如下图所示:
实验过程:检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝和10mL无水乙醇,点燃酒精灯加热。
请回答相关问题:
(1)、该催化机理如下所示,某同学判断该机理中一定有水生成,请写出生成H2O的步骤中反应方程式。 (2)、仪器B的名称为。该实验所采用的加热方式优点是。实验装置中还缺少的仪器是。(3)、B中无水氯化钙的作用是。甲同学认为可以将B装置改为装有浓硫酸的洗气瓶,老师否定了他的观点,理由是。(4)、气囊的作用是。其优点是。(5)、溴的四氯化碳溶液的作用是。(6)、中学教材中用乙醇和浓硫酸在170℃时制备乙烯。和教材实验相比,用三氯化铝做催化剂制备乙烯的优点有(任意写出两条即可)。19. 邻硝基苯酚(
(2)、仪器B的名称为。该实验所采用的加热方式优点是。实验装置中还缺少的仪器是。(3)、B中无水氯化钙的作用是。甲同学认为可以将B装置改为装有浓硫酸的洗气瓶,老师否定了他的观点,理由是。(4)、气囊的作用是。其优点是。(5)、溴的四氯化碳溶液的作用是。(6)、中学教材中用乙醇和浓硫酸在170℃时制备乙烯。和教材实验相比,用三氯化铝做催化剂制备乙烯的优点有(任意写出两条即可)。19. 邻硝基苯酚( )、对硝基苯酚(
)、对硝基苯酚( )是两种用途广泛的有机合成中间体,实验室可用苯酚(
)是两种用途广泛的有机合成中间体,实验室可用苯酚( )进行硝化制得。实验步骤和相关装置如下(其中夹持仪器和控温装置已省略):
)进行硝化制得。实验步骤和相关装置如下(其中夹持仪器和控温装置已省略):
I.在常温下,向装置①中的三口烧瓶中加入试剂:a.水;b.NaNO3;c.浓硫酸。
II.称取一定量苯酚,与少量温水混合,并冷却至室温。
III.在搅拌下,将苯酚水溶液自滴液漏斗滴入三口烧瓶中,将反应温度维持在15~ 20℃。
IV.加完苯酚后,继续搅拌1 h,冷却至黑色油状物固化,倾出酸层,然后用水洗涤数次。
V.邻硝基苯酚的收集:将油层利用装置②进行水蒸气蒸馏,得邻硝基苯酚粗品。
VI.对硝基苯酚的收集:在水蒸气蒸馏的残液中,加适量水,再加浓盐酸和少量活性炭,加热煮沸,趁热过滤,冷却结晶,分离得对硝基苯酚粗品。
已知:邻硝基苯酚、对硝基苯酚室温下在水中溶解度较小,邻硝基苯酚能与水蒸气一同挥发。
(1)、装置①、②中都使用了冷凝管,其中装置①中冷凝管的主要作用是。该冷凝管的进水口是(填字母)。(2)、装置①中硝化反应放出较多热量,容易发生副反应,需要控温在15~20℃ ,使用的方法是。(3)、装置①中加入试剂的先后顺序为(填标号)。A. acb B. cab C. cba
实验中生成NaHSO4 , 写出得到邻硝基苯酚的化学方程式:。
(4)、利用装置②进行水蒸气蒸馏时,少量邻硝基苯酚晶体会凝结在冷凝管内壁造成堵塞,可以采取的简便措施为。邻硝基苯酚能用水蒸气蒸馏的原因是(答出两条合理的原因)。(5)、步骤VI中趁热过滤的目的是。20. 实验室可利用SO2与Cl2在活性炭的催化下制取一种重要的有机合成试剂磺酰氯(SO2Cl2),所用的反应装置如图所示(部分夹持装置省略),使用甲装置既可以制备氯气,也可以制备SO2气体。已知:SO2Cl2的熔点为﹣54.1℃,沸点为69.1℃,密度1.67g/mL;SO2Cl2遇水能发生剧烈的水解反应,遇潮湿空气会产生白雾。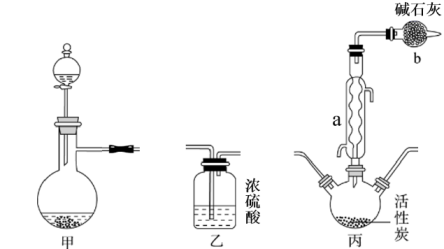 (1)、请写出该实验的仪器连接顺序:→→←←(用甲、乙、丙表示,可重复使用)。(2)、在实验前应该先对甲装置进行气密性检验,具体操作是。(3)、丙装置中仪器a的名称是 , 碱石灰的的作用。(4)、①甲装置中制备SO2时,试剂X、Y的组合最好是(填字母代号)。
(1)、请写出该实验的仪器连接顺序:→→←←(用甲、乙、丙表示,可重复使用)。(2)、在实验前应该先对甲装置进行气密性检验,具体操作是。(3)、丙装置中仪器a的名称是 , 碱石灰的的作用。(4)、①甲装置中制备SO2时,试剂X、Y的组合最好是(填字母代号)。A.98%浓硫酸+Cu B.70%H2SO4+Na2SO3固体
C.浓HNO3+Na2SO3固体 D.70%H2SO4+Na2SO3浓溶液
②甲装置中制备Cl2的化学方程式是。
(5)、SO2Cl2在潮湿的环境中对金属有强烈的腐蚀作用,结合方程式解释原因:。(6)、为测定所得产品的纯度,实验小组选用的方案是将一定体积的产品加入到足量Ba(NO3)2溶液中,过滤、洗涤、干燥,称量沉淀,然后计算含硫量,结果计算测得含硫量超过了100%,试分析造成这种结果的原因(每一步操作步骤均准确)。