从巩固到提高 高考化学二轮微专题43 氧化还原相关计算
试卷更新日期:2023-02-11 类型:二轮复习
一、单选题
-
1. 化合物R(结构式如图所示)具有强大的氧化能力,可有效改善水质。已知X、Y、Z、W是原子序数依次增大的前20号主族元素,X与W、Y与Z分别同主族,Z、W对应的简单离子核外电子排布相同。下列说法正确的是( )
 A、X与Y只能形成一种化合物 B、化合物R中Y的化合价有2种 C、W可与反应生成Y的单质 D、Y和Z形成的化合物的水溶液呈碱性2. 科学家近年发明了一种新型水介质电池。电池示意图如下,电极为金属锌和选择性催化材料。放电时,温室气体被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法正确的是( )
A、X与Y只能形成一种化合物 B、化合物R中Y的化合价有2种 C、W可与反应生成Y的单质 D、Y和Z形成的化合物的水溶液呈碱性2. 科学家近年发明了一种新型水介质电池。电池示意图如下,电极为金属锌和选择性催化材料。放电时,温室气体被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法正确的是( ) A、放电时,负极区pH升高 B、放电时,1mol转化为HCOOH,转移的电子数为4mol C、充电时,Zn电极连电源正极 D、充电时,产生22.4L(标准状况下) , 生成的Zn为130g3. 设为阿伏加德罗常数的值,下列说法正确的是( )A、1.8g含有的中子数为0.1 B、1L氨水中所含的数目为0.1 C、5.6g铁与足量稀盐酸反应、转移的电子数)0.3 D、124g(
A、放电时,负极区pH升高 B、放电时,1mol转化为HCOOH,转移的电子数为4mol C、充电时,Zn电极连电源正极 D、充电时,产生22.4L(标准状况下) , 生成的Zn为130g3. 设为阿伏加德罗常数的值,下列说法正确的是( )A、1.8g含有的中子数为0.1 B、1L氨水中所含的数目为0.1 C、5.6g铁与足量稀盐酸反应、转移的电子数)0.3 D、124g( )分子中所含的共价键数目为6
4. 部分含硫物质的分类与相应化合价及部分物质间转化关系如图所示。下列说法不正确的是( )
)分子中所含的共价键数目为6
4. 部分含硫物质的分类与相应化合价及部分物质间转化关系如图所示。下列说法不正确的是( ) A、a是一种有臭鸡蛋气味的气体 B、工业上由b制备e的路线:bcd C、c造成的酸雨雨水在空气中放置一段时间pH会增大 D、f、g正盐的阴离子可以在碱性溶液中共存5. 汽车碰撞时,安全气囊中发生反应:。若氧化产物比还原产物多7mol,下列说法错误的是( )A、生成8mol B、1mol被还原 C、转移7mol电子 D、15mol氮原子被氧化6. 氯磺酸是一种易水解的一元强酸,能与甲酸、苯等有机物反应。其与甲酸发生的反应为。下列说法错误的是( )A、将物质的量相等的与HCl分别溶于水制成1L溶液,前者的pH小 B、可与苯在一定条件下发生取代反应生成苯磺酸 C、中和溶液需要 D、与甲酸反应中每生成1mol HCl,转移电子的物质的量为2mol7. 下列说法正确的是( )A、室温下,1L0.1mol·L-1盐酸中H+的数目约为6.02×1022 B、标准状况下,5.6LCCl4中所含C—Cl键的数目约为6.02×1023 C、5.6gFe和足量Cl2反应转移电子的物质的量为0.2mol D、室温下,pH相同的盐酸和硫酸中,溶质的物质的量浓度相同8. 据2022年1月统计,我国光伏发电并网装机容量突破3亿千瓦,连续七年稳居全球首位。已知四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],工作原理如图。下列说法正确的是( )
A、a是一种有臭鸡蛋气味的气体 B、工业上由b制备e的路线:bcd C、c造成的酸雨雨水在空气中放置一段时间pH会增大 D、f、g正盐的阴离子可以在碱性溶液中共存5. 汽车碰撞时,安全气囊中发生反应:。若氧化产物比还原产物多7mol,下列说法错误的是( )A、生成8mol B、1mol被还原 C、转移7mol电子 D、15mol氮原子被氧化6. 氯磺酸是一种易水解的一元强酸,能与甲酸、苯等有机物反应。其与甲酸发生的反应为。下列说法错误的是( )A、将物质的量相等的与HCl分别溶于水制成1L溶液,前者的pH小 B、可与苯在一定条件下发生取代反应生成苯磺酸 C、中和溶液需要 D、与甲酸反应中每生成1mol HCl,转移电子的物质的量为2mol7. 下列说法正确的是( )A、室温下,1L0.1mol·L-1盐酸中H+的数目约为6.02×1022 B、标准状况下,5.6LCCl4中所含C—Cl键的数目约为6.02×1023 C、5.6gFe和足量Cl2反应转移电子的物质的量为0.2mol D、室温下,pH相同的盐酸和硫酸中,溶质的物质的量浓度相同8. 据2022年1月统计,我国光伏发电并网装机容量突破3亿千瓦,连续七年稳居全球首位。已知四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],工作原理如图。下列说法正确的是( ) A、光伏并网发电装置中N型半导体为正极 B、c为阳离子交换膜,d、e均为阴离子交换膜 C、保持电流恒定,升高温度可加快合成四甲基氢氧化铵的速率 D、制备182g四甲基氢氧化铵,两极共产生33.6L气体(标准状况)9. 液氨具有微弱的导电性,加入钠单质可快速得到深蓝色溶液,并慢慢产生气泡,溶液导电能力显著提升。下列说法错误的是( )
A、光伏并网发电装置中N型半导体为正极 B、c为阳离子交换膜,d、e均为阴离子交换膜 C、保持电流恒定,升高温度可加快合成四甲基氢氧化铵的速率 D、制备182g四甲基氢氧化铵,两极共产生33.6L气体(标准状况)9. 液氨具有微弱的导电性,加入钠单质可快速得到深蓝色溶液,并慢慢产生气泡,溶液导电能力显著提升。下列说法错误的是( ) A、液氨能够发生电离,有和生成 B、钠和液氨可发生反应: C、蒸发钠的液氨溶液,蓝色会逐渐褪去 D、0.1mol钠投入液氨中生成0.01mol时,Na共失去0.02mol电子10. 一种新型无隔膜可充电电池 , 水系电池以锌箔、石墨毡为集流体,和的混合液作电解质溶液,工作原理如图所示。
A、液氨能够发生电离,有和生成 B、钠和液氨可发生反应: C、蒸发钠的液氨溶液,蓝色会逐渐褪去 D、0.1mol钠投入液氨中生成0.01mol时,Na共失去0.02mol电子10. 一种新型无隔膜可充电电池 , 水系电池以锌箔、石墨毡为集流体,和的混合液作电解质溶液,工作原理如图所示。
下列说法正确的是( )
A、过程I为充电过程,a接电源的正极 B、为增强电池效率,可向电解液中加入硫酸以增强溶液的导电性 C、过程II为放电过程,石墨毡极的电极反应式为 D、放电时,当外电路转移2mol时,两电极质量变化的差值为22g11. SO2、NOx是重要化工原料,可用于硫酸、硝酸的生产。工业制硫酸时,接触室中主要反应为:2SO2(g)+O2(g) =2SO3(g) ΔH=-196.6 kJ·mol-1 , SO2、NOx也是大气主要污染物,NOx可与NH3混合,通过选择性催化剂高温脱除,SO2可通过碱液吸收去除。对于反应 2SO2(g)+O2(g) 2SO3(g),下列说法正确的是( )A、该反应ΔH<0 ΔS>0 B、2 mol SO2(g)和1 mol O2(g)所含键能总和比2 mol SO3(g)所含键能小 C、反应在高温、催化剂条件下进行可提高SO2的平衡转化率 D、该反应中每生成22.4 L SO3转移电子的数目约等于2×6.02×102312. 科学家发明了如图所示的新型Zn—CO2水介质电池,电极为金属锌和选择性催化材料,放电时,CO2被转化为储氢物质甲酸等。下列说法正确的是( ) A、放电时,负极反应式为:Zn+2e-+4OH-=Zn(OH) B、放电时,1 mol CO2完全转化为HCOOH,理论上转移4 mol电子 C、充电时,正极溶液中OH−浓度升高 D、充电时,电池总反应为:2Zn(OH)2Zn+O2↑+4OH-+2H2O13. 乙醚、75%乙醇、过氧乙酸(CH3COOOH)、氯仿等化学药品均可有效灭活新冠病毒。下列说法正确的是( )A、乙醚可由2分子乙醇脱水制得 B、乙醇通过氧化灭活病毒 C、过氧乙酸中O原子均为-2价 D、氯仿的化学名称是二氯甲烷14. 甲酸在催化作用下脱氢可生成CO2 , 反应机理和相对能量变化如图所示,下列说法正确的是( )
A、放电时,负极反应式为:Zn+2e-+4OH-=Zn(OH) B、放电时,1 mol CO2完全转化为HCOOH,理论上转移4 mol电子 C、充电时,正极溶液中OH−浓度升高 D、充电时,电池总反应为:2Zn(OH)2Zn+O2↑+4OH-+2H2O13. 乙醚、75%乙醇、过氧乙酸(CH3COOOH)、氯仿等化学药品均可有效灭活新冠病毒。下列说法正确的是( )A、乙醚可由2分子乙醇脱水制得 B、乙醇通过氧化灭活病毒 C、过氧乙酸中O原子均为-2价 D、氯仿的化学名称是二氯甲烷14. 甲酸在催化作用下脱氢可生成CO2 , 反应机理和相对能量变化如图所示,下列说法正确的是( )
 A、甲酸脱氢反应放热,因此不需要加热 B、在反应历程中,反应速率由形成H2并脱附一步决定 C、在催化剂表面离解C-H键比离解O-H键难 D、生成22.4LCO2时,转移电子数为2NA15. 镓(Ga)位于周期表中第四周期第IIIA族,与强酸、强碱溶液均能反应生成H2 , 是一种应用广泛的金属元素,可用于制造半导体材料氮化镓、砷化镓、磷化镓等。同温同压下, 分别与 浓度均为 的盐酸和氢氧化钠溶液充分反应,生成H2的体积分别为 和 。下列说法错误的是( )A、 B、转移的电子数之比为 C、消耗酸和碱的物质的量之比为 D、反应前后两溶液的质量变化相等16. 铁器表面氧化层的成分有多种:致密的Fe3O4、疏松的FeO(OH)和FeOCl,它们均难溶于水。下列说法错误的是( )A、有氧条件下 与 转化为 ,周围环境的 增大 B、 可自发转变为 ,说明 的溶解度小于 C、检验 中是否含有 ,可选用的试剂是稀硫酸和 溶液 D、 完全转化为 时转移 电子17. 水合肼 的性质类似氨水。利用水合肼处理铜氨 废液回收铜粉的实验流程如图:
A、甲酸脱氢反应放热,因此不需要加热 B、在反应历程中,反应速率由形成H2并脱附一步决定 C、在催化剂表面离解C-H键比离解O-H键难 D、生成22.4LCO2时,转移电子数为2NA15. 镓(Ga)位于周期表中第四周期第IIIA族,与强酸、强碱溶液均能反应生成H2 , 是一种应用广泛的金属元素,可用于制造半导体材料氮化镓、砷化镓、磷化镓等。同温同压下, 分别与 浓度均为 的盐酸和氢氧化钠溶液充分反应,生成H2的体积分别为 和 。下列说法错误的是( )A、 B、转移的电子数之比为 C、消耗酸和碱的物质的量之比为 D、反应前后两溶液的质量变化相等16. 铁器表面氧化层的成分有多种:致密的Fe3O4、疏松的FeO(OH)和FeOCl,它们均难溶于水。下列说法错误的是( )A、有氧条件下 与 转化为 ,周围环境的 增大 B、 可自发转变为 ,说明 的溶解度小于 C、检验 中是否含有 ,可选用的试剂是稀硫酸和 溶液 D、 完全转化为 时转移 电子17. 水合肼 的性质类似氨水。利用水合肼处理铜氨 废液回收铜粉的实验流程如图:
下列说法错误的是( )
A、上述三步反应过程均为氧化还原反应 B、反应1的目的是制备 C、合成水合肼的反应中每消耗 转移电子数为 D、反应2完成后要用到过滤操作18. 向含HCN的废水中加入铁粉和K2CO3可制备K4[Fe(CN)6],反应如下:6HCN+Fe+2K2CO3=K4[Fe(CN)6]+H2↑+2CO2↑+2H2O。下列说法错误的是( )A、依据反应可知:Ka(HCN)>Ka1(H2CO3) B、HCN的结构式是H—C≡N C、反应中每1molFe转移2mol电子 D、[Fe(CN)6]4-中Fe2+的配位数是619. 下列有关物质和反应的叙述中,正确的是( )A、反应的 B、为了增强溶液的氧化性,可选用浓盐酸进行酸化 C、电解饱和NaCl溶液制取氯气时,可用铁作阳极、石墨作阴极 D、浓盐酸与足量共热反应,可生成20. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、由H218O与D216O组成的4.0 g混合物含中子数为2NA B、100 mL 0.1 mol/LCH3COONa溶液中阴离子数目大于0.01NA C、标准状况下,22.4 L甲醇中含有-OH的数目为NA个 D、某密闭容器中0.1molNa2O2和0.1 mol SO2充分反应,转移电子的数目为0.2NA21. 催化还原氮氧化物是目前应用最广泛的烟气脱硝技术。用活化后的作催化剂,将NO还原成的一种反应历程如图所示:
下列说法正确的是( )
A、增大浓度会影响催化剂对其它气体的吸附 B、总反应的化学方程式为 C、反应过程中催化剂本身未发生价态的变化 D、当消耗标准状况下时,整个过程转移6mol电子二、解答题
-
22. 在制备NiOOH的某种工艺流程,所得NiOOH常会混有 , 其组成可表示为。现称取10.14g样品溶于稀硫酸,加入100mL 1.0000 标准溶液,搅拌至溶液清亮,定容至200mL。取出20.00mL,用0.0100 标准溶液滴定,用去标准溶液20.00mL,请通过计算确定x:y的值并写出计算过程。涉及反应如下:
三、综合题
-
23. 2020年人类在金星大气中探测到磷化氢( , 也叫膦),也是一种储粮用的熏蒸杀虫剂。(1)、在密闭粮仓放置的磷化钙()片剂,遇水蒸气放出气体。该反应的化学方程式为。(2)、可以采取类似于实验室制取氨气的方法来制取 , 写出PH4I固体和NaOH固体制取的化学方程式:。(3)、工业上,由磷矿制备膦的一种工艺如下:

已知: , 回答下面问题:
①已知白磷在空气中易自燃,将和CO分离得到最经济科学的方法是。
②属于元酸,属于。(填“酸式盐”“正盐”或“碱式盐”)
③白磷和氢氧化钾溶液反应中氧化剂和还原剂物质的量之比是。
④吸入磷化氢会对心脏、呼吸系统、肾、肠胃、神经系统和肝脏造成影响。磷化氢中毒时,可以口服硫酸铜溶液催吐,并解毒:。那么消耗2mol时转移电子mol。
24. 根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:(1)、还原产物是。还原剂与还原产物的物质的量之比为。(2)、当有2 mol HNO3参加反应时,被氧化的物质质量为g。25. 铂钌催化剂是甲醇燃料电池的阳极催化剂。一种以钌矿石[主要含Ru(CO3)2 , 还含少量的FeO、MgO、RuO4、CaO、SiO2]为原料制备钌(Ru)的流程如图。回答下列问题: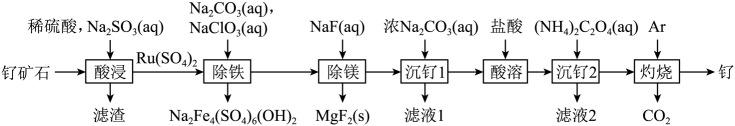 (1)、Na2Fe4(SO4)6(OH)2中Fe的化合价为。(2)、“酸浸”时,Na2SO3的作用。“滤渣”的主要成分有SiO2和(填化学式)。“酸浸”中钌的浸出率与浸出温度、pH的关系如图所示,“酸浸”的最佳条件是。
(1)、Na2Fe4(SO4)6(OH)2中Fe的化合价为。(2)、“酸浸”时,Na2SO3的作用。“滤渣”的主要成分有SiO2和(填化学式)。“酸浸”中钌的浸出率与浸出温度、pH的关系如图所示,“酸浸”的最佳条件是。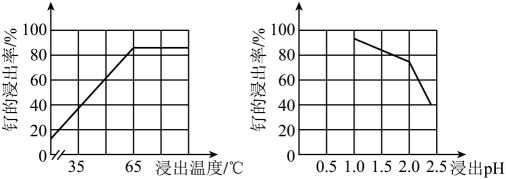 (3)、“除铁”的离子方程式为。(提示:1molNaClO3参与反应,转移6mol电子)(4)、从“滤液2”中可提取一种化肥,其电子式为。(5)、“灼烧”时Ar的作用是。(6)、某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为。(保留三位有效数字)26. 发蓝工艺是将钢铁浸入热的NaNO2碱性溶液中,在其表面形成一层四氧化三铁薄膜。其中铁经历了如下转化:
(3)、“除铁”的离子方程式为。(提示:1molNaClO3参与反应,转移6mol电子)(4)、从“滤液2”中可提取一种化肥,其电子式为。(5)、“灼烧”时Ar的作用是。(6)、某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为。(保留三位有效数字)26. 发蓝工艺是将钢铁浸入热的NaNO2碱性溶液中,在其表面形成一层四氧化三铁薄膜。其中铁经历了如下转化:
其中②的化学方程式为:Na2FeO2+NaNO2+H2ONa2Fe2O4+NH3↑+NaOH(未配平)。
完成下列填空:
(1)、Na原子核外有种能量不同的电子,其中能量最高的电子所占的电子亚层符号为。将反应②中涉及的短周期元素,按原子半径由大到小顺序排列。(2)、NH3分子的结构式为。从原子结构的角度解释氮元素的非金属性比氧元素弱的原因。(3)、配平反应②的化学方程式。若反应生成11.2 L(标准状态)氨气,则电子转移的数目为。(4)、反应③中Na2FeO2与Na2Fe2O4的物质的量之比为。写出Fe→Fe3O4的置换反应的化学方程式27. 纳米零价铁(ZVI)因其高比表面积、优异的吸附性、较强的还原性和反应活性等优点被广泛应用于污染物的去除。(1)、ZVI可通过FeCl2·4H2O和NaBH4溶液反应制得,同时生成H2、B(OH) , 制备过程中需要不断通入高纯氮气,其目的是。(2)、ZVI电化学腐蚀处理三氯乙烯进行水体修复,H+、O2、等物种的存在会影响效果,水体修复的过程如图所示。有效腐蚀过程中,生成1mol乙烯所转移的电子物质的量为mol,过程④对应的电极反应式为。 (3)、ZVI可去除废水中Pb2+ , pH<6时,pH对Pb2+的去除率的影响如图所示。
(3)、ZVI可去除废水中Pb2+ , pH<6时,pH对Pb2+的去除率的影响如图所示。
已知:ⅰ)在水中,ZVI表面的FeOH会因为质子化/去质子化作用而使其表面带正/负电荷,可表示为:FeOH+H+FeOH , FeOHFeO-+H+。pH约为8.1达到等电点,ZVI表面不带电。
ⅱ)pH<6时,ZVI去除Pb2+主要发生表面配位反应和还原反应:
2FeOH+ Pb2+(FeO)2Pb + 4H+
2Fe+ 3Pb2++ 4H2O3Pb+2FeOOH + 6H+
①pH<6时,铁氧化物颗粒不易吸附Pb2+的原因是。
②pH<6时,随着pH增大,Pb2+的去除率会增大至接近100%的原因是。
(4)、催化剂协同ZVI能将水体中的硝酸盐()转化为N2 , 其催化还原反应的过程如图所示。为有效降低水体中氮元素的含量,宜调整水体pH为4.2,当pH<4.2时,随pH减小,N2生成率逐渐降低的原因是。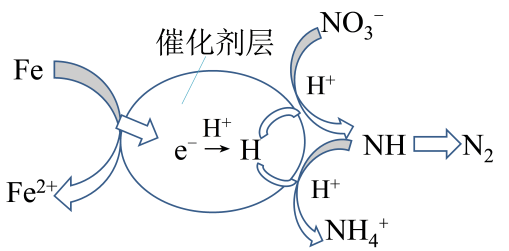
-