从巩固到提高 高考化学二轮微专题39 氢键
试卷更新日期:2023-02-11 类型:二轮复习
一、单选题
-
1. 下列关于HF、、的说法错误的是( )A、HF、、都是由极性键形成的极性分子 B、HF、、中共价键键长逐渐增大,键能逐渐减小 C、、的中心原子杂化方式相同 D、比HF的沸点高是由于HF分子间不能形成氢键2. 下列对有关事实的解释正确的是( )
选项
事实
解释
A
NH3的热稳定性比PH3强
NH3分子间能形成氢键
B
基态Fe3+比Fe2+稳定
基态Fe3+价电子排布式为3d5 , 是半充满的稳定结构
C
石墨能够导电
石墨是离子晶体
D
CH4与H2O分子的空间构型不同
它们中心原子杂化轨道类型不同
A、A B、B C、C D、D3. 3体积浓硝酸和1体积浓盐酸组成的混合液叫做反王水,腐蚀能力强于王水,含有一种氧化性很强的离子(如图所示),其中不含氢元素。下列叙述错误的是( )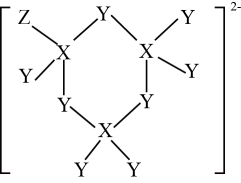 A、原子半径:r(Z)>r(X)>r( Y) B、X、Z均能与Y形成多种化合物 C、该离子中各元素原子均满足8电子稳定结构 D、X、Y、Z的气态氢化物中,沸点最高的是X的气态氢化物4. 聚氨酯是一种应用广泛的有机材料,可根据需求调节其硬度,其结构片段如图。
A、原子半径:r(Z)>r(X)>r( Y) B、X、Z均能与Y形成多种化合物 C、该离子中各元素原子均满足8电子稳定结构 D、X、Y、Z的气态氢化物中,沸点最高的是X的气态氢化物4. 聚氨酯是一种应用广泛的有机材料,可根据需求调节其硬度,其结构片段如图。 (R、R'表示短碳链,
(R、R'表示短碳链, 表示长碳链)
表示长碳链)下列有关聚氨酯的说法错误的是( )
A、聚氨酯在一定条件下能发生水解 B、聚氨酯中只含有酯基 C、聚氨酯链之间可形成氢键,增大材料的硬度 D、的值越大,聚氨酯材料的硬度越大5. X、Y、Z、W是处于不同周期的前四周期常见元素,原子序数依次递增。Y原子最外层电子数是周期序数的3倍,基态z原子核外s能级与p能级电子数之比为。由上述元素组成的物质转化关系如图所示,其中m、n、q为单质,其它为化合物,甲具有磁性,丙为二元强酸。下列说法错误的是( )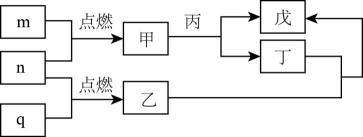 A、乙与丁反应物质的量之比为 B、乙分子构型为Ⅴ型 C、丙分子间可形成氢键 D、向戊中通入n可生成丁6. 2022年2月,第24届冬奥会在北京成功举办。下列有关说法正确的是( )A、为保证食物的口感和安全性,不能在食品中添加任何食品添加剂 B、北京冬奥会上,礼仪服饰采用高科技石墨烯发热材料,石墨烯属于有机高分子材料 C、冰的密度比水小,是因为水分子内存在氢键 D、“绿色奥运”是本届奥运会的理念之一,采用风能和太阳能为奥运服务体现了这一理念7. 可作为下列有机合成反应的催化剂。下列说法正确的是 ( )
A、乙与丁反应物质的量之比为 B、乙分子构型为Ⅴ型 C、丙分子间可形成氢键 D、向戊中通入n可生成丁6. 2022年2月,第24届冬奥会在北京成功举办。下列有关说法正确的是( )A、为保证食物的口感和安全性,不能在食品中添加任何食品添加剂 B、北京冬奥会上,礼仪服饰采用高科技石墨烯发热材料,石墨烯属于有机高分子材料 C、冰的密度比水小,是因为水分子内存在氢键 D、“绿色奥运”是本届奥运会的理念之一,采用风能和太阳能为奥运服务体现了这一理念7. 可作为下列有机合成反应的催化剂。下列说法正确的是 ( ) A、中σ键与π键的个数相等 B、甲分子中采取杂化的碳原子有6个 C、有机物乙的沸点低于对羟基苯甲醛(
A、中σ键与π键的个数相等 B、甲分子中采取杂化的碳原子有6个 C、有机物乙的沸点低于对羟基苯甲醛(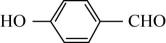 )的沸点
D、常温下,中键比中键易断裂
8. 下列有关物质结构与性质的说法中正确的是( )A、碳正离子呈平面三角形 B、是第四周期未成对电子数最多的元素 C、物质的熔沸点:(金刚石) D、冰分子中的化学键-氢键可以表示为9. 下列说法正确的是( )A、次氯酸的结构式为:H-Cl-O B、虚线表示邻烃基苯甲醛的分子间氢键:
)的沸点
D、常温下,中键比中键易断裂
8. 下列有关物质结构与性质的说法中正确的是( )A、碳正离子呈平面三角形 B、是第四周期未成对电子数最多的元素 C、物质的熔沸点:(金刚石) D、冰分子中的化学键-氢键可以表示为9. 下列说法正确的是( )A、次氯酸的结构式为:H-Cl-O B、虚线表示邻烃基苯甲醛的分子间氢键: C、醛基的碳氧双键有极性:
C、醛基的碳氧双键有极性: D、组成天然蛋白质的氨基酸可以表示为
D、组成天然蛋白质的氨基酸可以表示为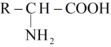 10. 某物质在水溶液中得到了如图所示的结构,虚线表示氢键,其中X、Y、Z和M是原子序数依次增大的短周期元素。下列说法错误的是( )
10. 某物质在水溶液中得到了如图所示的结构,虚线表示氢键,其中X、Y、Z和M是原子序数依次增大的短周期元素。下列说法错误的是( )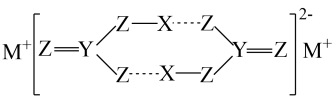 A、非金属性: Z>Y B、该结构中Z均满足8电子稳定结构 C、M的焰色试验呈黄色 D、氢键的存在使该物质在水中的溶解性较大11. 工业上用CH3OH与H2O重整生产原料气H2 , 并有少量的CO、CH3OCH3等副产物。CO会使催化剂中毒,可用CH3COO[Cu(NH3)2]溶液吸收。下列说法正确的是( )A、CH3OCH3是非极性分子 B、CH3COO[Cu(NH3)2]中N—H键角大于NH3分子中N—H键角 C、CH3OH和CH3OCH3分子之间均只存在范德华力 D、CH3COO[Cu(NH3)2]中C原子的杂化方式都为sp3
A、非金属性: Z>Y B、该结构中Z均满足8电子稳定结构 C、M的焰色试验呈黄色 D、氢键的存在使该物质在水中的溶解性较大11. 工业上用CH3OH与H2O重整生产原料气H2 , 并有少量的CO、CH3OCH3等副产物。CO会使催化剂中毒,可用CH3COO[Cu(NH3)2]溶液吸收。下列说法正确的是( )A、CH3OCH3是非极性分子 B、CH3COO[Cu(NH3)2]中N—H键角大于NH3分子中N—H键角 C、CH3OH和CH3OCH3分子之间均只存在范德华力 D、CH3COO[Cu(NH3)2]中C原子的杂化方式都为sp3二、综合题
-
12. 回答下列问题(1)、锌的四种卤化物晶体的熔点数据如下表:
物质
熔点/℃
827
275
394
446
与熔点相差较大,、、熔点依次增大,原因是。
(2)、已知顺、反丁烯二酸的相关数据如下表:物质
电离平衡常数
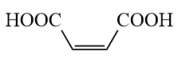

从结构角度分析顺丁烯二酸的小于反丁烯二酸的的原因是。
13. 回答下列问题:(1)、氢键存在于分子之间,也可以存在分子内,如邻羟基苯甲醛存在分子内氢键,导致它的沸点比对羟基苯甲醛低,氢键用X—H…Y表示,画出邻羟基苯甲醛分子的内氢键。(2)、苯酚常温下在水中溶解度不大,但高于65°时,它能与水任何比例互溶,原因是。(3)、三种晶体的熔点数据如下:物质
熔点
280℃
3550℃
3652℃
和金刚石熔点相差大,石墨的熔点比金刚石高,原因是。
14. 青蒿素()是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。 (1)、提取青蒿素
(1)、提取青蒿素在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚()提取,效果更好。
①乙醚的沸点低于乙醇,原因是。
②用乙醚提取效果更好,原因是。
(2)、确定结构①测量晶胞中各处电子云密度大小,可确定原子的位置、种类。比较青蒿素分子中C、H、O的原子核附近电子云密度大小:。
②图中晶胞的棱长分别为a、b、c , 晶体的密度为。(用表示阿伏加德罗常数;;青蒿素的相对分子质量为282)
③能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是。
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)、修饰结构,提高疗效一定条件下,用将青蒿素选择性还原生成双氢青蒿素。

①双氢青蒿素分子中碳原子的杂化轨道类型为。
②的空间结构为。
双氢青蒿素比青蒿素水溶性更好,治疗疟疾的效果更好。
15. 氢键对生命活动具有重要意义。DNA中四种碱基间的配对方式如图。(~代表糖苷键)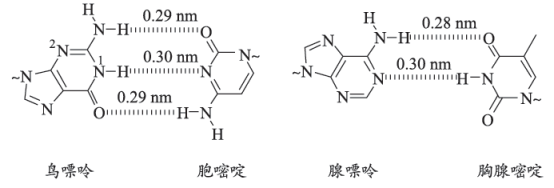 (1)、基态N的核外电子排布式为。(2)、碱基中的—NH2具有一定的碱性,可以结合H+形成—NH , 从结构角度解释可以结合的原因:。(3)、鸟嘌呤是一种常见的碱基。
(1)、基态N的核外电子排布式为。(2)、碱基中的—NH2具有一定的碱性,可以结合H+形成—NH , 从结构角度解释可以结合的原因:。(3)、鸟嘌呤是一种常见的碱基。①鸟嘌呤中2号N的杂化类型为。
②鸟嘌呤中N—H键的平均键长。(填“大于”“小于”或“等于”)0.29nm。
(4)、氢键在DNA复制过程中起重要作用①碱基中,O、N能与H形成氢键而C不能,原因是。
②下列说法正确的是(填序号)。
a.氢键的强度较小,在DNA解旋和复制时容易断裂和形成
b.鸟嘌呤与胞嘧啶之间的相互作用比腺嘌呤与胸腺嘧啶之间的更强
c.碱基配对时,一个H可以同时与多个原子形成氢键
(5)、一定条件下鸟嘌呤会发生异构化,其1号N上的H会转移到O上形成-OH。①鸟嘌呤异构化后的结构简式为。
②鸟嘌呤异构化后最有可能配对的嘧啶碱基是。。
16. 碳元素能形成多种单质及化合物,在生产生活中有重要的研究和应用价值。请根据以下信息,回答下列问题。(1)、邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如下图所示。
①在元素周期表中铜位于区(填“s”、“p”、“d”或“ds”)。C、N、O三种元素的电负性由大到小的顺序为。
②邻氨基吡啶的铜配合物中,Cu2+的配位数是 , N原子的杂化类型有。
(2)、化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。①1体积水可溶解约1体积CO2 , 1体积水可溶解约700体积NH3 , NH3极易溶于水的原因是 , 反应时,向饱和NaCl溶液中先通入。
②NaHCO3分解得Na2CO3 , 空间结构为。
(3)、碳原子构成的单质具有多种同素异形体,也对应着有多种不同晶体类型。①下图为石墨和石墨烯的结构示意图。石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。下列关于石墨与石墨烯的说法正确的是。

A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取sp3杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.石墨烯中平均每个六元碳环含有2个碳原子
②利用皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管可以合成T-碳,T-碳的晶体结构可看成金刚石晶体中每个碳原子被正四面体结构单元(由四个碳原子组成)取代,如图所示(其中图(a)、(b)为T-碳的晶胞和俯视图,图(c)为金刚石晶胞)。

一个T-碳晶胞中含有个碳原子,T-碳的密度非常小为金刚石的一半,则T-碳晶胞的边长和金刚石晶胞的边长之比为。
17. 氮、磷、铁、铜、钇在现代工农业、科技及国防建设等领域中都有着广泛的应用。回答下列问题:(1)、基态磷原子核外电子共有种空间运动状态。磷原子在成键时,能将一个3s电子激发进入3d能级而参与成键,写出该激发态磷原子的核外电子排布式。(2)、已知偏二甲肼[(CH3)2NNH2]、肼(N2H4)均可做运载火箭的主体燃料,其熔沸点见表。物质
熔点
沸点
偏二甲肼
-58℃
63.9℃
肼
1.4℃
113.5℃
偏二甲肼中氮原子的杂化方式为 , 二者熔沸点存在差异的主要原因是。
(3)、N4H只有一种化学环境的氢原子,结构如图所示,其中的大π键可表示为(分子中的大π键可用符号Π表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯分子中的大π键可表示为Π)。 (4)、Cu2+可形成[Cu(X)2]2+ , 其中X代表CH3—NH—CH2—CH2—NH2。1mol[Cu(X)2]2+中,VSEPR模型为正四面体的非金属原子共有mol。(5)、铁酸钇是一种典型的单相多铁性材料,其正交相晶胞结构如图。
(4)、Cu2+可形成[Cu(X)2]2+ , 其中X代表CH3—NH—CH2—CH2—NH2。1mol[Cu(X)2]2+中,VSEPR模型为正四面体的非金属原子共有mol。(5)、铁酸钇是一种典型的单相多铁性材料,其正交相晶胞结构如图。
铁酸钇的化学式为。已知1号O原子分数坐标为(0,0,),2号O原子分数坐标为( , -m,-n),则3号Fe原子的分数坐标为。已知铁酸钇的摩尔质量为Mg·mol-1 , 晶体密度为ρg·cm-3 , 阿伏加德罗常数的值为NA , 该晶胞的体积为pm3(列出表达式)。
18. 请回答下列问题:(1)、纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的电子排布图为。向硫酸铜溶液逐滴加入氨水,会先生成难溶物然后溶解形成深蓝色溶液,写出难溶物溶于NH3分子的离子方程式 , 不考虑空间构型,使溶液显示深蓝色的微粒的结构可用示意图表示为。(2)、2﹣巯基烟酸 ( )水溶性优于2﹣巯基烟酸氧钒配合物 (
)水溶性优于2﹣巯基烟酸氧钒配合物 ( )的原因是。 (3)、名原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是____。A、SO2 B、 C、H2S D、CS2(4)、尿素 (H2NCONH2)尿素分子中,原子杂化轨道类型有 , σ键与π键数目之比为。(5)、氮化硼 (BN )是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼 (如图1 )和六方氮化硼 (如图2),前者类似于金刚石,后者与石墨相似。
)的原因是。 (3)、名原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是____。A、SO2 B、 C、H2S D、CS2(4)、尿素 (H2NCONH2)尿素分子中,原子杂化轨道类型有 , σ键与π键数目之比为。(5)、氮化硼 (BN )是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼 (如图1 )和六方氮化硼 (如图2),前者类似于金刚石,后者与石墨相似。
①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为 (0,0,0),D为 ( , , 0),则E原子的坐标参数为。X﹣射线衍射实验测得立方氮化硼晶胞边长为361.5pm,则立方氮化硼晶体中N与B的原子半径之和为pm (只列计算式)。
②已知六方氮化硼同层中B﹣N距离为acm,密度为dg/cm3 , 则层与层之间距离的计算表这式为pm (已知正六边形面积为 , a为边长)。
③同一周期中,第一电离能介于B、N之间的元素有种。
19. 回答下列问题(1)、四种元素的原子半径如下表:元素符号
Li
Be
Na
S
Cl
原子半径/pm
152
89
186
102
99
由此可推理:决定原子半径大小的因素有
(2)、和都是化工生产中的重要物质。①的沸点(-33.5℃)高于的沸点(-129℃)的主要原因是
②的一种下游产品三聚氟氰(分子式为:),分子结构中显示有环状结构,请从价键理论和物质的相对稳定性角度写出三聚氟氰的结构式。
20. 富镍三层状氧化物LiNi0.8Co0.1Mn0.1O2(NCM811)作为新一代锂电池的正极材料,被广泛关注和深入研究,纳米级TiO2形成的表面包覆对提高该材料的性能效果明显。回答下列问题。(1)、基态氧原子中能量最高的电子,其电子云有个伸展方向 (取向) ;基态Mn原子的电子排布式为。(2)、Ni2+在水中以水合离子[Ni(H2O)6]2+形式存在,它与乙二胺 ( , 简写为en)反应后溶液变为蓝色,反应为: [Ni(H2O)6]2+ + 2en= [Ni(en)2(H2O)2]2+ (蓝色)+ 4H2O。
, 简写为en)反应后溶液变为蓝色,反应为: [Ni(H2O)6]2+ + 2en= [Ni(en)2(H2O)2]2+ (蓝色)+ 4H2O。①1个乙二胺分子中含sp3杂化的原子个数为 , 分子中电负性最大的元素是 ;
②Ni(H2O)6]2+中H2O与Ni2+之间以键结合在一起,在与乙二胺反应的过程中,Ni2+的轨道杂化类型是否发生改变? (填“是”或“否”) ;
③沸点:乙二胺(116℃)<乙二醇(197℃), 其原因是:。
(3)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,记为原子分数坐标。已知TiO2为四方晶系(长方体形),晶胞参数为459pm、459pm、 295pm。 如图为沿y轴投影的晶胞中所有O原子和Ti原子的分布图和原子分数坐标。①该晶胞中O原子的数目为。
②设NA为阿伏加德罗常数的值,TiO2 的摩尔质量为80g/mol,则TiO2晶胞的密度为g·cm-3(列出计算表达式)
