从巩固到提高 高考化学二轮微专题38 晶体结构
试卷更新日期:2023-02-11 类型:二轮复习
一、单选题
-
1. 砷化镉晶胞结构如图。图中“①”和“②”位是“真空”,晶胞参数为apm,建立如图的原子坐标系,①号位的坐标为( , , )。已知:砷化镉的摩尔质量为Mg/mol,NA为阿伏加德罗常数的值。下列说法错误的是( )
 A、砷化镉中Cd与As原子个数比为3:2 B、两个Cd原子间最短距离为0.5apm C、③号位原子坐标参数为( , 1,) D、该晶胞的密度为g·cm-3
A、砷化镉中Cd与As原子个数比为3:2 B、两个Cd原子间最短距离为0.5apm C、③号位原子坐标参数为( , 1,) D、该晶胞的密度为g·cm-3二、综合题
-
2. John B.Goodenough等三位科学家因在发展锂离子电池方面做出的贡献而获得了诺贝尔化学奖。回答下列问题:(1)、锰酸锂( LiMn2O4)电池具有原料成本低合成工艺简单等优点。原子中运动的电子有两种相反的身旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数。对于基态Li原子,其核外电子自旋磁量子数的代数和为。基态 Mn原子核外价层电子的运动状态有种。(2)、锂离子电池的电解液一般为溶有LiPF6的碳酸酯类有机溶剂,LiPF6遇水反应生成PF3和POF , PF中心原子的价层电子对数为 , POF3的空间构型为。 下列对PF5中心原子杂化方式的推断合理的是(填字母)。
A.sp2 B.sp3 C.sp3d D.sp3d2
(3)、三元正极材料LiCNjMnO2掺杂Al3+可使其性能更优,第三电离能:Fe(填“大于”或“小于”)Mn,原因是。(4)、链化锂被认为是很有潜力的正极材料,晶胞结构如图所示。
①晶施可以看作是由铋原子构成的面心立方晶格,锂原子填充在其中的四面体和八面体空隙处,晶体的化学式为。
②图中原子坐标参数:A为(0,0,0),B为(1,0.5,1),则C的坐标为 , Bi与Li(1)和Li(2)之间的最短距离的比值为。
3. Cu、Mn等金属单质及其化合物应用十分广泛。回答下列问题:(1)、基态Cu的价层电子排布式为。基态Mn原子核外未成对电子数为。(2)、Cu可以形成一种离子化合物 , 中氧原子的杂化类型为;配体中的配位原子是;配体中非金属元素的电负性由大到小的顺序为。(3)、硝酸锰是工业制备中常用的催化剂,的空间构型为;O的第一电离能小于N的第一电离能,原因为。(4)、锰的一种晶型结构为体心立方堆积(如图),晶胞参数为891.25pm。锰原子半径为pm;已知阿伏加德罗常数的值为 , 该晶体的密度为。(列出计算式) 4. 钾离子电池以其优异的性能成为替代锂离子电池的一种选择,该电池的负极是由钾嵌入石墨中构成,正极主要含、铝箔、醚类有机物等。从某废旧钾离子电池中回收部分材料的流程如下:
4. 钾离子电池以其优异的性能成为替代锂离子电池的一种选择,该电池的负极是由钾嵌入石墨中构成,正极主要含、铝箔、醚类有机物等。从某废旧钾离子电池中回收部分材料的流程如下:
已知:I.放电时负极的电极反应式为;
II.常温下, , 当溶液中某离子浓度低于时,认为该离子已沉淀完全。
回答下列问题:
(1)、废旧电池放电处理的原因为。(2)、“碱浸”时发生的化学反应方程式为。(3)、已知中的铁为+3价,则“酸溶”时主要反应的离子方程式为;该工序中温度需控制在40℃的原因为。(4)、若最终调节pH=3,则所得母液中的(填“已”或“未”)沉淀完全。(5)、实验室中从“反萃取”所得混合液中分离出溶液的操作名称为。(6)、废旧钾离子电池放电处理并拆解后,从负极得到石墨,其结构如图。石墨两层之间最近碳原子间距远大于层内最近碳原子间距的原因为;设阿伏加德罗常数的值为 , 则石墨晶体密度为(列式即可)。 5. Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用,请回答下列问题:(1)、Fe元素属于元素周期表的 区(填分区)(2)、基态Ni2+核外电子排布式为。(3)、鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M的结构如图甲所示。
5. Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用,请回答下列问题:(1)、Fe元素属于元素周期表的 区(填分区)(2)、基态Ni2+核外电子排布式为。(3)、鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M的结构如图甲所示。
①组成M的5中元素中,除H元素外,另外4种元素第一电离能由大到小的顺序为(填元素符号),其中C原子的杂化类型为。
②图中各微粒不存在的作用力有 ( 填标号)
a. 极性键 b.非极性键 c. 配位键
d. π键 e.离子键 f.氢键
(4)、一种铁氮化合物具有高磁导率,可用于制电子元件,其晶胞结构如图乙所示。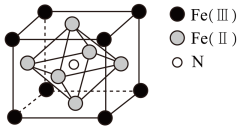
①铁氮化合物的化学式为。
②在该晶胞结构的另一种表示中,N处于顶点位置,则铁处于、位置
③若该化合物密度为pg·cm-3 , 用NA表示阿伏加德罗常数,则由Fe( II )构成的正八面体的体积为cm3
6. 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、钴、硼、镓、硒等。已知铜的配合物A结构如图。请回答下列问题: (1)、基态二价铜离子的核外电子排布式为 , 已知高温下Cu2O比CuO更稳定,试从核外电子排布角度解释。(2)、配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2 , N2中σ键和π键数目之比是。(3)、硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的原因是。(4)、立方氮化硼(结构如图)与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为。
(1)、基态二价铜离子的核外电子排布式为 , 已知高温下Cu2O比CuO更稳定,试从核外电子排布角度解释。(2)、配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2 , N2中σ键和π键数目之比是。(3)、硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的原因是。(4)、立方氮化硼(结构如图)与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为。 (5)、六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为。六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构、硬度与金刚石相似,其晶胞如图,晶胞边长为apm,立方氮化硼的密度是g·cm-3(只列算式,NA为阿伏加德罗常数的值)。
(5)、六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为。六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构、硬度与金刚石相似,其晶胞如图,晶胞边长为apm,立方氮化硼的密度是g·cm-3(只列算式,NA为阿伏加德罗常数的值)。 7. 回答下列问题:(1)、氨基酸锌是研究最早和使使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图是氨基酸锌的结构简式。
7. 回答下列问题:(1)、氨基酸锌是研究最早和使使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图是氨基酸锌的结构简式。
①组成氨基酸锌的C、N、O的第一电离能由大到小的顺序是。
②最简单的氨基酸是甘氨酸(结构简式如图),其结构中π键与σ键的数量比为。
 (2)、分于中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界。
(2)、分于中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界。
①配合物中每个中心离子的配位数为。
②Co2+的最高能层电子排布式为。
③下列状态的钴中,电离最外层一个电子所需能量最大的是(填标号)
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(3)、二氯甲醛的结构简式为 , 已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是。 (4)、碳酸亚乙酯(
, 已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是。 (4)、碳酸亚乙酯( )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因。 (5)、化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn , 如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+ , 即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱。(6)、氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。晶胞中距离最近的两个O2-之间的距离为apm,MnO晶体的密度为ρg·cm-3 , 则阿伏加德罗常数的值为(用含a和ρ的最简代数式表示)。
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因。 (5)、化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn , 如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+ , 即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱。(6)、氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。晶胞中距离最近的两个O2-之间的距离为apm,MnO晶体的密度为ρg·cm-3 , 则阿伏加德罗常数的值为(用含a和ρ的最简代数式表示)。 8. 铜是人类广泛使用的第一种金属,含铜物质在生产生活中有着广泛应用。回答下列问题:(1)、铜锰氧化物(CuMn2O4能在常温下催化氧化一氧化碳和甲醛(HCHO)。
8. 铜是人类广泛使用的第一种金属,含铜物质在生产生活中有着广泛应用。回答下列问题:(1)、铜锰氧化物(CuMn2O4能在常温下催化氧化一氧化碳和甲醛(HCHO)。①基态Cu原子的M层电子排布式为。
②CO和N2互为等电子体。标准状况下V L CO分子中π键数目为。
(2)、钙铜合金可用作电解法制备金属钙的阴极电极材料。钙在元素周期表中位于(填“s”、“p”、“d”或“ds")区。一种钙铜合金的结构如图(Ⅲ可看作是由Ⅰ、Ⅱ两种原子层交替堆积排列而形成的)。该钙铜合金中铜原子与钙原子的个数比为。 (3)、已知硫酸铜稀溶液呈蓝色,判断硫酸铜稀溶液中不存在的作用力有____(填英文字母)。A、配位键 B、金属键 C、离子键 D、氢键 E、范德华力(4)、已知Cu2O的熔点为1235℃,Cu2S的熔点为1130℃,Cu2O熔点较高的原因是。(5)、Cu2+可形成[Cu(X)2]2+ , 其中X代表CH3-HN-CH2-CH2-NH2。则1 mol [Cu(X)2]2+微粒中VSEPR模型为四面体的非金属原子共有mol。(6)、一种含有Fe、Cu、S三种元素的矿物的晶胞(如图所示),属于四方晶系(晶胞底面为正方形),则该化合物的化学式为;若晶胞的底面边长为a nm,晶体的密度为p g·cm-3 , 阿伏加德罗常数为NA , 则该晶胞的高为nm。
(3)、已知硫酸铜稀溶液呈蓝色,判断硫酸铜稀溶液中不存在的作用力有____(填英文字母)。A、配位键 B、金属键 C、离子键 D、氢键 E、范德华力(4)、已知Cu2O的熔点为1235℃,Cu2S的熔点为1130℃,Cu2O熔点较高的原因是。(5)、Cu2+可形成[Cu(X)2]2+ , 其中X代表CH3-HN-CH2-CH2-NH2。则1 mol [Cu(X)2]2+微粒中VSEPR模型为四面体的非金属原子共有mol。(6)、一种含有Fe、Cu、S三种元素的矿物的晶胞(如图所示),属于四方晶系(晶胞底面为正方形),则该化合物的化学式为;若晶胞的底面边长为a nm,晶体的密度为p g·cm-3 , 阿伏加德罗常数为NA , 则该晶胞的高为nm。 9. 研究发现,过量摄入铝元素能损害人的脑细胞。适当地补充碘元素可预防甲状腺肿大,但摄入过多也会导致甲状腺病变。试回答下列问题:(1)、Fe也是人体需要补充的元素之一,写出Fe3+的核外电子排布式:。(2)、与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能由大到小的顺序是。(3)、氯化铝的熔点是194℃,氧化铝的熔点是2054℃,但是工业上获取铝单质不是电解熔融氯化铝,而是电解熔融氧化铝,原因是;为降低熔点和增强导电性,电解熔融氧化铝时通常要加入Na3AlF6(冰晶石),Na3AlF6中含有的化学键类型有(填字母)。
9. 研究发现,过量摄入铝元素能损害人的脑细胞。适当地补充碘元素可预防甲状腺肿大,但摄入过多也会导致甲状腺病变。试回答下列问题:(1)、Fe也是人体需要补充的元素之一,写出Fe3+的核外电子排布式:。(2)、与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能由大到小的顺序是。(3)、氯化铝的熔点是194℃,氧化铝的熔点是2054℃,但是工业上获取铝单质不是电解熔融氯化铝,而是电解熔融氧化铝,原因是;为降低熔点和增强导电性,电解熔融氧化铝时通常要加入Na3AlF6(冰晶石),Na3AlF6中含有的化学键类型有(填字母)。A.离子键 B.金属键 C.氢键 D.配位键
(4)、F与I是同一主族的元素,BF3与H3O+都是由四个原子构成的粒子,两种粒子的中心原子B和O的杂化方式分别为、 , BF3的空间构型是 , H3O+的空间构型是。(5)、I2晶体的晶胞结构如图所示,该晶胞中含有I原子的数目为 , 已知该晶胞的晶胞参数为apm、bpm和cpm,则I2晶体的密度是g/cm3。(列出最简表达式,用NA表示阿伏加德罗常数的值) 10. 过渡金属及其化合物在生产生活中有着广泛应用。回答下列问题:(1)、过渡元素Co基态原子的核外电子排布式为;第四电离能 , 其原因是。(2)、Fe、Fe2+、Fe3+可以与CO、、、(尿素)等多种配体形成很多的配合物。
10. 过渡金属及其化合物在生产生活中有着广泛应用。回答下列问题:(1)、过渡元素Co基态原子的核外电子排布式为;第四电离能 , 其原因是。(2)、Fe、Fe2+、Fe3+可以与CO、、、(尿素)等多种配体形成很多的配合物。①配合物的熔点为-20℃,沸点为103℃,可用于制备纯铁。的结构如图所示。下列关于说法错误的是(填序号)。

A.是分子晶体
B.中Fe原子的配体与互为等电子体
C.中σ键与π键之比为1∶1
D.反应中没有新化学键生成
②的电子式为。
③(尿素)中N原子的杂化方式为 , 组成尿素的4种元素的第一电离能由大到小的顺序为。
(3)、Ni和As形成某种晶体的晶胞图如图所示。其中,大球为Ni,小球为As,距离As最近的Ni构成正三支柱,其中晶胞下方As原子坐标为( , , )。
①Ni的配位数为。
②已知晶胞底面边长为apm,高为cpm,NA为阿伏加德罗常数。则晶胞密度为。
11. 我国科学家研究发现AgGrS2在室温下具有超离子行为(原子可在晶体中自由移动)。回答下列问题:(1)、基态铬原子的核外电子排布式为 , 基态硫原子核外有种不同运动状态的电子。(2)、与硫元素同族的几种元素中,电负性最大的是 ( 填元素符号)。常见含硫的微粒有SO2、SO3、、、 H2S等,的空间构型为 ; 请写出与H2S互为等电子体的一种微粒的化学式 ;SO2、SO3杂化轨道类型相同,但键角SO3大于SO2 , 原因是。(3)、Ag+与氨水形成的二氨合银配离子[Ag(NH3)2]+的空间构型是直线型,则其中心原子的杂化类型是 , 该配离子中的配位原子是(填元素符号),1mol该配离子中含有的σ键的数目为。(4)、复合材料氧铬酸钙的立方晶胞如图所示。
已知A、B的原子分数坐标分别为(0,0,0)、(1,1,0),则C的原子分数坐标为 , 该物质的化学式为 , 已 知钙和氧的最近距离为a pm。晶体的密度ρ g·cm-3 , 则阿伏加德罗常数NA= mol-1( 用含a和ρ的式子表示,列出计算式即可)。
12. [选修3:物质结构与性质]东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:(1)、镍元素基态原子的电子排布式为3d能级上的未成对电子数为。(2)、硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。氨的沸点(填“高于”或“低于”)膦(PH3),原因是
氨是分子(填“极性”或“非极性”),中心原子的轨道杂化类型为。
(3)、单质铜及镍都是由键形成的晶体;元素铜与镍的第二电离能分别为ICu=1 958 kJ·mol–1、INi=1 753 kJ·mol-1 , ICu>INi的原因是。(4)、某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为。
13. 回答下列问题(1)、锌的四种卤化物晶体的熔点数据如下表:物质
熔点/℃
827
275
394
446
与熔点相差较大,、、熔点依次增大,原因是。
(2)、已知顺、反丁烯二酸的相关数据如下表:物质
电离平衡常数
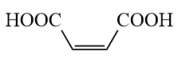

从结构角度分析顺丁烯二酸的小于反丁烯二酸的的原因是。
14. 黄金是一种非常重要的金属。不仅是用于储备和投资的特殊通货,同时又是首饰业、电子业、现代通讯。航天航空业等部门的重要材料。(1)、金能溶解于王水中: , 请分析中的配体是 , 配位数是。(2)、开采的金矿可用氰化法提取:先以氰化钠(NaCN)溶液处理粉碎的金矿石得到 , 再用锌还原:。Zn与形成的配离子为正四面体形,Au(+1价)与形成的配离子为直线形。①中配合离子中σ键和π键个数之比是 , 配体杂化方式是。
②写出Zn的电子排布式 , C、N、Na的第一电离能由大到小顺序为。
(3)、是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态还是气态,它都是以二聚体的形式存在。依据以上信息判断晶体的结构属于晶体,写出的结构式。(4)、①Au单质的晶体为面心立方最密堆积,Au的配位数为。以下金属和金具有相同的堆积模型的是。a.Po b.Na c.Zn d.Cu
②若Au的原子半径为a nm,Au单质的摩尔质量为M g/mol,阿伏加德罗常数为NA , 求Au单质的密度为。(用含a、NA、M的代数式表示)
15. 硼单质及其化合物在科技前沿有广泛的应用,如用作高能火箭燃料,制作半导体材料等,回答下列问题:(1)、硼与氧的亲和力超过硅,常作炼钢工业去氧剂。硼原子的核外电子排布式为 , 晶体硼的晶体类型为 , 晶体硼的熔点比晶体硅 (选填“高”或“低”),原因是。(2)、乙硼烷B2H6常用于制作半导体材料。乙硼烷分子内通过“桥氢原子”形成两个特殊共价键 ;使B原子最外层达到稳定结构(如图一)。则B2H6中B原子的杂化方式为。
;使B原子最外层达到稳定结构(如图一)。则B2H6中B原子的杂化方式为。
 (3)、多聚硼酸盐常用于制作光学玻璃。某多聚硼酸根具有无限网状结构,其结构单元如图二所示,若其结构单元表示为(B5On)m- , 则m= , n= ;结构单元中电负性较强的元素为 。
(3)、多聚硼酸盐常用于制作光学玻璃。某多聚硼酸根具有无限网状结构,其结构单元如图二所示,若其结构单元表示为(B5On)m- , 则m= , n= ;结构单元中电负性较强的元素为 。 (4)、氮化硼(BN)是一种重要的功能陶瓷材料。可通过下列反应得到: B2O3+22BN+3H2O
(4)、氮化硼(BN)是一种重要的功能陶瓷材料。可通过下列反应得到: B2O3+22BN+3H2O①横线上物质的空间构型为 。
②六方氮化硼晶体结构与石墨相似(如图三),N- B键键长为apm,晶体的层间距为bpm,则六方氮化硼晶体的密度为 g·cm-3(列出计算式,用NA表示阿伏加德罗常数的值)。
 16. 材料是人类进步的基石,深入认识物质的结构有助于进一步开发新的材料。回答下列问题:(1)、按照杂化轨道理论,基态B原子的价电子先激发,再杂化成键形成BCl3。杂化前,处于激发态的B原子的价电子轨道表示式为____ ( 选填标号)。A、
16. 材料是人类进步的基石,深入认识物质的结构有助于进一步开发新的材料。回答下列问题:(1)、按照杂化轨道理论,基态B原子的价电子先激发,再杂化成键形成BCl3。杂化前,处于激发态的B原子的价电子轨道表示式为____ ( 选填标号)。A、 B、
B、 C、
C、 D、
D、 (2)、已知:第四周期中3d轨道上没有未成对电子的过渡元素离子的水合离子为无色。下列离子形成的水合离子为无色的是____。A、Sc3+ B、Cr3+ C、Fe3+ D、Zn2+(3)、K3[Fe(CN)6]中所含元素电负性由大到小的顺序为 , 1mol K3[Fe(CN)6]含有 molσ键;Ti3+能形成化合物[TiCl(H2O)5]Cl2·H2O,该化合物中Ti3+的配位数为。(4)、Ni(CO)4常温下呈液态,其分子空间构型为正四面体。解释其易溶于CCl4、苯等有机溶剂的原因:。(5)、纯水电离产生H3O+、OH- , 研究发现在某些水溶液中还存在、等微粒。
(2)、已知:第四周期中3d轨道上没有未成对电子的过渡元素离子的水合离子为无色。下列离子形成的水合离子为无色的是____。A、Sc3+ B、Cr3+ C、Fe3+ D、Zn2+(3)、K3[Fe(CN)6]中所含元素电负性由大到小的顺序为 , 1mol K3[Fe(CN)6]含有 molσ键;Ti3+能形成化合物[TiCl(H2O)5]Cl2·H2O,该化合物中Ti3+的配位数为。(4)、Ni(CO)4常温下呈液态,其分子空间构型为正四面体。解释其易溶于CCl4、苯等有机溶剂的原因:。(5)、纯水电离产生H3O+、OH- , 研究发现在某些水溶液中还存在、等微粒。①H2O分子的键角小于H3O+离子的键角,原因是。
②画出可能的一种结构式。
(6)、TiO2通过氮掺杂反应生成TiO2-xNy , 表示如图。
①立方晶系TiO2晶胞参数如图甲所示,若用NA表示阿伏加德罗常数,其晶体的密度为g/cm3。
②图乙的结构可用化学式TiO2-xNy表示,其中x=。
17. 铁在史前就为人们所知,铁及其化合物推动了人类文明的发展。回答下列问题:(1)、Fe元素位于元素周期表的区,基态Fe2+的核外电子排布式为。(2)、复盐NH4Fe(SO4)2·12H2O俗称铁铵矾,可用于鞣革。铁铵矾中,所含N、O、S三种非金属元素第一电离能由小到大的顺序是 , 阴离子的空间构型为。的键角比NH3的键角(填“大”或“小”)。(3)、三价铁的强酸盐溶于水后经水解可以生成如图所示的二聚体,其中Fe3+的配位数为 , 过渡元素的s、p、d轨道可以参与杂化,含s、p、d轨道的杂化类型有:①dsp2、 ②sp3d、③sp3d2 , 该二聚体中Fe采取的杂化类型为(填标号)。 (4)、三种化合物的熔点如下表所示:
(4)、三种化合物的熔点如下表所示:化合物
FeCl3
NaCl
MgO
熔点/℃
308
801
2852
试解释其熔点差异的原因:。
(5)、铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某立方FexNy的晶胞如图所示,晶胞参数为apm,该晶体密度为g·cm-3 (设NA为阿伏加德罗常数的值,写出表达式),Cu完全替代该晶体中b位置Fe,形成Cu替代型产物Fe(x-n)CunNy , n:y=。 18. 回答下列问题:(1)、两种无机物的相关信息如表:
18. 回答下列问题:(1)、两种无机物的相关信息如表:化学式
P4S3
C3N4
用途
制造火柴及火柴盒摩擦面
可用作切磨机、钻头、轴承
熔点
174℃
1900℃
请从结构和微观作用力的角度解释两种物质的熔点差异。
(2)、将温度传感器探头伸入装有甘油(丙三醇)的试管中,片刻后再取出置于潮湿空气中,探头的温度变化如图。请解释温度升高的原因。 19. 按要求回答问题(1)、乙醇的沸点远高于环氧乙烷的沸点,原因是。(2)、一些氧化物的熔点如表所示:
19. 按要求回答问题(1)、乙醇的沸点远高于环氧乙烷的沸点,原因是。(2)、一些氧化物的熔点如表所示:氧化物
熔点/℃
1570
1132
23.8
-75.5
解释表中氧化物之间熔点差异的原因。
20.(1)、Ⅰ.元素Fe、C、卤素元素等形成的材料在工业、生活、国防中有很大的作用。请回答下列问题:基态Fe原子核外电子的空间运动状态有种,实验室常用邻二氮菲(
 )检验Fe2+ , 生成橙红色的邻二氮菲亚铁络离子,邻二氮菲中N原子参与杂化的原子轨道为。(2)、Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
)检验Fe2+ , 生成橙红色的邻二氮菲亚铁络离子,邻二氮菲中N原子参与杂化的原子轨道为。(2)、Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。拟卤素( CN)2、( SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。(SCN)2对应的酸有两种,测得硫氰酸(H- S- C≡N )的沸点低于异硫氰酸(H -N=C=S),其原因是。
(3)、卤化物RbICl2在加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为 ;属于多卤素阳离子,其空间构型为。(4)、碳的一种同素异形体---石墨,其晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为个。已知石墨的密度为ρg· cm-3 , C-C键键长为r cm ,阿伏加德罗常数的值为NA , 计算石墨晶体的层间距d为cm。 21. 我国中科院天津工业技术研究所,首次实现人工通过二氧化碳合成淀粉。请回答下列问题:(1)、基态碳原子的核外电子排布图为。(2)、原子中运动的电子有2种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋量子数。对于基态碳原子,其价电子自旋量子数的代数和为。(3)、结合如表所示键能数据,分析CO和N2相对活泼性并说明原因:。
21. 我国中科院天津工业技术研究所,首次实现人工通过二氧化碳合成淀粉。请回答下列问题:(1)、基态碳原子的核外电子排布图为。(2)、原子中运动的电子有2种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋量子数。对于基态碳原子,其价电子自旋量子数的代数和为。(3)、结合如表所示键能数据,分析CO和N2相对活泼性并说明原因:。CO
C-O
C=O
C
 O
O键能/kJ·mol-1
357.7
798.9
1071.9
N2
N-N
N=N
N≡N
键能/kJ·mol-1
154.8
418.4
941.7
(4)、CO2分子的空间构型为 , 与CO2互为等电子体,写出的结构式。(5)、一种新型Na-Fe3O4/HZSM-5多功能复合催化剂成功实现了CO2直接加氢制取高辛烷值汽油。该催化剂成分Fe3O4的晶胞如图所示。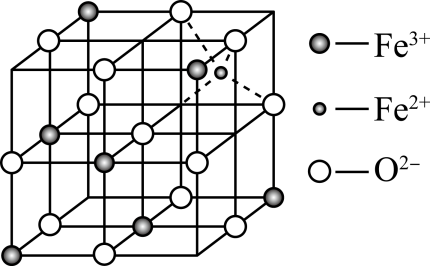
①晶胞中Fe3+处于O2-围成的空隙(填“正四面体”“正八面体”或“正十六面体”)。
②若晶胞体对角线为anm,阿伏加德罗常数为NA , 晶体的密度为g·cm-3(写出表达式)。
22. KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:(1)、在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是(填离子符号)。(2)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为。(3)、已知有关氨、磷的单键和三键的键能(kJ•mol-1)如表:N—N
N≡N
P—P
P≡P
193
946
197
489
从能量角度看,氮以N2、而白磷以P4(结构式可表示为
 )形式存在的原因是。(4)、已知KH2PO2是次磷酸的正盐,H3PO2的结构式为 , 其中P采取杂化方式。(5)、与PO电子总数相同的等电子体的分子式为。(6)、磷酸通过分子间脱水缩合形成多磷酸,如:
)形式存在的原因是。(4)、已知KH2PO2是次磷酸的正盐,H3PO2的结构式为 , 其中P采取杂化方式。(5)、与PO电子总数相同的等电子体的分子式为。(6)、磷酸通过分子间脱水缩合形成多磷酸,如:
如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。
(7)、分别用○、●表示H2PO和K+ , KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO、K+在晶胞xz面、yz面上的位置:
①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA , 晶体的密度g•cm-3(写出表达式)。
②晶胞在x轴方向的投影图为 (填标号)。
 23. 超导材料和超导技术是2世纪最伟大的发现之一,有着广阔的应用前景。我国科学家发现了一种新型的超导体材料 , 由和交替堆叠构成。其中A层是由无限四方平面层构成,S原子位于八面体上下顶点上(如图a),其俯视图如图b。
23. 超导材料和超导技术是2世纪最伟大的发现之一,有着广阔的应用前景。我国科学家发现了一种新型的超导体材料 , 由和交替堆叠构成。其中A层是由无限四方平面层构成,S原子位于八面体上下顶点上(如图a),其俯视图如图b。 (1)、画出基态S的价电子排布图。(2)、写出A层离子的化学式。A层各元素的第一电离能由大到小的顺序为。(3)、“依布硒”(
(1)、画出基态S的价电子排布图。(2)、写出A层离子的化学式。A层各元素的第一电离能由大到小的顺序为。(3)、“依布硒”( )具有良好的抗炎活性。下列说法正确的是。
)具有良好的抗炎活性。下列说法正确的是。a.Se采用sp3的方式杂化
b.分子中各个C原子的杂化方式不同
c.分子中既含有极性共价键,又含有非极性共价键
d.分子中和的键角相同
(4)、H2O和H2S都是分子晶体,熔沸点较高的是 , 原因是。(5)、83Bi是第周期VA族元素,是一种极少数不溶性的钠盐,其阴离子的立体构型为。(6)、汞钡铜氧晶体通过掺杂Ca2+可以获得具有更高临界温度的超导材料,如图c所示。其密度为(列式表示、设NA为阿伏加德罗常数的值)。 24. 铜及其化合物在能源、信息等领域应用广泛。回答下列问题:(1)、铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10 , 失去1个电子需要的能量由大到小排序是____(填字母)。A、④②①③ B、④②③① C、①②④③ D、①④③②(2)、铜的熔点比同周期钾的熔点高,这是由于。(3)、用超临界CO2/CH3CN及水作电解质,使用碳作载体的铜基催化剂可高效将CO2还原为HCOOH。CO2的空间结构为 , CH3CN 中C原子的杂化方式为 。(4)、[Cu(NH3)4]2+是Cu2+常见的配离子,1 mol [Cu(NH3)4]2+中所含σ键数目为 ;[Cu(NH3)4]2+中H-N-H的键角比NH3中H- N- H的键角(填“大”“小”或“无法判断”),原因是。(5)、一种热电材料的晶胞结构如图所示,底部边长为apm的正方形,高为cpm,该晶体的化学式为 , 紧邻的 Sb与Cu间的距离为pm,设NA为阿伏加德罗常数的值,晶体的密度为g· cm-3(列出计算表达式)。
24. 铜及其化合物在能源、信息等领域应用广泛。回答下列问题:(1)、铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10 , 失去1个电子需要的能量由大到小排序是____(填字母)。A、④②①③ B、④②③① C、①②④③ D、①④③②(2)、铜的熔点比同周期钾的熔点高,这是由于。(3)、用超临界CO2/CH3CN及水作电解质,使用碳作载体的铜基催化剂可高效将CO2还原为HCOOH。CO2的空间结构为 , CH3CN 中C原子的杂化方式为 。(4)、[Cu(NH3)4]2+是Cu2+常见的配离子,1 mol [Cu(NH3)4]2+中所含σ键数目为 ;[Cu(NH3)4]2+中H-N-H的键角比NH3中H- N- H的键角(填“大”“小”或“无法判断”),原因是。(5)、一种热电材料的晶胞结构如图所示,底部边长为apm的正方形,高为cpm,该晶体的化学式为 , 紧邻的 Sb与Cu间的距离为pm,设NA为阿伏加德罗常数的值,晶体的密度为g· cm-3(列出计算表达式)。 25. 碳族元素在生产生活中的应用极其广泛,请回答以下有关碳族元素的问题。(1)、Si位于周期表的区, 基态Si原子含有个未成对电子,其核外电子有种空间运动状态。(2)、甲醇重整制氢反应中,铜基催化剂(CuO/SiO2)具有重整温度低、催化选择性高等优点。Cu、Si、O三种元素的电负性由大到小的顺序是。(3)、锡(Sn)是人类最早使用的元素之一,化合物SnCl4常温下为无色液体,它的晶体类型是 , 属于(填“极性分子”或“非极性分子”),与SnCl4互为等电子体的阴离子(写一种)。(4)、C16S8是新型环烯类储氢材料,研究证明其分子呈平面结构(如图1所示)。
25. 碳族元素在生产生活中的应用极其广泛,请回答以下有关碳族元素的问题。(1)、Si位于周期表的区, 基态Si原子含有个未成对电子,其核外电子有种空间运动状态。(2)、甲醇重整制氢反应中,铜基催化剂(CuO/SiO2)具有重整温度低、催化选择性高等优点。Cu、Si、O三种元素的电负性由大到小的顺序是。(3)、锡(Sn)是人类最早使用的元素之一,化合物SnCl4常温下为无色液体,它的晶体类型是 , 属于(填“极性分子”或“非极性分子”),与SnCl4互为等电子体的阴离子(写一种)。(4)、C16S8是新型环烯类储氢材料,研究证明其分子呈平面结构(如图1所示)。
图1
①C16S8分子中C原子和S原子的杂化轨道类型分别为、。
②测得C16S8中碳硫键的键长介于C-S键和C=S键之间,其原因可能是。
(5)、锗(Ge)是典型的半导体材料,在电子、材料等领域应用广泛。锗单晶的晶胞结构如图2所示,其晶胞参数为apm,阿伏加德罗常数的值为NA , 则晶体密度为g·cm-3(列出计算式即可)。 26. 氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi),在性质上表现出从典型的非金属元素到典型的金属元素的一个完整的过渡。(1)、下列氮原子的能量最低的是____。A、
26. 氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi),在性质上表现出从典型的非金属元素到典型的金属元素的一个完整的过渡。(1)、下列氮原子的能量最低的是____。A、 B、
B、 C、
C、 D、
D、 (2)、①氮族元素简单氢化物的键角NH3>PH3>AsH3 , 其原因是。
(2)、①氮族元素简单氢化物的键角NH3>PH3>AsH3 , 其原因是。②南开大学某课题组成功合成了无机二茂铁类似物[Fe(η4- P4)2]2-。环状是芳香性π配体,P的杂化方式是 ,中的大π键应表示为(分子中的大π键可用符号表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数)
 (3)、雌黄的分子式为As2S3 , 1个As2S3分子中孤电子对数目为。(4)、天津理工大学科研团队制备出一种智能离子交换剂,由平行堆积的一维链阴离子(部分结构如下图)和K+阳离子组成,含有n个最简单元的阴离子可表示为。
(3)、雌黄的分子式为As2S3 , 1个As2S3分子中孤电子对数目为。(4)、天津理工大学科研团队制备出一种智能离子交换剂,由平行堆积的一维链阴离子(部分结构如下图)和K+阳离子组成,含有n个最简单元的阴离子可表示为。 (5)、①基态铋原子的价电子排布式为。
(5)、①基态铋原子的价电子排布式为。②铋的一种氧化物的立方晶胞结构如图所示,已知最近的两个铋离子之间的距离为a pm,阿伏加德罗常数为NA , 则该晶体的密度为g·cm-3(列出计算式即可)。
 27. ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。回答下列问题:(1)、基态O原子电子占据最高能级的电子云轮廓图为形。(2)、S单质的常见形式为 , 其环状结构如图所示,S原子的杂化轨道类型是。
27. ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。回答下列问题:(1)、基态O原子电子占据最高能级的电子云轮廓图为形。(2)、S单质的常见形式为 , 其环状结构如图所示,S原子的杂化轨道类型是。 (3)、基态Se原子的核外电子排布式为。(4)、S、Se、Te三种元素电负性由大到小的顺序是 , 三种元素氢化物水溶液的酸性最强的是(填化学式)。(5)、分子中共价键的类型是 , 常温下是气体而是液体的原因是。(6)、ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有个。晶胞棱长为a pm,密度为(NA表示阿伏加德罗常数的值)。
(3)、基态Se原子的核外电子排布式为。(4)、S、Se、Te三种元素电负性由大到小的顺序是 , 三种元素氢化物水溶液的酸性最强的是(填化学式)。(5)、分子中共价键的类型是 , 常温下是气体而是液体的原因是。(6)、ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有个。晶胞棱长为a pm,密度为(NA表示阿伏加德罗常数的值)。
-