从巩固到提高 高考化学二轮微专题34 元素周期表
试卷更新日期:2023-02-11 类型:二轮复习
一、单选题
-
1. 化合物R(结构式如图所示)具有强大的氧化能力,可有效改善水质。已知X、Y、Z、W是原子序数依次增大的前20号主族元素,X与W、Y与Z分别同主族,Z、W对应的简单离子核外电子排布相同。下列说法正确的是( )
 A、X与Y只能形成一种化合物 B、化合物R中Y的化合价有2种 C、W可与反应生成Y的单质 D、Y和Z形成的化合物的水溶液呈碱性2. 已知X、Y、Z、W、M为原子序数依次递增的短周期元素,其中X、Y、Z元素同周期, Y与W元素同主族,它们可以形成一种重要化合物甲。其结构如图所示。下列说法正确的是( )
A、X与Y只能形成一种化合物 B、化合物R中Y的化合价有2种 C、W可与反应生成Y的单质 D、Y和Z形成的化合物的水溶液呈碱性2. 已知X、Y、Z、W、M为原子序数依次递增的短周期元素,其中X、Y、Z元素同周期, Y与W元素同主族,它们可以形成一种重要化合物甲。其结构如图所示。下列说法正确的是( ) A、原子半径:M>W>Z B、第一电离能:Y>Z>X C、氢化物的沸点:Z>Y>X D、甲中W的杂化方式为sp23. W、X、Y、Z为原子序数依次增大的短周期主族元素,Y的原子序数等于W与X的原子序数之和,Z是地壳中含量最丰富的金属元素,W与X可形成原子个数比2∶1的分子,下列说法正确的是( )A、X与Z能形成耐高温的无机材料 B、简单离子半径Z>X>Y C、由W、X、Y三种元素所组成的化合物的水溶液均显酸性 D、非金属性:X>Y>W4. 短周期主族非金属元素X、Y、Z、M的原子序数依次增大,其中Y与Z同族,Z原子最外层电子数等于X原子的核外电子总数,X与M、Y与Z的核电荷数之和均为22。下列说法正确的是( )A、将少量Na2CO3固体加入到X的最高价含氧酸的水溶液中,有气泡产生 B、X、Z分别与M形成的二元化合物中,各原子均满足8e-稳定结构 C、常温下,单质M能够从Y的简单氢化物中置换出单质Y D、X与Y形成的二元化合物为分子晶体,熔沸点低5. 下列我国科研成果所涉及的物质转化中,物质所含元素位于0族的是( )A、由二氧化碳制取汽油:
A、原子半径:M>W>Z B、第一电离能:Y>Z>X C、氢化物的沸点:Z>Y>X D、甲中W的杂化方式为sp23. W、X、Y、Z为原子序数依次增大的短周期主族元素,Y的原子序数等于W与X的原子序数之和,Z是地壳中含量最丰富的金属元素,W与X可形成原子个数比2∶1的分子,下列说法正确的是( )A、X与Z能形成耐高温的无机材料 B、简单离子半径Z>X>Y C、由W、X、Y三种元素所组成的化合物的水溶液均显酸性 D、非金属性:X>Y>W4. 短周期主族非金属元素X、Y、Z、M的原子序数依次增大,其中Y与Z同族,Z原子最外层电子数等于X原子的核外电子总数,X与M、Y与Z的核电荷数之和均为22。下列说法正确的是( )A、将少量Na2CO3固体加入到X的最高价含氧酸的水溶液中,有气泡产生 B、X、Z分别与M形成的二元化合物中,各原子均满足8e-稳定结构 C、常温下,单质M能够从Y的简单氢化物中置换出单质Y D、X与Y形成的二元化合物为分子晶体,熔沸点低5. 下列我国科研成果所涉及的物质转化中,物质所含元素位于0族的是( )A、由二氧化碳制取汽油: 等
B、液氦到超流氦的转变:液氦(-269℃)→超流氦(-271℃)
C、煤炭的清洁化利用:煤炭→
D、利用太阳能合成燃料:
6. 下图为某物质的结构。已知:W、Y、Z属于不同周期、不同主族的短周期元素,W、Y、Z原子最外层电子数之和等于X原子最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述错误的是( )
等
B、液氦到超流氦的转变:液氦(-269℃)→超流氦(-271℃)
C、煤炭的清洁化利用:煤炭→
D、利用太阳能合成燃料:
6. 下图为某物质的结构。已知:W、Y、Z属于不同周期、不同主族的短周期元素,W、Y、Z原子最外层电子数之和等于X原子最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述错误的是( )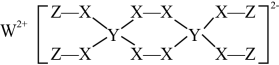 A、Y元素在周期表中的位置为第二周期IVA族 B、W、X对应的简单离子半径:X>W C、该物质具有强氧化性,可以用作漂白剂 D、该物质中,Y、X原子的最外层均满足8电子结构7. a、b、c、d、e为原子序数依次增大的短周期主族元素。X、Y、Z、W为这些元素形成的常见化合物,X为二元化合物,常温下0.1mol/L X溶液的pH=1。物质之间的转化关系如图所示。
A、Y元素在周期表中的位置为第二周期IVA族 B、W、X对应的简单离子半径:X>W C、该物质具有强氧化性,可以用作漂白剂 D、该物质中,Y、X原子的最外层均满足8电子结构7. a、b、c、d、e为原子序数依次增大的短周期主族元素。X、Y、Z、W为这些元素形成的常见化合物,X为二元化合物,常温下0.1mol/L X溶液的pH=1。物质之间的转化关系如图所示。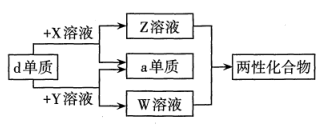
下列说法正确的是( )
A、简单离子半径:e>d> b B、b、c形成的化合物中都不含共价键 C、Z、W都能破坏水的电离平衡 D、b的氢化物稳定性一定强于e的氢化物8. 短周期主族元素W、X、Y、Z的原子序数依次增大,它们形成的一种化合物的结构如图所示。已知W和X的原子序数之和与Y的最外层电子数相等。下列说法错误的是( ) A、简单离子半径:Y>Z B、该化合物中X的杂化方式相同 C、第一电离能:Y>X D、化合物ZYW中既含离子键,又含极性共价键9. 一种新型漂白剂(如图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( )
A、简单离子半径:Y>Z B、该化合物中X的杂化方式相同 C、第一电离能:Y>X D、化合物ZYW中既含离子键,又含极性共价键9. 一种新型漂白剂(如图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( ) A、W单质在空气中点燃发出耀眼的白光 B、W、X对应的简单离子半径W>X C、Y的单质高温下可与水反应放出氢气,体现Y的氧化性 D、该漂白剂的漂白原理与相同10. X、Y、Z、M、W是五种短周期主族元素,其原子半径与原子序数的关系如图甲所示,X、Y、Z、M形成的化合物如图乙所示,Z与W同主族。下列说法错误的是( )
A、W单质在空气中点燃发出耀眼的白光 B、W、X对应的简单离子半径W>X C、Y的单质高温下可与水反应放出氢气,体现Y的氧化性 D、该漂白剂的漂白原理与相同10. X、Y、Z、M、W是五种短周期主族元素,其原子半径与原子序数的关系如图甲所示,X、Y、Z、M形成的化合物如图乙所示,Z与W同主族。下列说法错误的是( )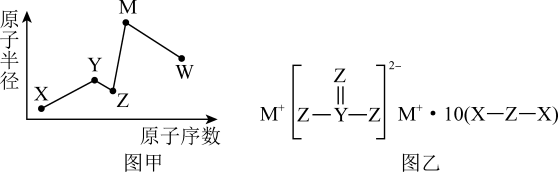 A、简单氢化物的熔沸点:Z>W B、简单离子的半径:W>Z>M C、X2Z2和M2Z2中的化学键类型完全相同 D、最高价氧化物对应水化物的酸性:W>Y11. W、X、Z、Y为原子序数依次增大的短周期主族元素,Z与X最外层电子数之和是Y的最外层电子数的两倍,W与X可形成原子个数比为3:1的18e-分子。下列说法正确的是( )A、简单离子半径:Z>Y>W B、氢化物沸点:Z>X C、X与Z形成的化合物均可以用排空气法收集 D、Y的某种氧化物的水化物可形成二元酸12. 下列有关Na、Mg、Al的叙述正确的是( )A、元素均位于周期表s区 B、均可用电解法冶炼制得单质 C、原子均有一个未成对电子 D、还原性由弱到强:13. X、Y、Z为前10号原子序数递增的同周期紧邻元素,基态Z原子的第一电离能的大小在本周期元素中排第二位。下列说法错误的是( )A、电负性:X>Y>Z B、基态原子未成对电子数:X>Y>Z C、原子半径:X>Y>Z D、简单气态氢化物稳定性:Z>Y>X14. 下列叙述正确的是( )A、和互称为同素异形体 B、元素周期表中位于金属与非金属分界线附近的元素属于过渡元素 C、合成氨工业中采用循环操作,主要是为了提高氮气和氢气的利用率 D、聚乳酸(
A、简单氢化物的熔沸点:Z>W B、简单离子的半径:W>Z>M C、X2Z2和M2Z2中的化学键类型完全相同 D、最高价氧化物对应水化物的酸性:W>Y11. W、X、Z、Y为原子序数依次增大的短周期主族元素,Z与X最外层电子数之和是Y的最外层电子数的两倍,W与X可形成原子个数比为3:1的18e-分子。下列说法正确的是( )A、简单离子半径:Z>Y>W B、氢化物沸点:Z>X C、X与Z形成的化合物均可以用排空气法收集 D、Y的某种氧化物的水化物可形成二元酸12. 下列有关Na、Mg、Al的叙述正确的是( )A、元素均位于周期表s区 B、均可用电解法冶炼制得单质 C、原子均有一个未成对电子 D、还原性由弱到强:13. X、Y、Z为前10号原子序数递增的同周期紧邻元素,基态Z原子的第一电离能的大小在本周期元素中排第二位。下列说法错误的是( )A、电负性:X>Y>Z B、基态原子未成对电子数:X>Y>Z C、原子半径:X>Y>Z D、简单气态氢化物稳定性:Z>Y>X14. 下列叙述正确的是( )A、和互称为同素异形体 B、元素周期表中位于金属与非金属分界线附近的元素属于过渡元素 C、合成氨工业中采用循环操作,主要是为了提高氮气和氢气的利用率 D、聚乳酸( )降解的产物为丙酸
15. 一种新型漂白剂由短周期元素W、X、Y、Z组成,其结构如图所示,其中W、Y、Z三种元素分别位于不同的短周期且不同主族,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子层结构相同。下列叙述错误的是( )
)降解的产物为丙酸
15. 一种新型漂白剂由短周期元素W、X、Y、Z组成,其结构如图所示,其中W、Y、Z三种元素分别位于不同的短周期且不同主族,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子层结构相同。下列叙述错误的是( ) A、元素的非金属性X>Y B、该漂白剂的漂白原理与漂白粉相似 C、工业上通常采用电解W的氯化物的水溶液制备单质W D、该漂白剂中X、Y原子最外层均满足8电子稳定结构16. 一种用于合成治疗免疫疾病药的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述错误的是( )
A、元素的非金属性X>Y B、该漂白剂的漂白原理与漂白粉相似 C、工业上通常采用电解W的氯化物的水溶液制备单质W D、该漂白剂中X、Y原子最外层均满足8电子稳定结构16. 一种用于合成治疗免疫疾病药的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述错误的是( ) A、Y的氢化物的熔点一定低于 Z的氢化物的熔点 B、Z元素能形成多种氢化物 C、WZX与WXQ化学键类型相同 D、W2Q2Z3溶液与Q的最高价氧化物对应水化物的稀溶液反应有黄色浑浊和无色气体产生
A、Y的氢化物的熔点一定低于 Z的氢化物的熔点 B、Z元素能形成多种氢化物 C、WZX与WXQ化学键类型相同 D、W2Q2Z3溶液与Q的最高价氧化物对应水化物的稀溶液反应有黄色浑浊和无色气体产生二、综合题
-
17. 胆矾化学式为CuSO4·5H2O。实验证明CuSO4·5H2O中有4个水分子为配位水分子,其结构示意图如下:回答下列问题:
 (1)、基态铜原子的价层电子排布式为 , 位于周期表中第周期族。(2)、胆矾中S原子的杂化方式是 , H、O、S中,第一电离能最大的元素是(填元素符号)(3)、胆矾中存在的化学键有配位键、。(4)、含硫化合物SOCl2的VSEPR模型是 , 试分析该分子中健角∠Cl-S-O大于∠Cl-S-Cl的原因是。(5)、立方铜晶胞中铜原子的配位数为12,则每个晶胞中有个铜原子,铜原子的半径为rcm,则铜晶体的密度为g·cm-3(阿伏加德罗常数值用NA表示)。18. 铝的单质、合金及其化合物在生产、生活中具有广泛的应用。(1)、Al属于周期表中区元素,其基态原子核外具有种空间运动状态不同的电子。(2)、与Al位于同一周期,且第一电离能比Al小的元素有(填元素符号)。(3)、一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键;如果两个成键元素间的电负性差值小于1.7,它们之间通常形成共价键。部分主族元素的电负性如下表所示:
(1)、基态铜原子的价层电子排布式为 , 位于周期表中第周期族。(2)、胆矾中S原子的杂化方式是 , H、O、S中,第一电离能最大的元素是(填元素符号)(3)、胆矾中存在的化学键有配位键、。(4)、含硫化合物SOCl2的VSEPR模型是 , 试分析该分子中健角∠Cl-S-O大于∠Cl-S-Cl的原因是。(5)、立方铜晶胞中铜原子的配位数为12,则每个晶胞中有个铜原子,铜原子的半径为rcm,则铜晶体的密度为g·cm-3(阿伏加德罗常数值用NA表示)。18. 铝的单质、合金及其化合物在生产、生活中具有广泛的应用。(1)、Al属于周期表中区元素,其基态原子核外具有种空间运动状态不同的电子。(2)、与Al位于同一周期,且第一电离能比Al小的元素有(填元素符号)。(3)、一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键;如果两个成键元素间的电负性差值小于1.7,它们之间通常形成共价键。部分主族元素的电负性如下表所示:5B
2.0
6C
2.5
7N
3.0
8O
3.5
9F
4.0
13Al
1.5
14Si
1.8
15P
2.1
16S
2.5
17Cl
3.0
31Ga
1.6
32Ge
1.8
33As
2.0
34Se
2.4
35Br
2.8
下列含铝化合物属于离子化合物的是____(填标号)。
A、 B、 C、 D、AlP(4)、Al的熔点为660℃,Ga的熔点为29.76℃,Al的熔点更高的原因为。(5)、三甲基铝(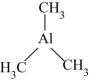 )是一种金属有机化合物,可作烯烃聚合催化剂、引火燃料。
)是一种金属有机化合物,可作烯烃聚合催化剂、引火燃料。①三甲基铝分子中C原子的VSEPR模型为 , Al原子的杂化轨道类型为。
②该物质可与胺类( , R表示烃基)结合,原因是。
(6)、X-射线衍射实验表明,合金Cr-Al晶体(有序)属四方晶系,其晶胞参数如图所示,晶胞棱边夹角均为90°。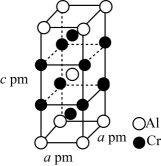
①该合鑫Cr-Al晶体的化学式为。
②用NA表示阿伏加德罗常数的值,则合金Cr-Al晶体的密度为(写出计算式即可,不要求化简)。
19. 五氟化锑主要用作氟化工的催化剂,也用作纺织工业织物阻燃剂,在染料工业中用于制造染料中间体,此外,还用于制备高纯度金属锑、无机离子交换材料和胶体五氧化二锑。以某锑矿(主要成分为Sb2O3 , 含有少量CuO、PbO、As2O3等杂质)为原料制备SbF5的工艺流程如图1:
已知:I.CuS、PbS的Ksp分别为6.3×10-36、9.0×10-29;
II.As2O3微溶于水、Sb2O3难溶于水,它们均为两性氧化物;SbOCl难溶于水。
回答下列问题:
(1)、已知锑与氮元同素主族,原子序数为51,请写出锑在元素周期表中的位置。(2)、“浸出”时少量Sb2O3转化为“滤渣1”。其成分为SbOCl,加入氨水“除氯”,同时将其转化为Sb2O3 , 该反应的离子方程式为 , 不宜用NaOH溶液代替氨水的原因为。(3)、“沉淀”的过程是加入极稀的Na2S溶液,其目的是使Cu2+和Pb2+转化为相应的硫化物而除去,当CuS、PbS共沉时,=。(4)、“除砷”时,H2PO转化为H3PO4 , 该反应中氧化剂与还原剂的物质的量之比为。(5)、“电解”中锑的产率与电压大小关系如图2所示。当电压趣过U0V时,锑的产率降低的原因可能是。 (6)、SbF5与KMnF6反应。首次实现了用化学方法制取F2 , 同时生成KSbF6和MnF3 , 化学反应方程式为。
(6)、SbF5与KMnF6反应。首次实现了用化学方法制取F2 , 同时生成KSbF6和MnF3 , 化学反应方程式为。三、推断题
-
20. 我国嫦娥五号探测器带回1.731kg的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素A、B、C、D,原子序数依次增大,最外层电子数之和为15。B、C、D为同周期相邻元素,A为地壳中含量最多的元素。回答下列问题:(1)、元素D在周期表中的位置为 , A、C的简单离子半径大小顺序为 (填离子符号)。(2)、化合物BA的电子式为(填元素符号)。A和D形成的化合物中的化学键类型为。(3)、B和C两元素相比较,金属性较强是 (填元素符号),可以证明该结论的实验。
A.比较两种元素的单质与冷的浓硫酸反应的速率
B.比较两种元素最高价氧化物对应的水化物的碱性
C.将相同大小的两种元素单质分别放入沸水中,观察反应现象
D.比较相同物质的量的两种元素的单质与足量稀盐酸反应产生的多少