从巩固到提高 高考化学二轮微专题31 金属电化学腐蚀与防护
试卷更新日期:2023-02-11 类型:二轮复习
一、单选题
-
1. 我国有着丰富的海风资源,在海水中建立风电设备,防腐蚀是一个突出问题。下列说法正确的是( )
 A、钢铁构件表面的镀铜破损后依然会保护内部钢铁不被腐蚀 B、可将钢铁构件与电源负极连接臧缓腐蚀发生 C、钢铁发生吸氧腐蚀时负极发生的反应为 D、海水中发生化学腐蚀的速率大于电化学腐蚀速率2. 某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,设计下表实验。将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞。从胶头滴管中一次性滴入醋酸溶液,同时测量容器中的压强变化。下列说法错误的是( )
A、钢铁构件表面的镀铜破损后依然会保护内部钢铁不被腐蚀 B、可将钢铁构件与电源负极连接臧缓腐蚀发生 C、钢铁发生吸氧腐蚀时负极发生的反应为 D、海水中发生化学腐蚀的速率大于电化学腐蚀速率2. 某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,设计下表实验。将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞。从胶头滴管中一次性滴入醋酸溶液,同时测量容器中的压强变化。下列说法错误的是( )
编号
实验目的
碳粉/g
铁粉/g
醋酸/
醋酸/
①
为以下实验作参照
0.5
2.0
90.0
2.0
②
醋酸浓度的影响
0.5
a
36.0
2.0
③
M
0.2
2.0
90.0
2.0
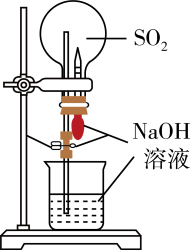
A、 B、M为“碳粉质量的影响” C、该实验一共探究了4种影响因素 D、铁发生电化学腐蚀负极反应为3. 化学在人类社会发展中发挥着重要作用,下列说法错误的是( )A、双氧水可用于处理泄漏的有毒物质 B、在钢铁设备上连接金属铜保护钢铁 C、高纯硅可用于制作通信设备的芯片 D、可用核磁共振氢谱区分苯甲醇和对甲基苯酚4. 含可钝化金属的工业管道或反应器,由于会被内部溶液腐蚀,通过外接电源而钝化,称之为阳极保护法。下图是某金属外接电势与电流密度的变化关系,有关说法正确的是( ) A、阳极保护法中受保护的金属外接电源的负极 B、电流密度越大,金属受保护程度越好 C、CFD区,金属受到保护 D、外接电势越高,对金属保护性越有效5. 我国古代的青铜器工艺精湛,有很高的艺术价值和历史价值。下列说法错误的是( )A、商代后期制作的司母戊鼎,其主要成分是铜合金 B、青铜文物在潮湿的土壤环境中比在干燥的环境中易被腐蚀 C、与火法冶铜(以Cu2S为原料)相比,采用湿法冶铜(以CuSO4为原料)的优点是减少了环境污染和能源消耗 D、《本草纲目》中载有一药物,名“铜青”,铜青是铜器上的绿色物质,则铜青就是青铜6. 如图实验,一段时间后,玻璃管口有气泡产生,下列说法正确的是( )
A、阳极保护法中受保护的金属外接电源的负极 B、电流密度越大,金属受保护程度越好 C、CFD区,金属受到保护 D、外接电势越高,对金属保护性越有效5. 我国古代的青铜器工艺精湛,有很高的艺术价值和历史价值。下列说法错误的是( )A、商代后期制作的司母戊鼎,其主要成分是铜合金 B、青铜文物在潮湿的土壤环境中比在干燥的环境中易被腐蚀 C、与火法冶铜(以Cu2S为原料)相比,采用湿法冶铜(以CuSO4为原料)的优点是减少了环境污染和能源消耗 D、《本草纲目》中载有一药物,名“铜青”,铜青是铜器上的绿色物质,则铜青就是青铜6. 如图实验,一段时间后,玻璃管口有气泡产生,下列说法正确的是( ) A、铁电极反应式为Fe-3e→ Fe3+ B、铁腐蚀过程中化学能转化为电能和热能 C、活性炭的存在可以减缓铁的腐蚀 D、铁发生析氢腐蚀7. 下列实验方案或操作正确且能达到实验目的的是( )
A、铁电极反应式为Fe-3e→ Fe3+ B、铁腐蚀过程中化学能转化为电能和热能 C、活性炭的存在可以减缓铁的腐蚀 D、铁发生析氢腐蚀7. 下列实验方案或操作正确且能达到实验目的的是( )A
B
C
D

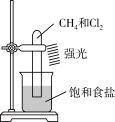
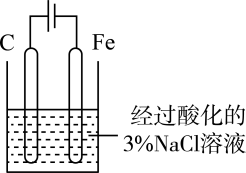
A.除去CO2中的水蒸气
B.进行喷泉实验
C.探究CH4与Cl2的反应
D.用铁氯化钾溶液验证牺牲阳极法保护铁
A、A B、B C、C D、D8. 下列有关金属及其化合物的应用不合理的是( )A、含有废铁屑的FeCl2溶液,可用于除去工业废气中的Cl2 B、盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良 C、铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业 D、钢铁设施采用“牺牲阳极的阴极保护法”时,表面连接的金属一定比铁活泼9. 下列说法正确的是( )A、波长为的紫外光的光子能量大于蛋白质中的、、键的键能,因而会灼伤皮肤 B、浓硝酸与碳在加热条件下得到的红棕色气体一定是被碳还原生成的 C、镀锌或镀铜的钢管破损后均会加快钢管的腐蚀 D、硅胶、生石灰、均可用作食品干燥剂10. 在硫酸盐还原细菌的作用下,深埋地下的铁管道与土壤中的硫酸根离子会发生电化学腐蚀,其原理如图所示。下列说法正确的是( ) A、铁管道发生的是吸氧腐蚀 B、铁管道附近土壤的pH会减小 C、铁管道上镀锌可以延缓管道的腐蚀 D、输送高温水蒸汽的铁管道也会发生该类型腐蚀11. 化学与社会、生活、生产密切相关,下列有关说法错误的是。( )A、2022年北京冬奥会开幕式上绚丽多彩的焰火,主要利用了“焰色反应”的知识 B、航天员所穿航天服的主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 C、“闽鹭”是我国制造的第四艘LNG船。船底镶嵌锌块,锌作正极,以防船体被腐蚀 D、低碳生活需要节能减排,使用太阳能代替化石燃料,可减少温室气体的排放12. 家庭常用的一种储水式电热水器的结构如下图所示,其中a、b为水管口。
A、铁管道发生的是吸氧腐蚀 B、铁管道附近土壤的pH会减小 C、铁管道上镀锌可以延缓管道的腐蚀 D、输送高温水蒸汽的铁管道也会发生该类型腐蚀11. 化学与社会、生活、生产密切相关,下列有关说法错误的是。( )A、2022年北京冬奥会开幕式上绚丽多彩的焰火,主要利用了“焰色反应”的知识 B、航天员所穿航天服的主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 C、“闽鹭”是我国制造的第四艘LNG船。船底镶嵌锌块,锌作正极,以防船体被腐蚀 D、低碳生活需要节能减排,使用太阳能代替化石燃料,可减少温室气体的排放12. 家庭常用的一种储水式电热水器的结构如下图所示,其中a、b为水管口。
下列说法错误的是( )
A、电热水器可将电能转化为热能 B、该热水器采用了牺牲阳极的电化学保护法 C、镁棒可以有效防止内部水垢生成 D、a应为出水口,b应为进水口13. 下列做法或实验(图中部分夹持装置已省略),能达到目的的是( )A
B
C
D




橡皮管能减小气体体积测量的误差
分离碘和四氯化碳的混合液
浓硫酸与萤石(主要成分为CaF2)加热制备HF
防止铁管道被腐蚀
A、A B、B C、C D、D14. 如图装置进行实验,向小试管中加入稀盐酸。观察到U形管内两边红墨水液面逐渐变为左低右高,与此现象有关的推论是( ) A、反应物总能量低于生成物 B、发生了析氢腐蚀,产生较多气体 C、生成物中化学键形成会放出能量 D、锥形瓶内气体分子间平均距离变大15. 利用下图所示装置能达到相应目的的是( )
A、反应物总能量低于生成物 B、发生了析氢腐蚀,产生较多气体 C、生成物中化学键形成会放出能量 D、锥形瓶内气体分子间平均距离变大15. 利用下图所示装置能达到相应目的的是( ) A、利用甲装置制取少量 B、利用乙装置测量化学反应速率 C、利用丙装置制备乙酸乙酯 D、利用丁装置对铁件进行保护16. 下列实验操作正确且能达到实验目的的是( )
A、利用甲装置制取少量 B、利用乙装置测量化学反应速率 C、利用丙装置制备乙酸乙酯 D、利用丁装置对铁件进行保护16. 下列实验操作正确且能达到实验目的的是( )选项
操作
目的
A
将MgCl2溶液加热蒸干
由MgCl2溶液制备无水MgCl2
B
将铁钉放入试管中,用盐酸浸没
验证铁的吸氧腐蚀
C
称取KMnO4固体0.3160g,放入100mL容量瓶中,加水溶解并稀释至刻度
配制浓度为0.0200的KMnO4溶液
D
先从分液漏斗下口放出有机层,后从上口倒出水层
CCl4萃取分离碘水中的I2
A、A B、B C、C D、D17. 下列有关金属腐蚀的说法中正确的是( )A、银质奖牌久置后表面变暗是因为发生了电化腐蚀 B、因为二氧化碳普遍存在, 所以钢铁的电化腐蚀以析氢腐蚀为主 C、无论是析氢腐蚀还是吸氧腐蚀, 总是金属被氧化 D、钢铁吸氧腐蚀的正极反应:18. 化学与社会、生活、生产密切相关,下列有关说法正确的是( )A、漂白粉可用于游泳池杀菌消毒 B、菜刀洗净后擦干主要是为了防止发生化学腐蚀 C、安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 D、区分食盐是否加碘的方法是向食盐溶液中加少量淀粉,观察是否变蓝19. 下列叙述正确的是( )A、需要通电才可进行的有:电离、电解、电泳、电镀、电化学腐蚀 B、盐卤(含MgCl2)Mg(OH)2MgCl2溶液Mg C、煤的“气化”、煤的“液化”、煤的“干馏”都是化学变化 D、淀粉、蛋白质、纤维素、油脂都是高分子化合物,氨水、王水、双氧水都是混合物20. 生活因化学更美好,以下生活用途和化学原理都正确的是( )选项
生活用途
化学原理
A
电热水器内胆连接镁棒防止腐蚀
牺牲阳极的阴极保护法
B
过氧化钠用作呼吸面具或潜水艇中的供氧剂
过氧化钠具有氧化性
C
明矾可用作净水剂和消毒剂
铝离子水解生成氢氧化铝胶体
D
铁粉和生石灰常用作袋装食品的抗氧化剂
能够吸收氧气防止食品腐坏
A、A B、B C、C D、D二、综合题
-
21. 铁的腐蚀与防护与生产生活密切相关。(1)、Ⅰ.研究铁的腐蚀
实验步骤如下:
步骤1:将铁粉放置于0.002 溶液中浸泡,过滤后用水洗涤。
步骤2:向15.00 mL 1 NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。
步骤3:采集溶液pH随时间变化的数据。

第一阶段,主要发生析氢腐蚀,Cu上发生的电极反应为。
(2)、第二、三阶段主要发生吸氧腐蚀。①选取b点进行分析,经检验溶液中含有 , 写出Fe被腐蚀的总反应。
②取b点溶液向其中滴加KSCN无明显现象,加入稀盐酸后立即变红。写出b点被氧化的离子方程式。
③依据b点发生的反应,分析第二阶段pH上升的原因是。
(3)、Ⅱ.研究铁的防护在铁表面镀锌可有效防止铁被腐蚀
已知:放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。
①镀件Fe应与电源的相连。
②向电解液中加入NaCN溶液,将转化为 , 电解得到的镀层更加致密、细腻,原因是。
(4)、电镀后的废水中含有 , 一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c 溶液滴定,消耗溶液V mL。已知:(无色) , 。①滴定终点的现象是。
②废水中的含量是(填计算式)。