从巩固到提高 高考化学二轮微专题30 电解池
试卷更新日期:2023-02-11 类型:二轮复习
一、单选题
-
1. 某电化学装置如图所示,该装置能将CO2转化为燃料C2H5OH,从而实践“碳中和”。下列说法正确的是( )
 A、该电化学装置实现“碳中和”的同时将光能转化为电能 B、该电化学装置工作时,溶液中的H+由a极区移向b极区 C、a电极的反应式为2CO2+12H++12e-=C2H5OH+3H2O D、每生成3.36LO2 , 有4.4gCO2被还原2. 电化学广泛应用于工业领域。下列叙述正确的是( )A、电解精炼铜时,与电源正极相连的是精铜 B、锌铜原电池产生电流时,溶液中的阳离子移向Zn电极 C、用惰性电极电解足量的饱和食盐水时,阳极的电极反应式: D、外接电源保护海水中钢闸门时,应将钢闸门与电源的正极相连3. 科学家近年发明了一种新型水介质电池。电池示意图如下,电极为金属锌和选择性催化材料。放电时,温室气体被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法正确的是( )
A、该电化学装置实现“碳中和”的同时将光能转化为电能 B、该电化学装置工作时,溶液中的H+由a极区移向b极区 C、a电极的反应式为2CO2+12H++12e-=C2H5OH+3H2O D、每生成3.36LO2 , 有4.4gCO2被还原2. 电化学广泛应用于工业领域。下列叙述正确的是( )A、电解精炼铜时,与电源正极相连的是精铜 B、锌铜原电池产生电流时,溶液中的阳离子移向Zn电极 C、用惰性电极电解足量的饱和食盐水时,阳极的电极反应式: D、外接电源保护海水中钢闸门时,应将钢闸门与电源的正极相连3. 科学家近年发明了一种新型水介质电池。电池示意图如下,电极为金属锌和选择性催化材料。放电时,温室气体被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法正确的是( ) A、放电时,负极区pH升高 B、放电时,1mol转化为HCOOH,转移的电子数为4mol C、充电时,Zn电极连电源正极 D、充电时,产生22.4L(标准状况下) , 生成的Zn为130g4. 如图所示电解装置中,通电后Ⅱ室溶液底部逐渐溶解,下列判断正确的是( )
A、放电时,负极区pH升高 B、放电时,1mol转化为HCOOH,转移的电子数为4mol C、充电时,Zn电极连电源正极 D、充电时,产生22.4L(标准状况下) , 生成的Zn为130g4. 如图所示电解装置中,通电后Ⅱ室溶液底部逐渐溶解,下列判断正确的是( ) A、a是电源的正极 B、通电一段时间后,向石墨电极Ⅱ附近滴加酚酞溶液,出现红色 C、随着电解的进行,Ⅰ室溶液的pH变大 D、当0.01mol 全溶解时,至少产生气体672mL(标准状况下测得)5. “电絮凝-电气浮法”污水处理装置原理如图所示。在外电压作用下,可溶性阳极产生阳离子体对胶体污染物发生凝聚效应,同时另一极产生气体,在气体上浮过程中将絮体上浮,从而实现污染物的分离和水的净化。下列有关说法错误的是( )
A、a是电源的正极 B、通电一段时间后,向石墨电极Ⅱ附近滴加酚酞溶液,出现红色 C、随着电解的进行,Ⅰ室溶液的pH变大 D、当0.01mol 全溶解时,至少产生气体672mL(标准状况下测得)5. “电絮凝-电气浮法”污水处理装置原理如图所示。在外电压作用下,可溶性阳极产生阳离子体对胶体污染物发生凝聚效应,同时另一极产生气体,在气体上浮过程中将絮体上浮,从而实现污染物的分离和水的净化。下列有关说法错误的是( ) A、外接电源a端为正极 B、石墨极电极反应为:4OH- - 4e- =O2↑+2H2O C、电解时阳极产生少量强氧化性新生态氧,有一定杀菌作用 D、铝电极可以用铁替换6. 如图是我国研发的某种石墨烯电池有关原理示意图,装置甲工作时的电极反应为Li1-xC6+xLi++xe-=LiC6 , Li[GS/Si]O2-xe-=Li1-x[GS/Si]O2+xLi+。下列说法错误的是( )
A、外接电源a端为正极 B、石墨极电极反应为:4OH- - 4e- =O2↑+2H2O C、电解时阳极产生少量强氧化性新生态氧,有一定杀菌作用 D、铝电极可以用铁替换6. 如图是我国研发的某种石墨烯电池有关原理示意图,装置甲工作时的电极反应为Li1-xC6+xLi++xe-=LiC6 , Li[GS/Si]O2-xe-=Li1-x[GS/Si]O2+xLi+。下列说法错误的是( ) A、a与d电极上发生的反应类型相同,装置甲中b电极的电势高于a电极 B、甲乙两个装置中的离子交换膜均为阳离子交换膜 C、装置甲工作时电子经流:负极→a→离子交换隔膜→>b→正极 D、电池放电时,正极反应为Li1-x[GS/Si]O2+xLi++xe-=Li[(GS/Si]O27. 有一种清洁、无膜的氯碱工艺,它利用含有保护层的电极(Na0.44MnO2/Na0.44-xMnO2)中的Na+的脱除和嵌入机理,分两步电解得到氯碱工业产品,其原理如图所示。下列说法正确的是( )
A、a与d电极上发生的反应类型相同,装置甲中b电极的电势高于a电极 B、甲乙两个装置中的离子交换膜均为阳离子交换膜 C、装置甲工作时电子经流:负极→a→离子交换隔膜→>b→正极 D、电池放电时,正极反应为Li1-x[GS/Si]O2+xLi++xe-=Li[(GS/Si]O27. 有一种清洁、无膜的氯碱工艺,它利用含有保护层的电极(Na0.44MnO2/Na0.44-xMnO2)中的Na+的脱除和嵌入机理,分两步电解得到氯碱工业产品,其原理如图所示。下列说法正确的是( ) A、电解时产生的X气体是O2 , Y气体是Cl2 B、b是直流电源的正极,c是直流电源的负极 C、钠离子嵌入时的电极反应式为:Na0.44MnO2- xe-= Na0.44-xMnO2+ xNa+ D、第一步电解后,Na0.44MnO2/Na0.44-xMnO2电极不经清洗可直接用于第二步电解8. 我国科学家最近研发出一种新型纳米硅锂电池,可反复充电3万次,电池容量只衰减了不到10%。电池反应式为Li1-xTiO2+LixSiLiTiO2+Si。下列说法错误的是( )
A、电解时产生的X气体是O2 , Y气体是Cl2 B、b是直流电源的正极,c是直流电源的负极 C、钠离子嵌入时的电极反应式为:Na0.44MnO2- xe-= Na0.44-xMnO2+ xNa+ D、第一步电解后,Na0.44MnO2/Na0.44-xMnO2电极不经清洗可直接用于第二步电解8. 我国科学家最近研发出一种新型纳米硅锂电池,可反复充电3万次,电池容量只衰减了不到10%。电池反应式为Li1-xTiO2+LixSiLiTiO2+Si。下列说法错误的是( ) A、电池放电时,Li+由N极移向M极 B、电池放电时,电池正极反应式为Li1-xTiO2+xLi++xe-=LiTiO2 C、精制的饱和食盐水通入阳极室 D、负极质量减轻7g时,理论上最多可制得40gNaOH9. 某锂离子电池的总反应为:。某小组以该电池为电源电解处理含废水和含、的酸性废水,并分别获得溶液和单质镍。电解处理的工作原理如图所示[为锂离子电池的电解质]。下列说法错误的是( )
A、电池放电时,Li+由N极移向M极 B、电池放电时,电池正极反应式为Li1-xTiO2+xLi++xe-=LiTiO2 C、精制的饱和食盐水通入阳极室 D、负极质量减轻7g时,理论上最多可制得40gNaOH9. 某锂离子电池的总反应为:。某小组以该电池为电源电解处理含废水和含、的酸性废水,并分别获得溶液和单质镍。电解处理的工作原理如图所示[为锂离子电池的电解质]。下列说法错误的是( ) A、X与锂离子电池的FeS电极相连 B、a室的电极反应式为: C、离子膜N为阳离子交换膜,离子膜M为阴离子交换膜 D、若去掉离子膜M将a、b两室合并,则X电极将产生有毒气体10. 一种氯离子介导的电化学合成方法,能将乙烯高效清洁、选择性地转化为环氧乙烷,电化学反应的具体过程如图所示。在电解结束后,将阴、阳极电解液输出混合,便可反应生成环氧乙烷。下列说法错误的是( )
A、X与锂离子电池的FeS电极相连 B、a室的电极反应式为: C、离子膜N为阳离子交换膜,离子膜M为阴离子交换膜 D、若去掉离子膜M将a、b两室合并,则X电极将产生有毒气体10. 一种氯离子介导的电化学合成方法,能将乙烯高效清洁、选择性地转化为环氧乙烷,电化学反应的具体过程如图所示。在电解结束后,将阴、阳极电解液输出混合,便可反应生成环氧乙烷。下列说法错误的是( )
 A、Ni电极与电源正极相连 B、该过程的总反应为:CH2=CH2+H2O→
A、Ni电极与电源正极相连 B、该过程的总反应为:CH2=CH2+H2O→ +H2
C、工作过程中阴极附近pH增大
D、在电解液混合过程中会发生反应:
11. 中科大经过多次实验发现,采用如图所示装置,阳极(Ti基)上产生羟基·OH(·OH氧化性仅次于F),阴极上产生H2O2 , 分别深度氧化苯酚( C6H5OH)为CO2 , 实现了对苯酚酸性废水的高效处理。下列有关说法错误的是( )
+H2
C、工作过程中阴极附近pH增大
D、在电解液混合过程中会发生反应:
11. 中科大经过多次实验发现,采用如图所示装置,阳极(Ti基)上产生羟基·OH(·OH氧化性仅次于F),阴极上产生H2O2 , 分别深度氧化苯酚( C6H5OH)为CO2 , 实现了对苯酚酸性废水的高效处理。下列有关说法错误的是( ) A、电流从a极→Ti基→废水→不锈钢→b极 B、阴极电极反应为2H+ + O2+ 2e-= H2O2 C、阳极处理苯酚的方程式为C6H5OH + 28·OH = 6CO2 +17H2O D、当消耗14molO2时,理论上共氧化处理94g苯酚12. 我国科研团队开发了一种新型铠甲催化剂Ni/Co@石墨烯,可以高效去除合成气中的H2S杂质并耦合产氢,其工作原理如图所示。下列说法错误的是( )
A、电流从a极→Ti基→废水→不锈钢→b极 B、阴极电极反应为2H+ + O2+ 2e-= H2O2 C、阳极处理苯酚的方程式为C6H5OH + 28·OH = 6CO2 +17H2O D、当消耗14molO2时,理论上共氧化处理94g苯酚12. 我国科研团队开发了一种新型铠甲催化剂Ni/Co@石墨烯,可以高效去除合成气中的H2S杂质并耦合产氢,其工作原理如图所示。下列说法错误的是( ) A、M电极为阴极,电极上发生还原反应 B、生成H2和Sx的物质的量之比为1:x C、阳极的电极反应式为xH2S- 2xe- =Sx +2xH+ D、铠甲催化剂表面的石墨烯可以保护内部金属核免受环境的影响13. 甲是一种在微生物作用下将废水中的尿素转化为环境友好物质,实现化学能转化为电能的装置。利用甲、乙两装置,实现对冶金硅(为硅源)进行电解精炼制备高纯硅。下列说法错误的是( )
A、M电极为阴极,电极上发生还原反应 B、生成H2和Sx的物质的量之比为1:x C、阳极的电极反应式为xH2S- 2xe- =Sx +2xH+ D、铠甲催化剂表面的石墨烯可以保护内部金属核免受环境的影响13. 甲是一种在微生物作用下将废水中的尿素转化为环境友好物质,实现化学能转化为电能的装置。利用甲、乙两装置,实现对冶金硅(为硅源)进行电解精炼制备高纯硅。下列说法错误的是( )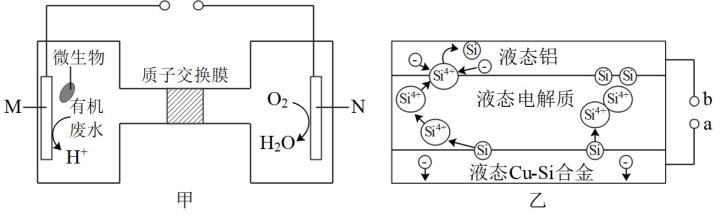 A、电极M与电极相连 B、当甲池中消耗时,乙池得到高纯硅 C、乙池中液态合金为阳极,液态铝为阴极 D、M上的电极反应式为:
A、电极M与电极相连 B、当甲池中消耗时,乙池得到高纯硅 C、乙池中液态合金为阳极,液态铝为阴极 D、M上的电极反应式为:二、多选题
-
14. 我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如图。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述错误的是( )
 A、放电时,a电极反应为I2Br-+2e-=2I-+Br- B、放电时,溶液中离子的数目增大 C、充电时,b电极每增重0.65g,溶液中有0.02molI-被还原 D、充电时,a电极接外电源负极15. 现有一种安全、高效的双极制氢系统,该系统能够从阳极低电压醛氧化和阴极析氢反应中得到氢气;其工作原理如图所示。下列说法正确的是( )
A、放电时,a电极反应为I2Br-+2e-=2I-+Br- B、放电时,溶液中离子的数目增大 C、充电时,b电极每增重0.65g,溶液中有0.02molI-被还原 D、充电时,a电极接外电源负极15. 现有一种安全、高效的双极制氢系统,该系统能够从阳极低电压醛氧化和阴极析氢反应中得到氢气;其工作原理如图所示。下列说法正确的是( ) A、电压越高,阳极制氢速率越快 B、电解一段时间后,阴极室的pH不变 C、制得1mol氢气,理论上有1molOH-透过交换膜 D、阳极反应为2R-CHO+4OH--2e-=2R-COO-+H2↑+2H2O
A、电压越高,阳极制氢速率越快 B、电解一段时间后,阴极室的pH不变 C、制得1mol氢气,理论上有1molOH-透过交换膜 D、阳极反应为2R-CHO+4OH--2e-=2R-COO-+H2↑+2H2O三、综合题
-
16. 二氧化碳的排放越来越受到能源和环境领域的关注,其综合利用是目前研究的重要课题之一、回答下列问题:(1)、已知下列反应的正反应活化能(E1)逆反应活化能(E2)如表所示:
序号
化学反应
E1/(kJ·mol-1)
E2/(kJ·mol-1)
①
H2(g)+ O2(g)=H2O(1)
685
970
②
2CH3OH(1) + 3O2(g)=2CO2 (g) +4H2O (1)
3526
4978
CO2与H2合成液态甲醇的热化学方程式为。
(2)、一定温度下,在2L密闭容器中充入3 mol CO2和 6 mol H2 , 发生反应:CO2(g)+ 3H2(g) CH3OH(g) + H2O(g),测定H2的转化率[α(H2) ]随时间的变化如图所示:
①0~ 20 min内,用CH3OH的浓度变化表示的平均 反应速率:v(CH3OH)= mol·L-1·min-1。
②该温度下,反应的平衡常数K= (结果保 留两位小数)。
③若在上述平衡状态下,再向容器中充入1mol CO2和1molH2O(g),则反应速率 v(正)v(逆) (填“>”“< “或“= “)。
(3)、科学家提出利用CO2与CH4制备合成气: CO2(g) +CH4(g) 2CO(g)+ 2H2(g)。在体积均为2L的密闭容器甲和乙中,分别充入1 molCO2和1 mol CH4、2 mol CO2和2 mol CH4 , 在相同温度下达到平衡状态时,CO2的转化率:α(甲)α(乙)(填“>”“<“或“=” ,下同),达到平衡所需的时间: t(甲) t(乙)。 (4)、如图是利用太阳能电池电解C2H6分别转化成其它含碳化合物的原理示意图,碳电极上生成CO的电极反应式。若起始投入0.3mol C2H6全部反应完全,生成三种产物中C2H4的物质的量为0.1mol,则电路中转移的电子数目为。
(4)、如图是利用太阳能电池电解C2H6分别转化成其它含碳化合物的原理示意图,碳电极上生成CO的电极反应式。若起始投入0.3mol C2H6全部反应完全,生成三种产物中C2H4的物质的量为0.1mol,则电路中转移的电子数目为。 17. 目前人工固氨和二氧化碳利用技术,对人类生存、社会进步和经济发展都有着重大意义。(1)、Ⅰ.目前研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,其总反应可表示为。
17. 目前人工固氨和二氧化碳利用技术,对人类生存、社会进步和经济发展都有着重大意义。(1)、Ⅰ.目前研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,其总反应可表示为。该反应能自发的条件是(填“低温”或“高温”)。
(2)、二氧化碳催化加氢制甲醇合成总反应在起始物时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃时x(CH3OH)随压强(p)的变化及在时x(CH3OH)随温度(t)的变化,如图所示。
①图中对应等温过程的曲线是(填“a”或“b”),判断的理由是。
②t=250℃时,当x(CH3OH)=0.10时,的平衡转化率 , (保留小数点后一位)此条件下该反应的Kp=。(保留小数点后两位)(对于气相反应,可以用分压表示,分压=总压×物质的量分数)。
(3)、研究表明,在电解质水溶液中,电池中的气体可被还原,在(填“正”或“负”)极发生电化学反应,而在碱性介质中被还原为正丙醇(CH3CH2CH2OH),其电极反应方程式为。(4)、Ⅱ.目前工业上利用氮气和氢气催化合成氨是人工固氮的主要手段。合成氨的反应历程和能量变化如图所示。请回答下列问题:
合成氨反应的热化学方程式为。
(5)、对总反应速率影响较大的步骤的能垒(活化能)为kJ,该步骤的化学方程式为。18. 次磷酸钠(NaH2PO2)广泛应用于电镀、材料等行业,在生产NaH2PO2的过程中会产生大量废渣[主要含NaH2PO2和CaHPO3 , 还含有少量Ca(OH)2], 一种回收NaH2PO2实现废渣资源化利用的工艺流程如下:
已知:CaHPO3和Ca(OH)2的Ksp分别为1 ×10-4和6 ×10-6 , H3PO3为二元中强酸。
回答下列问题:
(1)、“碱浸”发生反应的化学方程式为 , “ 趁热过滤”的目的是。要使该操作后所得滤液中的浓度不小于0.01 mol·L-1 , 则滤液pH不低于(lg6=0.8)。(2)、“试剂A”的化学式为 ,Na2HPO3属于 (填 “正盐”或“酸式盐”)。(3)、电解NaH2PO2溶液可制得Ni(H2PO2)2 , 后者广泛用于化学镀镍,电解NaH2PO2溶液装置如图所示。阴极的电极反应式为 , 产品室能得到Ni(H2PO2)2的原理是。 (4)、化学镀镍的方法是:将镀件置于一定浓度的Ni(H2PO2)2溶液中,加入NaOH溶液至碱性,产生的Ni可均匀地沉积在镀件上(同时生成),发生反应的离子方程式为。与电镀镍相比,化学镀镍工艺的优点是(写出一点)。19. 火法炼铜过程中产生的碱性渣,其主要成分为TeO2、Na2TeO3、Na2SeO3以及少量的CuO、PbO、SiO2等。一种利用这种碱性渣提取高纯碲和粗硒的工艺流程如下图所示。
(4)、化学镀镍的方法是:将镀件置于一定浓度的Ni(H2PO2)2溶液中,加入NaOH溶液至碱性,产生的Ni可均匀地沉积在镀件上(同时生成),发生反应的离子方程式为。与电镀镍相比,化学镀镍工艺的优点是(写出一点)。19. 火法炼铜过程中产生的碱性渣,其主要成分为TeO2、Na2TeO3、Na2SeO3以及少量的CuO、PbO、SiO2等。一种利用这种碱性渣提取高纯碲和粗硒的工艺流程如下图所示。
已知:Ksp (CuS)=6×10-36;Ksp(PbS)=9×10-29。
请回答以下问题:
(1)、“碱浸”前应对碱性渣进行的操作是。(2)、下图分别是温度和NaOH溶液浓度对碲浸出率的影响,则碱浸时的合适温度是。实际生产中采用1mol·L-1的NaOH溶液,而不用更大浓度 NaOH溶液的原因是。 (3)、已知:CuO和PbO均具有一定的“两性”,“碱浸”时生成物类型类似于偏铝酸钠。则“碱浸”时PbO所发生反应的离子方程式为。(4)、滤渣3的主要成分为。滤液中Pb2+沉淀完全时,c(Cu2+)的最大值是mol·L-1 , (保留小数点后2位。某离子浓度低于1×10-5mol·L-1时,可认为该离子沉淀完全)(5)、电解制碲时阴极的电极反应式为。电解余液经处理后可循环使用于步骤。电解时电流为10A,电解时间为4h。若生成碲(Te)的电流利用率为95%,则生成碲的质量为。(法拉第常数为96500C·mol-1 , 保留小数点后1位)
(3)、已知:CuO和PbO均具有一定的“两性”,“碱浸”时生成物类型类似于偏铝酸钠。则“碱浸”时PbO所发生反应的离子方程式为。(4)、滤渣3的主要成分为。滤液中Pb2+沉淀完全时,c(Cu2+)的最大值是mol·L-1 , (保留小数点后2位。某离子浓度低于1×10-5mol·L-1时,可认为该离子沉淀完全)(5)、电解制碲时阴极的电极反应式为。电解余液经处理后可循环使用于步骤。电解时电流为10A,电解时间为4h。若生成碲(Te)的电流利用率为95%,则生成碲的质量为。(法拉第常数为96500C·mol-1 , 保留小数点后1位)四、实验探究题
-
20. 绿水青山和金山银山绝不是对立的,关键在人,关键在思路。消除NOx、CO、SO2等大气污染物对建设美丽环境具有重要意义。(1)、工业上常用氨水吸收法处理尾气中的SO2 , 已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+2NH3·H2O(aq)=(NH4)2SO3(aq)+H2O(l) △H1
②(NH4)2SO3(aq)+SO2(g)+H2O(l)=2NH4HSO3(aq) △H2
③2NH4HSO3(aq)+2NH3·H2O+O2(g)=2(NH4)2SO4(aq)+2H2O(l) △H3
则2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=。
(2)、工业上可将SO2和NO2混合转化,反应为SO2(g)+NO2(g)SO3(g)+NO(g) △H<0,进而制取硫酸。欲使该反应的速率增大且平衡逆向移动,改变的反应条件为。一定温度下,能判断该反应已达到化学平衡状态的是(填字母)。A.SO3和NO的浓度比保持不变
B.混合气体的颜色保持不变
C.容器中压强不再变化
D.恒容混合气体的密度保持不变
(3)、NO和NO2尾气可用碱液吸收,生成的可用电化学原理降解,原理如图所示,则阴极为(填a或b),电极反应式为。 (4)、利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g)N2(g)+2CO2(g) △H<0。实验测得v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2),k正、k逆为速率常数,只与温度有关。
(4)、利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g)N2(g)+2CO2(g) △H<0。实验测得v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2),k正、k逆为速率常数,只与温度有关。①达到平衡后,仅升高温度,k正增大的倍数(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,总压为a,在一定温度下达到平衡时,CO的转化率为50%,则=;在t1min时再向容器内加入1molCO和1molNO,保持温度不变,则再次达平衡时NO的转化率(填“增大”“减小”或“不变”)。整个过程中容器中的气压(P)与反应时间(t)的关系曲线如图所示,则用平衡分压代替平衡浓度表示的压强平衡常数Kp=。
