从巩固到提高 高考化学二轮微专题29 化学电源与新型电池
试卷更新日期:2023-02-11 类型:二轮复习
一、单选题
-
1. 下图为最新研制的一款车载双电极镍氢电池,放电时a、c电极的反应物为吸附了氢气的稀土合金,可表示为MH;充电时b、d电极的反应物为吸附的Ni(OH)2 , 下列叙述正确的是( )
 A、放电时电子的流动路径为: a→外电路→d→c→铜箔→b B、放电时c极上的反应可表示为: MH-e- + OH-= M+H2O C、充电时a、b接电源的负极,c、d接电源的正极 D、充电时外电路每通过2mol电子,该电池正极共增重4g2. 复旦大学教授吴字平课题组研制的水溶液锂电池成功应用于电动汽车,原理如图所示。其中锂电极用复合膜包裹,复合膜只允许Li+通过;尖晶石锰酸锂(LiMn2O4)覆盖碳膜上,发生的转化为LiMn2O4Li1-xMn2O4。下列有关说法正确的是( )
A、放电时电子的流动路径为: a→外电路→d→c→铜箔→b B、放电时c极上的反应可表示为: MH-e- + OH-= M+H2O C、充电时a、b接电源的负极,c、d接电源的正极 D、充电时外电路每通过2mol电子,该电池正极共增重4g2. 复旦大学教授吴字平课题组研制的水溶液锂电池成功应用于电动汽车,原理如图所示。其中锂电极用复合膜包裹,复合膜只允许Li+通过;尖晶石锰酸锂(LiMn2O4)覆盖碳膜上,发生的转化为LiMn2O4Li1-xMn2O4。下列有关说法正确的是( ) A、放电时,Li+由电解质溶液穿进复合膜 B、放电时,正极反应为Li1-xMn2O4+xLi++xe-=LiMn2O4 C、充电时,电极a为阳极,发生氧化反应 D、该电池的缺点是存在副反应2Li+2H2O=2LiOH+H2↑3. 实现“碳中和”的重要方式之一是将重新转化成能源,在金属氧化物电解池,高温下电解的混合气体制备和CO是一种新的能源利用方式,基本原理如图所示。下列说法错误的是( )
A、放电时,Li+由电解质溶液穿进复合膜 B、放电时,正极反应为Li1-xMn2O4+xLi++xe-=LiMn2O4 C、充电时,电极a为阳极,发生氧化反应 D、该电池的缺点是存在副反应2Li+2H2O=2LiOH+H2↑3. 实现“碳中和”的重要方式之一是将重新转化成能源,在金属氧化物电解池,高温下电解的混合气体制备和CO是一种新的能源利用方式,基本原理如图所示。下列说法错误的是( ) A、Y是电源的正极 B、阳极的电极反应式是 C、总反应可表示为 D、阴阳两极生成的气体的物质的量之比是1:24. 太阳能发电和阳光分解水是清洁能源研究的主攻方向。染料敏化的TiO2纳米晶薄膜半导体光解水的基本原理如图,下列对该装置的相关说法错误的是( )
A、Y是电源的正极 B、阳极的电极反应式是 C、总反应可表示为 D、阴阳两极生成的气体的物质的量之比是1:24. 太阳能发电和阳光分解水是清洁能源研究的主攻方向。染料敏化的TiO2纳米晶薄膜半导体光解水的基本原理如图,下列对该装置的相关说法错误的是( ) A、SO由甲电极向乙电极定向移动 B、甲电极反应为 C、电池总反应为 D、实现光能→电能→化学能的转换5. 浓差电池是由于电池中存在浓度差而产生的。锂离子浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。下列说法错误的是( )
A、SO由甲电极向乙电极定向移动 B、甲电极反应为 C、电池总反应为 D、实现光能→电能→化学能的转换5. 浓差电池是由于电池中存在浓度差而产生的。锂离子浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。下列说法错误的是( ) A、若Y电极材料为铁,也能实现如图转化 B、浓缩海水中锂离子浓度大于左侧LiCl溶液中的锂离子浓度 C、X电极的反应为:2H++2e-=H2↑ D、右侧生成1molCl2时,左侧Li+增加2mol6. 以锂硫电池(电池的总反应为2Li + xS= Li2Sx )为电源,电解含(NH4)2SO4的废水制备硫酸和化肥的原理如图(不考虑其他杂质离子的反应)。下列说法正确的是( )
A、若Y电极材料为铁,也能实现如图转化 B、浓缩海水中锂离子浓度大于左侧LiCl溶液中的锂离子浓度 C、X电极的反应为:2H++2e-=H2↑ D、右侧生成1molCl2时,左侧Li+增加2mol6. 以锂硫电池(电池的总反应为2Li + xS= Li2Sx )为电源,电解含(NH4)2SO4的废水制备硫酸和化肥的原理如图(不考虑其他杂质离子的反应)。下列说法正确的是( ) A、a为锂硫电池的负极 B、电解池中膜1和膜2都是阳离子交换膜 C、锂硫电池每消耗2.8g锂,理论上M室产生2.24L气体(标准状况) D、电解一段时间后,原料室中溶液的pH会下降7. 一种铝—空气电池放电过程如图所示,下列关于该电池放电时的说法正确的是( )
A、a为锂硫电池的负极 B、电解池中膜1和膜2都是阳离子交换膜 C、锂硫电池每消耗2.8g锂,理论上M室产生2.24L气体(标准状况) D、电解一段时间后,原料室中溶液的pH会下降7. 一种铝—空气电池放电过程如图所示,下列关于该电池放电时的说法正确的是( ) A、a极发生还原反应 B、往b极迁移 C、每转移4mol电子,正极消耗1mol空气 D、负极电极反应式:8. 我国科研团队设计了一种表面锂掺杂的锡纳米粒子催化剂s-SnLi可提高电催化制甲酸盐的产率,同时释放电能,实验原理如图所示。下列说法错误的是( )
A、a极发生还原反应 B、往b极迁移 C、每转移4mol电子,正极消耗1mol空气 D、负极电极反应式:8. 我国科研团队设计了一种表面锂掺杂的锡纳米粒子催化剂s-SnLi可提高电催化制甲酸盐的产率,同时释放电能,实验原理如图所示。下列说法错误的是( )
 A、充电时,电池总反应为:2 2Zn +O2↑+4OH- +2H2O B、使用催化剂Sn或者s-SnLi均能加快化学反应速率,且能有效减少副产物CO的生成 C、若电池工作t min,维持电流强度为IA,理论上消耗CO2的质量为g(已知F =96500 C/mol) D、使用s-SnLi 催化剂,中间产物更不稳定9. 我国科学家最近研发出一种新型纳米硅锂电池,可反复充电3万次,电池容量只衰减了不到10%。电池反应式为Li1-xTiO2+LixSiLiTiO2+Si。下列说法错误的是( )
A、充电时,电池总反应为:2 2Zn +O2↑+4OH- +2H2O B、使用催化剂Sn或者s-SnLi均能加快化学反应速率,且能有效减少副产物CO的生成 C、若电池工作t min,维持电流强度为IA,理论上消耗CO2的质量为g(已知F =96500 C/mol) D、使用s-SnLi 催化剂,中间产物更不稳定9. 我国科学家最近研发出一种新型纳米硅锂电池,可反复充电3万次,电池容量只衰减了不到10%。电池反应式为Li1-xTiO2+LixSiLiTiO2+Si。下列说法错误的是( ) A、电池放电时,Li+由N极移向M极 B、电池放电时,电池正极反应式为Li1-xTiO2+xLi++xe-=LiTiO2 C、精制的饱和食盐水通入阳极室 D、负极质量减轻7g时,理论上最多可制得40gNaOH10. 我国科研人员以二硫化钼(MoS2)作为电极催化剂,研发出一种Zn-NO电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图所示(双极膜可将水解离成H+和OH- , 并实现其定向通过)。下列说法正确的是( )
A、电池放电时,Li+由N极移向M极 B、电池放电时,电池正极反应式为Li1-xTiO2+xLi++xe-=LiTiO2 C、精制的饱和食盐水通入阳极室 D、负极质量减轻7g时,理论上最多可制得40gNaOH10. 我国科研人员以二硫化钼(MoS2)作为电极催化剂,研发出一种Zn-NO电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图所示(双极膜可将水解离成H+和OH- , 并实现其定向通过)。下列说法正确的是( ) A、外电路中电子从MoS2电极流向Zn/ZnO电极 B、双极膜右侧为阴离子交换膜 C、当电路中转移0.2 mol电子时负极质量减小6.5 g D、使用MoS2电极能加快合成氨的速率11. 火星大气约95%是CO2 , Li-CO2电池在未来的火星探测领域有着重要的应用前景。科学家设计了一系列Ru/M-CPY@ CNT(碳纳米管)杂化材料(M = Co、Zn、Ni、Mn, CNTs碳纳米管是一种电导率高、比表面积大、通道和孔隙率丰富的导电基底)作为电极。已知该电池放电时的反应为4Li+3CO2=2Li2CO3+C,下列说法错误的是( )
A、外电路中电子从MoS2电极流向Zn/ZnO电极 B、双极膜右侧为阴离子交换膜 C、当电路中转移0.2 mol电子时负极质量减小6.5 g D、使用MoS2电极能加快合成氨的速率11. 火星大气约95%是CO2 , Li-CO2电池在未来的火星探测领域有着重要的应用前景。科学家设计了一系列Ru/M-CPY@ CNT(碳纳米管)杂化材料(M = Co、Zn、Ni、Mn, CNTs碳纳米管是一种电导率高、比表面积大、通道和孔隙率丰富的导电基底)作为电极。已知该电池放电时的反应为4Li+3CO2=2Li2CO3+C,下列说法错误的是( ) A、放电时,Li电极作电池负极,有电子经导线流出 B、充电时,每转移1mol电子,两电极的质量变化差值为7g C、充电时,阳极的电极反应式为C-4e-+2Li2CO3 =3CO2↑+4Li+ D、杂化材料中CNTs增多了CO2的吸附位点,可使该电池表现出优异的电化学性能12. 氢氧熔融碳酸盐燃料电池是一种高温电池,具有效率高、无污染、燃料多样、余热利用价值高等优点,电池的工作原理如图所示。下列有关说法正确的是( )
A、放电时,Li电极作电池负极,有电子经导线流出 B、充电时,每转移1mol电子,两电极的质量变化差值为7g C、充电时,阳极的电极反应式为C-4e-+2Li2CO3 =3CO2↑+4Li+ D、杂化材料中CNTs增多了CO2的吸附位点,可使该电池表现出优异的电化学性能12. 氢氧熔融碳酸盐燃料电池是一种高温电池,具有效率高、无污染、燃料多样、余热利用价值高等优点,电池的工作原理如图所示。下列有关说法正确的是( )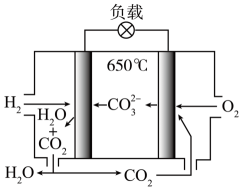 A、该电池在常温下也能正常工作 B、H2通入负极,发生还原反应 C、正极反应式为O2+ 2CO2+4e- =2 D、电池工作时,外电路中流过2 mol电子,消耗22.4L H213. 一种新型电池结构示意图如图,电池由三个不同区域(A、B、C)组成,所用电解质分别为和 , 不同区域由离子交换膜隔开。下列关于该电池的说法错误的是( )
A、该电池在常温下也能正常工作 B、H2通入负极,发生还原反应 C、正极反应式为O2+ 2CO2+4e- =2 D、电池工作时,外电路中流过2 mol电子,消耗22.4L H213. 一种新型电池结构示意图如图,电池由三个不同区域(A、B、C)组成,所用电解质分别为和 , 不同区域由离子交换膜隔开。下列关于该电池的说法错误的是( ) A、为电池的负极,发生氧化反应 B、a为阴离子交换膜,b为阳离子交换膜 C、电极反应: D、电池工作过程中,区域A、B、C溶液分别减小、不变、增大14. 双极膜电渗析法固碳技术是将捕集的CO2转化为CaCO3而矿化封存,其工作原理如图所示。双极膜中间层中的H2O解离成H+和OH- , 并在直流电场作用下分别向两极迁移。下列说法错误的是( )
A、为电池的负极,发生氧化反应 B、a为阴离子交换膜,b为阳离子交换膜 C、电极反应: D、电池工作过程中,区域A、B、C溶液分别减小、不变、增大14. 双极膜电渗析法固碳技术是将捕集的CO2转化为CaCO3而矿化封存,其工作原理如图所示。双极膜中间层中的H2O解离成H+和OH- , 并在直流电场作用下分别向两极迁移。下列说法错误的是( ) A、两个双极膜中间层中的H+均向左侧迁移 B、若碱室中比值增大,则有利于CO2的矿化封存 C、电解一段时间后,酸室中盐酸的浓度增大 D、该技术中电解固碳总反应的离子方程式为:2Ca2++2CO2+4H2O2CaCO3↓+2H2↑+O2↑+4H+15. 某微生物燃料电池在废水处理和新能源开发领域具有广阔的应用前景,其工作原理如图所示。下列说法正确的是( )
A、两个双极膜中间层中的H+均向左侧迁移 B、若碱室中比值增大,则有利于CO2的矿化封存 C、电解一段时间后,酸室中盐酸的浓度增大 D、该技术中电解固碳总反应的离子方程式为:2Ca2++2CO2+4H2O2CaCO3↓+2H2↑+O2↑+4H+15. 某微生物燃料电池在废水处理和新能源开发领域具有广阔的应用前景,其工作原理如图所示。下列说法正确的是( )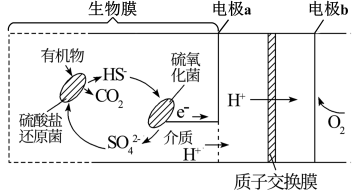 A、电极电势a< b,电极b上发生氧化反应 B、HS-在硫氧化菌作用下发生反应 HS-+ 4H2O- 8e- =+9H+ C、若该电池外电路有0.4 mol电子转移,则 有0.45molH+迁移到b极。 D、该燃料电池在高温下进行效率更高16. 工业上用石墨和铅作电极,用双极膜电解葡萄糖溶液制备甘露醇和葡萄糖酸盐。已知在直流电场作用下,双极膜将水解离为和并实现其定向通过,电解过程如图所示。下列说法错误的是( )
A、电极电势a< b,电极b上发生氧化反应 B、HS-在硫氧化菌作用下发生反应 HS-+ 4H2O- 8e- =+9H+ C、若该电池外电路有0.4 mol电子转移,则 有0.45molH+迁移到b极。 D、该燃料电池在高温下进行效率更高16. 工业上用石墨和铅作电极,用双极膜电解葡萄糖溶液制备甘露醇和葡萄糖酸盐。已知在直流电场作用下,双极膜将水解离为和并实现其定向通过,电解过程如图所示。下列说法错误的是( ) A、b极材料为石墨,接电源正极 B、通电后双极膜中产生的向b极定向移动 C、生成葡萄糖酸盐的反应为:
A、b极材料为石墨,接电源正极 B、通电后双极膜中产生的向b极定向移动 C、生成葡萄糖酸盐的反应为: D、理论上若生成1mol甘露醇,则可生成1mol葡萄糖酸盐
17. 使用三元锂电池新能源电动汽车已经成为趋势。该电池放电时反应为: , 电池工作原理如图所示,两电极之间有一个允许特定离子X通过的隔膜,下列说法错误的是( )
D、理论上若生成1mol甘露醇,则可生成1mol葡萄糖酸盐
17. 使用三元锂电池新能源电动汽车已经成为趋势。该电池放电时反应为: , 电池工作原理如图所示,两电极之间有一个允许特定离子X通过的隔膜,下列说法错误的是( ) A、三元锂电池具有能量密度高、耐低温等优异性能 B、放电时,X离子由A经过隔膜向B移动 C、放电时,每转移0.1mol电子,理论B极质量增加0.7g D、充电时,B极反应为:18. 2022年北京冬奥会,我国使用了“容和一号”大容量电池堆(铁一铬液流电池)来保障冬奥地区持续稳定存储、提供清洁电能。铁一铬液流电池与其他电化学电池相比,寿命远远高于钠硫电池、锂离子电池和铅酸电池。铁一铬液流电池的电解质溶液是含铁盐和铬盐的稀盐酸溶液。下列说法错误的是( )
A、三元锂电池具有能量密度高、耐低温等优异性能 B、放电时,X离子由A经过隔膜向B移动 C、放电时,每转移0.1mol电子,理论B极质量增加0.7g D、充电时,B极反应为:18. 2022年北京冬奥会,我国使用了“容和一号”大容量电池堆(铁一铬液流电池)来保障冬奥地区持续稳定存储、提供清洁电能。铁一铬液流电池与其他电化学电池相比,寿命远远高于钠硫电池、锂离子电池和铅酸电池。铁一铬液流电池的电解质溶液是含铁盐和铬盐的稀盐酸溶液。下列说法错误的是( ) A、该电池可将太阳能发的电稳定存储 B、充电时电池的反应为: C、放电时,电路中每流过0.1mol电子,浓度降低0.1mol/L D、负极每被氧化,电池中有1mol通过交换膜向正极转移
A、该电池可将太阳能发的电稳定存储 B、充电时电池的反应为: C、放电时,电路中每流过0.1mol电子,浓度降低0.1mol/L D、负极每被氧化,电池中有1mol通过交换膜向正极转移二、综合题
-
19. 根据题意回答有关氮的化合物的问题:(1)、随着人类社会的发展,氮氧化物的排放导致一系列问题。NO2形成硝酸型酸雨的化学方程式为。
一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。
已知:①
②
则 =。
(2)、肼(N2H4)可以用作燃料电池的原料。肼的电子式为;一种以液态肼为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。a电极是电极的极(填“正”或“负”),a电极的电极反应式为。 (3)、可逆反应: 。
(3)、可逆反应: 。
①一定温度下,向体积为0.5L的密闭容器中通入2molNO和1.5molO2反应,平衡时NO的转化率为50%,求该温度下反应的平衡常数K=L/mol。
②在某体积恒定的密闭容器中,通入2mol NO和1molO2 , 反应经历相同时间,测得不同温度下NO的转化率如图,则150℃时,v(正)v(逆)(填“”、“”或“”)。
③判断在恒温恒容条件下该反应已达到平衡状态的是(填字母)。
A. B.反应容器中压强不随时间变化而变化
C.混合气体颜色深浅保持不变 D.混合气体质量保持不变
20. 以CO2生产甲醇(CH3OH)是实现“碳中和”的重要途径。其原理是CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。(1)、该反应的能量变化如图所示,该反应为(填“放热”或“吸热”)反应。 (2)、恒容容器中,对于上述反应,下列措施能加快反应速率的是____。A、升高温度 B、充入He C、加入合适的催化剂 D、降低压强(3)、在体积为2L的密闭容器中,充入1molCO2和3molH2 , 测得CO2、CH3OH的物质的量随时间变化如图。反应达到平衡状态,此时H2的转化率为。
(2)、恒容容器中,对于上述反应,下列措施能加快反应速率的是____。A、升高温度 B、充入He C、加入合适的催化剂 D、降低压强(3)、在体积为2L的密闭容器中,充入1molCO2和3molH2 , 测得CO2、CH3OH的物质的量随时间变化如图。反应达到平衡状态,此时H2的转化率为。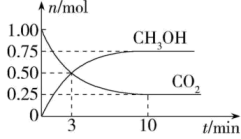 (4)、在相同温度、容积不变的条件下,不能说明该反应已达平衡状态的是____。A、CO2、H2的浓度均不再变化 B、体系压强不变 C、n(CH3OH)∶n(H2O)=1∶1 D、H2的消耗速率与CH3OH的生成速率之比为3∶1(5)、用CH3OH和O2组合形成的质子交换膜燃料电池的结构如图。
(4)、在相同温度、容积不变的条件下,不能说明该反应已达平衡状态的是____。A、CO2、H2的浓度均不再变化 B、体系压强不变 C、n(CH3OH)∶n(H2O)=1∶1 D、H2的消耗速率与CH3OH的生成速率之比为3∶1(5)、用CH3OH和O2组合形成的质子交换膜燃料电池的结构如图。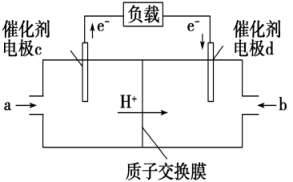
①则电极c是(填“正极”或“负极”),电极d的电极反应式。
②若线路中转移1mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为L。