从巩固到提高 高考化学二轮微专题27 化学反应与能量
试卷更新日期:2023-02-11 类型:二轮复习
一、单选题
-
1. 在一定温度压强下,依据图示关系,下列说法错误的是( )
 A、 B、1mol C(石墨)和1mol C(金刚石)分别与足量反应全部转化为(g),前者放热多 C、 D、化学反应的△H,只与反应体系的始态和终态有关,与反应途径无关2. 一定温度下,向容器中加入A可发生反应如下:①A→B,②A→C,③。反应体系中A、B、C的浓度随时间t的变化曲线如图所示。下列说法正确的是 ( )
A、 B、1mol C(石墨)和1mol C(金刚石)分别与足量反应全部转化为(g),前者放热多 C、 D、化学反应的△H,只与反应体系的始态和终态有关,与反应途径无关2. 一定温度下,向容器中加入A可发生反应如下:①A→B,②A→C,③。反应体系中A、B、C的浓度随时间t的变化曲线如图所示。下列说法正确的是 ( ) A、反应①的活化能大于反应② B、该温度下,反应③的平衡常数大于1 C、时,B的消耗速率小于生成速率 D、升高温度,时体系中B的含量增大3. CO与气体均会造成环境污染,研究表明二者可在表面转化为无害气体,其反应进程及能量变化过程如图所示。下列说法正确的是( )
A、反应①的活化能大于反应② B、该温度下,反应③的平衡常数大于1 C、时,B的消耗速率小于生成速率 D、升高温度,时体系中B的含量增大3. CO与气体均会造成环境污染,研究表明二者可在表面转化为无害气体,其反应进程及能量变化过程如图所示。下列说法正确的是( )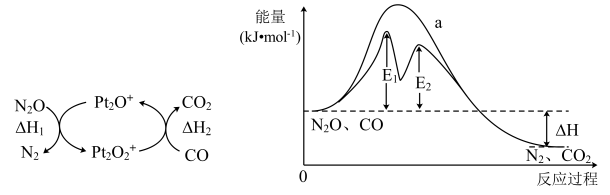 A、使用催化剂可降低反应活化能,但不改变反应历程 B、有催化剂条件下,E1时的反应速率比E2快 C、 D、为中间体、为催化剂4. 一定温度下,的氯化、溴化反应势能图及一段时间后产物的选择性如图,下列叙述错误的是 ( )
A、使用催化剂可降低反应活化能,但不改变反应历程 B、有催化剂条件下,E1时的反应速率比E2快 C、 D、为中间体、为催化剂4. 一定温度下,的氯化、溴化反应势能图及一段时间后产物的选择性如图,下列叙述错误的是 ( ) A、 B、升高温度,体系中n(1-氯丙烷)∶n(2-氯丙烷)的值增大 C、以丙烷为原料合成丙醇时,“先溴代再水解”有利于提高2-丙醇的含量 D、由图可知,丙烷中碳氢键的键能不完全相同5. 环己烷有多种不同构象,其中椅式、半椅式、船式、扭船式较为典型。各构型的相对能量图(位能)如图所示。下列说法正确的是( )
A、 B、升高温度,体系中n(1-氯丙烷)∶n(2-氯丙烷)的值增大 C、以丙烷为原料合成丙醇时,“先溴代再水解”有利于提高2-丙醇的含量 D、由图可知,丙烷中碳氢键的键能不完全相同5. 环己烷有多种不同构象,其中椅式、半椅式、船式、扭船式较为典型。各构型的相对能量图(位能)如图所示。下列说法正确的是( ) A、扭船型最稳定 B、=+39.3kJ/mol C、的标准燃烧热大于 D、相同条件下生成扭船型的速率大于生成船型6. 下列关于如图所示转化关系(X代表卤素),说法正确的是( )
A、扭船型最稳定 B、=+39.3kJ/mol C、的标准燃烧热大于 D、相同条件下生成扭船型的速率大于生成船型6. 下列关于如图所示转化关系(X代表卤素),说法正确的是( )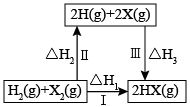 A、 <0 B、生成HX(g)的反应热与途径有关,所以 C、若X分别表示Cl、Br、I,则过程Ⅲ吸收的热量依次增多 D、Cl2(g)、I2(g)分别发生反应Ⅰ,同一温度下的平衡常数分别为K1、K3 , 则K1>K37. ICl与发生的总反应为。该反应分两步完成,第一步:。下列说法正确的是( )A、为总反应的氧化产物 B、ICl水解产物是HI和HClO C、已知键能:H-H>I-I,可推知键能:1-Cl>H-Cl D、第二步反应为
A、 <0 B、生成HX(g)的反应热与途径有关,所以 C、若X分别表示Cl、Br、I,则过程Ⅲ吸收的热量依次增多 D、Cl2(g)、I2(g)分别发生反应Ⅰ,同一温度下的平衡常数分别为K1、K3 , 则K1>K37. ICl与发生的总反应为。该反应分两步完成,第一步:。下列说法正确的是( )A、为总反应的氧化产物 B、ICl水解产物是HI和HClO C、已知键能:H-H>I-I,可推知键能:1-Cl>H-Cl D、第二步反应为二、综合题
-
8. C2H4是现代工业的重要原料,工业上用CO2氧化C2H6制C2H4具有重要意义。
已知:CO2氧化C2H6制C2H4的主反应热化学方程式为:C2H6(g) + CO2(g)=C2H4(g) + CO(g) + H2O(g) ΔH=+177kJ·mol-1
(1)、若主反应的反应历程分为如下两步:I. C2H6(g)=C2H4(g) + H2(g) (快) ΔH1
II. CO2(g) + H2(g)= CO(g) + H2O(g) (慢) ΔH2=+42kJ·mol-1
则:①反应I的ΔH1 = kJ ·mol-1。
②已知:ΔG=ΔH- T·ΔS。当ΔG>0,反应非自发;当ΔG<0,反应自发。若反应I的ΔS=+120J·K-1·mol-1 , 反应I自发进行的最低温度T=K。
③相比于提高c(C2H6) ,提高c(CO2)对主反应总速率影响更大,其原因是。
(2)、某催化剂催化主反应的过程中,在催化剂表面发生了一系列反应:①CH3- CH3→CH3- CH2·+ H++e- ,
②CH3-CH2·→CH2=CH2+H++e- ,
③CO2+e-→ ,
④+ H+→·COOH,
⑤ ,
则:自由基CH3-CH2·的电子式为 ,⑤的反应式为。
(3)、在C2H6与CO2反应制C2H4的过程中,还会发生副反应:C2H6(g)+ 2CO2(g) = 4CO(g)+ 3H2(g) ΔH> 0①其他条件相同时,1mol C2H6与1mol CO2经相同反应时间测得如表实验数据:
实验
温度/K
催化剂
C2H4的产率%
实验1
400
催化剂1
55.0
400
催化剂2
62.3
实验2
500
催化剂1
68.5
500
催化剂2
80.1
在催化剂相同时,温度越高C2H4产率更高的原因是 ; 相同温度时,催化剂2催化下C2H4产率更高的原因是。
②在容器体积为1.0L,充入2 mol C2H6和3 mol CO2同时发生主、副反应,乙烷的平衡转化率、乙烯的选择性与温度、压强的关系如图所示。则:判断P1>P2的理由是 ;M点主反应的平衡常数为(结果保留2 位有效数字)。
 9. 将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一,煤转化为水煤气的主要化学反应为:。C(s)、CO(g)和完全燃烧的热化学方程式分别为:
9. 将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一,煤转化为水煤气的主要化学反应为:。C(s)、CO(g)和完全燃烧的热化学方程式分别为:① ;
② ;
③ 。
试回答:
(1)、请你根据以上数据,写出C(s)与水蒸气反应生成CO和的热化学方程式:。(2)、比较反应热数据可知,和完全燃烧放出的热量之和,比完全燃烧放出的热量(填“多”或“少”)。甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量”。
乙同学根据盖斯定律作出了下列循环图
 (3)、请你写出、、、之间存在的关系式。(4)、乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同。”请分析:甲、乙两同学的观点正确的是(填“甲”或“乙”)同学,另一同学出现不正确观点的原因是。10. CH4-CO2重整反应[CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247kJ/mol]在大力推进生态文明建设、“碳达峰”、“碳中和”的时代背景下,受到更为广泛的关注。(1)、I.该反应以两种温室气体为原料,可以生成合成气。如何减少反应过程中的催化剂积炭,是研究的热点之一、某条件下,发生主反应的同时,还发生了积炭反应:
(3)、请你写出、、、之间存在的关系式。(4)、乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同。”请分析:甲、乙两同学的观点正确的是(填“甲”或“乙”)同学,另一同学出现不正确观点的原因是。10. CH4-CO2重整反应[CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247kJ/mol]在大力推进生态文明建设、“碳达峰”、“碳中和”的时代背景下,受到更为广泛的关注。(1)、I.该反应以两种温室气体为原料,可以生成合成气。如何减少反应过程中的催化剂积炭,是研究的热点之一、某条件下,发生主反应的同时,还发生了积炭反应:CO歧化:2CO(g)=CO2(g)+C(s) △H=-172kJ/mol
CH4裂解:CH4(g)=C(s)+2H2(g) △H=+75kJ/mol
对积炭反应进行计算,得到以下温度和压强对积炭反应中平衡炭量的影响图,其中表示温度和压强对CH4裂解反应中平衡炭量影响的是(选填序号) , 理由是。
 (2)、实验表明,在重整反应中,低温、高压时会有显著积炭产生,由此可推断,对于该重整反应而言,其积炭主要由反应产生。
(2)、实验表明,在重整反应中,低温、高压时会有显著积炭产生,由此可推断,对于该重整反应而言,其积炭主要由反应产生。综合以上分析,为抑制积炭产生,应选用高温、低压条件。
(3)、II.该重整反应也可用于太阳能、核能、高温废热等的储存,储能研究是另一研究热点。该反应可以储能的原因是。
某条件下,除发生主反应外,主要副反应为CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol。研究者研究反应物气体流量、CH4/CO2物质的量比对CH4转化率(XCH4)、储能效率的影响,部分数据如下所示。
(4)、【资料】储能效率:热能转化为化学能的效率,用ηchem表示。ηchem=Qchem/Q。其中,Qchem是通过化学反应吸收的热量,Q是设备的加热功率。序号
加热温度/℃
反应物气体流量/L·min-1
CH4/CO2
XCH4/%
ηchem/%
①
800
4
2:2
79.6
52.2
②
800
6
3:3
64.2
61.9
③
800
6
2:4
81.1
41.6
气体流量越大,CH4转化率越低,原因是:随着流量的提高,反应物预热吸热量增多,体系温度明显降低,。
(5)、对比实验(填序号),可得出结论:CH4/CO2越低,CH4转化率越高。(6)、对比②、③发现,混合气中CO2占比越低,储能效率越高,原因可能是(该条件下设备的加热功率视为不变)。11. 将二氧化碳转化为高附加值碳基燃料可有效减少碳排放。二氧化碳催化加氢制甲醇[CO2(g)+3H2(g)CH3OH(g)+H2O(g)]引起了科学界和工业界的极大兴趣。回答下列问题:(1)、相关的化学键键能数据如表所示。化学键
H—H
C=O
H—O
C—H
C—O
E(kJ/mol)
436
745
465
413
351
写出二氧化碳催化加氢制甲醇的热化学方程式。
(2)、采用真空封管法制备磷化硼纳米颗粒,成功的实现了高选择性电催化还原CO2制备甲醇,该反应历程如图所示。
①该过程容易产生副产物。
②上述合成甲醇的反应速率较慢,要使反应速率加快,需要降低某步骤的能量变化,写出该基元反应的化学方程式:。
(3)、Ⅱ.工业中,CO2和H2在催化剂作用下可发生两个平行反应,分别生成CH3OH和CO。反应a:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1;
反应b:CO2(g)+H2(g)CO(g)+H2O(g) △H2>0。
在传统的催化固定反应床(CFBR)中,CO2转化率和甲醇选择性通常都比较低,科学团队发展了一种具有反应分离双功能的分子筛膜催化反应器(MR)用于CO2催化加氢制备甲醇,极大地改善了该问题,原理如图所示。

保持压强为5MPa,向密闭容器中投入一定量CO2和H2 , 不同反应模式下CO2的平衡转化率和甲醇选择性的相关实验数据如表所示。
实验组
反应模式
压强/MPa
温度/℃
CO2转化率
CH3OH选择性
①
CFBR
3
5
250
25.6
61.3
②
CFBR
3
5
230
20.0
70.0
③
CMR
3
3
260
36.1
100
已知CH3OH选择性:转化的CO2中生成CH3OH的百分比。
CFBR模式时,投料比=3一定温度下发生反应,下列说法能作为反应a达到平衡状态的判据是____(填选项字母)。
A、气体压强不再变化 B、CO的体积分数不再变化 C、气体平均相对分子质量不再变化 D、不再变化 E、CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1(4)、由表中数据可知CMR模式下,CO2的转化率显著提高,结合具体反应分析可能的原因:。(5)、压力平衡常数Kp是指用平衡分压代替平衡浓度进行计算的平衡常数,平衡分压=p总×物质的量分数。根据表中数据计算温度为230℃时,反应a的Kp值为(无需计算,写表达式)。12. 根据题意回答有关氮的化合物的问题:(1)、随着人类社会的发展,氮氧化物的排放导致一系列问题。NO2形成硝酸型酸雨的化学方程式为。一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。
已知:①
②
则 =。
(2)、肼(N2H4)可以用作燃料电池的原料。肼的电子式为;一种以液态肼为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。a电极是电极的极(填“正”或“负”),a电极的电极反应式为。 (3)、可逆反应: 。
(3)、可逆反应: 。
①一定温度下,向体积为0.5L的密闭容器中通入2molNO和1.5molO2反应,平衡时NO的转化率为50%,求该温度下反应的平衡常数K=L/mol。
②在某体积恒定的密闭容器中,通入2mol NO和1molO2 , 反应经历相同时间,测得不同温度下NO的转化率如图,则150℃时,v(正)v(逆)(填“”、“”或“”)。
③判断在恒温恒容条件下该反应已达到平衡状态的是(填字母)。
A. B.反应容器中压强不随时间变化而变化
C.混合气体颜色深浅保持不变 D.混合气体质量保持不变
13. 二氧化碳的排放越来越受到能源和环境领域的关注,其综合利用是目前研究的重要课题之一、回答下列问题:(1)、已知下列反应的正反应活化能(E1)逆反应活化能(E2)如表所示:序号
化学反应
E1/(kJ·mol-1)
E2/(kJ·mol-1)
①
H2(g)+ O2(g)=H2O(1)
685
970
②
2CH3OH(1) + 3O2(g)=2CO2 (g) +4H2O (1)
3526
4978
CO2与H2合成液态甲醇的热化学方程式为。
(2)、一定温度下,在2L密闭容器中充入3 mol CO2和 6 mol H2 , 发生反应:CO2(g)+ 3H2(g) CH3OH(g) + H2O(g),测定H2的转化率[α(H2) ]随时间的变化如图所示:
①0~ 20 min内,用CH3OH的浓度变化表示的平均 反应速率:v(CH3OH)= mol·L-1·min-1。
②该温度下,反应的平衡常数K= (结果保 留两位小数)。
③若在上述平衡状态下,再向容器中充入1mol CO2和1molH2O(g),则反应速率 v(正)v(逆) (填“>”“< “或“= “)。
(3)、科学家提出利用CO2与CH4制备合成气: CO2(g) +CH4(g) 2CO(g)+ 2H2(g)。在体积均为2L的密闭容器甲和乙中,分别充入1 molCO2和1 mol CH4、2 mol CO2和2 mol CH4 , 在相同温度下达到平衡状态时,CO2的转化率:α(甲)α(乙)(填“>”“<“或“=” ,下同),达到平衡所需的时间: t(甲) t(乙)。 (4)、如图是利用太阳能电池电解C2H6分别转化成其它含碳化合物的原理示意图,碳电极上生成CO的电极反应式。若起始投入0.3mol C2H6全部反应完全,生成三种产物中C2H4的物质的量为0.1mol,则电路中转移的电子数目为。
(4)、如图是利用太阳能电池电解C2H6分别转化成其它含碳化合物的原理示意图,碳电极上生成CO的电极反应式。若起始投入0.3mol C2H6全部反应完全,生成三种产物中C2H4的物质的量为0.1mol,则电路中转移的电子数目为。 14. 工业合成氨反应具有非常重要的意义。(1)、已知:
14. 工业合成氨反应具有非常重要的意义。(1)、已知:则合成氨反应的热化学方程式为。
(2)、在某容积为2L的恒容容器中发生合成氨反应,体系中各物质浓度随时间变化的曲线如图所示:
前20min内 , 放出的热量为 , 25min时采取的措施是。
(3)、对可逆反应 , 若起始投料、 , 达到平衡后,增大压强,的体积分数(填“增大”“减小”或“不变”)(4)、T℃,以和为原料可合成化肥尿素:;在2L的密闭容器中,通入1.2mol和0.6mol , 2min时反应刚好达到平衡。此时, , 。①该反应的平衡常数是。
②若2min时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入0.6mol , 则此时平衡(填“正向移动”“逆向移动”或“不移动”)
15. 硫酸是化学工业当中最基本也是最重要的化工原料之一,硫酸的产量是衡量一个国家化工水平的标志。请回答:(1)、工业上大规模制备浓硫酸一般采用硫铁矿或硫磺粉为原料。①298K,101kPa下,下列反应
则反应能自发进行的条件是。
②两种方法在制备工艺上各有其优缺点,下列选项正确的是(可多选)。
A.在制备阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫磺粉法复杂得多
B.两种方法产生的气体都不需要干燥
C.在转化为阶段,控制温度在500℃左右的主要原因是为了提高反应速率和平衡转化率
D.将原料粉碎后送入沸腾炉中,可以提高原料的利用率
(2)、对于反应①某温度下,假设进入接触室内的物质的量恒定。当和的物质的量比为1∶1,反应达到平衡时压强减少1/5;保持温度不变欲使的平衡转化率提高到90%,则和的物质的量比为应为(计算结果保留1位小数)。
②催化氧化的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:
步骤Ⅰ:
步骤Ⅱ:。
步骤Ⅲ:
(3)、能溶于液态中,并存在如下两个平衡(未配平)当稀释时,的值(增大、减小或不变),理由是。
16. 羰基硫(COS)作为一种粮食熏蒸剂广泛应用于农药工业。利用工厂废气中的H2S和CO反应可以合成COS,回答下列问题:(1)、已知:①2H2(g)+O2(g)= 2H2O(g) ΔH1= -484 kJ· mol-1
②COS(g)+ H2O(g)⇌H2S(g)+CO2(g) ΔH2= -36kJ·mol-1
③CO的燃烧热为283 kJ·mol-1
反应CO(g)+ H2S(g)⇌COS(g)+ H2(g)的 ΔH= kJ·mol-1。
(2)、以FeOOH作催化剂,由H2S和CO合成COS的反应分两步进行。下列示意图能正确体现上述反应能量变化的是(填“甲”或“乙”)。+

关于该反应的下列叙述正确的是(填标号)。
A.步骤①是慢反应,活化能较大
B.总反应的速率由步骤②决定
C.反应进程中S2属于中间产物
D.更换催化剂可改变E和ΔH
(3)、240℃时,反应CO(g)+H2S(g)⇌COS(g)+H2(g)的平衡常数K=1。在密闭容器中充入等物质的量的CO和H2S发生上述反应,达平衡时测得CO的物质的量为4 mol,则H2S的转化率为 ,COS 的体积分数为。 在240℃下, 要同时提高CO和H2S的转化率,可采取的措施是。(4)、在两个密闭容器中都加入CO、H2S、COS、H2四种气体,起始时气体体积分数φ(CO)= φ(H2S),φ(COS)=p(H2),分别在300℃和320℃时反应,容器中H2S(g)和COS(g)的体积分数(φ)随时间(t) 的变化关系如图所示。+

300℃和320℃时,φ(H2S)随时间变化关系的曲线分别是、 , 判断的理由是。
17. 研究CO与H2反应制备二甲醚(CH3OCH3),既可减少碳排放,又可变废为宝。回答下列问题:(1)、已知CO与H2反应制备二甲醚的总反应为:2CO (g) +4H2(g)⇌CH3OCH3(g) +H2O (g),该反应经历以下两个中间反应:i:CO (g) + 2H2(g)⇌CH3OH (g) ΔH1=- 90. 1KJ/ mol
ii:2CH3OH (g)⇌CH3OCH3(g)+ H2O(g) ΔH2=- 24.5KJ/mol
则总反应的ΔH= ; 若反应过程中能量变化如图所示,则总反应速率主要由反应 (选填“i ”或“ii”)决定。
 (2)、下列措施既能加快总反应速率,又能提高CO转化率的是。
(2)、下列措施既能加快总反应速率,又能提高CO转化率的是。a.升高温度 b.增大压强 c.使用合适催化剂 d.及时分离二甲醚
(3)、当起始物=2时,在100℃、200℃、300℃时,总反应中CO的平衡转化率(α)随压强变化关系如图所示, 则:
①反应在100℃,5. 0 ×105Pa时,CO的平衡转化率α= , 判断依据是 , 该条件下的平衡体系中二甲醚的体积分数约为 %(保 留小数点后一位)。
②一定温度下,同一反应用平衡浓度表示的平衡常数Kc和用平衡分压表示的平衡常数Kp间存在定量关系,可以借助公式pV= nRT进行推导(其中T为体系温度;p为气体压强;V为气体体积;n为气体物质的量;R为常数)。则当体系温度为T时,总反应Kc与Kp的关系为Kc=Kp(用含 R、T的式子表示)。
18. 碳排放问题是第26届联合国气候变化大会讨论的焦点。我国向国际社会承诺2030年“碳达峰”,2060年实现“碳中和”。为了实现这个目标,加强了对CO2转化的研究。下面是CO2转化为高附加值化学品的反应。相关反应的热化学方程式如下:反应Ⅰ:CO2(g)+H2(g)H2O(g)+CO(g) △H1
反应Ⅱ:CO(g)+2H2(g)CH3OH(g) △H2=-90.0kJ·mol-1
反应Ⅲ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3=-49.0kJ·mol-1
反应Ⅳ:CO2(g)+4H2(g)CH4(g)+2H2O(g) △H4=-165.0kJ·mol-1
反应Ⅴ:2CO2g)+6H2(g)C2H4(g)+4H2O(g) △H5=-122.7kJ·mol-1
回答下列问题:
(1)、反应Ⅲ一般认为通过反应Ⅰ、Ⅱ来实现,则反应Ⅰ的△H1=kJ·mol-1;已知:由实验测得反应Ⅰ的v正=k正c(CO2)·c(H2),v逆=k逆·c(H2O)·c(CO)(k正、k逆为速率常数,与温度、催化剂有关)。若平衡后升高温度,则=(填“增大”、“不变”或“减小”)。(2)、在2L恒容密闭容器中充入总物质的量为8mol的CO2和H2发生反应Ⅲ,改变氢碳比 , 在不同温度下反应达到平衡状态,测得的实验数据如表:温度/K
CO2转化率
500
600
700
800
1
45
33
20
12
2
60
43
28
15
3
83
62
40
22
①下列说法中正确的是(填英文字母)。
A.增大氢碳比,平衡正向移动,平衡常数增大
B.v(CH3OH)=v(CO2)时,反应达到平衡
C.当混合气体平均摩尔质量不变时,达到平衡
D.当混合气体密度不变时,达到平衡
②在700K、氢碳比为3.0的条件下,某时刻测得容器内CO2、H2、CH3OH、H2O的物质的量分别为2mol、2mol、1mol和1mol,则此时正反应速率和逆反应速率的关系是(填英文字母)。
A.v(正)>v(逆) B.v(正)<v(逆) C.(正)=r(逆) D.无法判断
(3)、CO2在一定条件下催化加氢生成CH3OH,主要发生三个竞争反应(即反应Ⅲ、Ⅳ、Ⅴ),为分析催化剂对反应的选择性,在1L恒容密闭容器中充入2.0molCO2和5.3molH2 , 测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示:
①该催化剂在较低温度时主要选择反应(“Ⅲ”或“Ⅳ”或“Ⅴ”)。研究发现,若温度过高,三种含碳产物的物质的量会迅速降低,其主要原因可能是:。
②在一定温度下达到平衡,此时测得容器中部分物质的含量为:n(CH4)=0.1mol,n(C2H4)=0.4mol,n(CH3OH)=0.5mol。则该温度下反应Ⅲ的平衡常数K(Ⅲ)=L2/mol2(保留两位小数)。
(4)、常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。欲用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3 , 则所用的Na2CO3溶液的物质的量浓度至少为mol/L(已知:常温下Ksp(BaSO4)=1×10-11 , Ksp(BaCO3)=1×10-10。忽略溶液体积的变化,保留两位有效数字)。(5)、研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示。温度小于900℃时进行电解反应,碳酸钙先分解为CaO和CO2 , 电解质为熔融碳酸钠,阳极的电极反应式为2CO-4e-=2CO2↑+O2↑,则阴极的电极反应式为。 19. 目前人工固氨和二氧化碳利用技术,对人类生存、社会进步和经济发展都有着重大意义。(1)、Ⅰ.目前研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,其总反应可表示为。
19. 目前人工固氨和二氧化碳利用技术,对人类生存、社会进步和经济发展都有着重大意义。(1)、Ⅰ.目前研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,其总反应可表示为。该反应能自发的条件是(填“低温”或“高温”)。
(2)、二氧化碳催化加氢制甲醇合成总反应在起始物时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃时x(CH3OH)随压强(p)的变化及在时x(CH3OH)随温度(t)的变化,如图所示。
①图中对应等温过程的曲线是(填“a”或“b”),判断的理由是。
②t=250℃时,当x(CH3OH)=0.10时,的平衡转化率 , (保留小数点后一位)此条件下该反应的Kp=。(保留小数点后两位)(对于气相反应,可以用分压表示,分压=总压×物质的量分数)。
(3)、研究表明,在电解质水溶液中,电池中的气体可被还原,在(填“正”或“负”)极发生电化学反应,而在碱性介质中被还原为正丙醇(CH3CH2CH2OH),其电极反应方程式为。(4)、Ⅱ.目前工业上利用氮气和氢气催化合成氨是人工固氮的主要手段。合成氨的反应历程和能量变化如图所示。请回答下列问题:
合成氨反应的热化学方程式为。
(5)、对总反应速率影响较大的步骤的能垒(活化能)为kJ,该步骤的化学方程式为。三、实验探究题
-
20. 绿水青山和金山银山绝不是对立的,关键在人,关键在思路。消除NOx、CO、SO2等大气污染物对建设美丽环境具有重要意义。(1)、工业上常用氨水吸收法处理尾气中的SO2 , 已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+2NH3·H2O(aq)=(NH4)2SO3(aq)+H2O(l) △H1
②(NH4)2SO3(aq)+SO2(g)+H2O(l)=2NH4HSO3(aq) △H2
③2NH4HSO3(aq)+2NH3·H2O+O2(g)=2(NH4)2SO4(aq)+2H2O(l) △H3
则2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=。
(2)、工业上可将SO2和NO2混合转化,反应为SO2(g)+NO2(g)SO3(g)+NO(g) △H<0,进而制取硫酸。欲使该反应的速率增大且平衡逆向移动,改变的反应条件为。一定温度下,能判断该反应已达到化学平衡状态的是(填字母)。A.SO3和NO的浓度比保持不变
B.混合气体的颜色保持不变
C.容器中压强不再变化
D.恒容混合气体的密度保持不变
(3)、NO和NO2尾气可用碱液吸收,生成的可用电化学原理降解,原理如图所示,则阴极为(填a或b),电极反应式为。 (4)、利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g)N2(g)+2CO2(g) △H<0。实验测得v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2),k正、k逆为速率常数,只与温度有关。
(4)、利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g)N2(g)+2CO2(g) △H<0。实验测得v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2),k正、k逆为速率常数,只与温度有关。①达到平衡后,仅升高温度,k正增大的倍数(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,总压为a,在一定温度下达到平衡时,CO的转化率为50%,则=;在t1min时再向容器内加入1molCO和1molNO,保持温度不变,则再次达平衡时NO的转化率(填“增大”“减小”或“不变”)。整个过程中容器中的气压(P)与反应时间(t)的关系曲线如图所示,则用平衡分压代替平衡浓度表示的压强平衡常数Kp=。
