广西钦州市2022-2023学年高二上学期期末考试化学试题
试卷更新日期:2023-02-10 类型:期末考试
一、单选题
-
1. 下列说法正确的是A、100℃水的离子积是 B、中性水溶液中的 C、纯水在100℃时, mol·L , 所以此时纯水中 D、pH<7的溶液一定是酸溶液2. 下列变化不符合图示的是
 A、分解制 B、钠与水反应 C、二氧化碳与灼热的木炭反应 D、和的反应3. 将用导线连接的电极X、Y插入装有硫酸铜溶液的烧杯中(外电路中电子流向如图所示)。据此判断下列说法正确的是
A、分解制 B、钠与水反应 C、二氧化碳与灼热的木炭反应 D、和的反应3. 将用导线连接的电极X、Y插入装有硫酸铜溶液的烧杯中(外电路中电子流向如图所示)。据此判断下列说法正确的是 A、外电路中电流方向为X→Y B、若电极材料分别为锌片和铜片,则Y为锌片 C、X极上发生还原反应 D、若电极材料都是金属,则金属活动性:X>Y4. 下列描述中,不符合生产实际的是( )A、电解熔融的氧化铝制取金属铝 B、在镀件上电镀锌,用锌作阳极 C、电解法精炼粗铜,用纯铜作阳极 D、电解饱和食盐水制烧碱,阳极室产生氯气5. 一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
A、外电路中电流方向为X→Y B、若电极材料分别为锌片和铜片,则Y为锌片 C、X极上发生还原反应 D、若电极材料都是金属,则金属活动性:X>Y4. 下列描述中,不符合生产实际的是( )A、电解熔融的氧化铝制取金属铝 B、在镀件上电镀锌,用锌作阳极 C、电解法精炼粗铜,用纯铜作阳极 D、电解饱和食盐水制烧碱,阳极室产生氯气5. 一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)
 2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是A、平衡前,随着反应的进行,容器内压强始终不变 B、平衡时,其他条件不变,分离出硫,正反应速率加快 C、平衡时,其他条件不变,升高温度可提高SO2的转化率 D、其他条件不变,使用不同催化剂,该反应平衡常数不变6. 下列轨道表示式中能正确表示基态原子的核外电子排布的是A、
2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是A、平衡前,随着反应的进行,容器内压强始终不变 B、平衡时,其他条件不变,分离出硫,正反应速率加快 C、平衡时,其他条件不变,升高温度可提高SO2的转化率 D、其他条件不变,使用不同催化剂,该反应平衡常数不变6. 下列轨道表示式中能正确表示基态原子的核外电子排布的是A、 B、
B、 C、
C、 D、
D、 7. 水的电离平衡曲线如图所示,下列说法错误的是
7. 水的电离平衡曲线如图所示,下列说法错误的是 A、图中五点间的关系:B>C>A=D=E B、若从A点到达C点,可采用的方法:温度不变在水中加少量NaCl固体 C、向E点对应的醋酸钠溶液中滴加HCl溶液至A点,此时 D、若处在B点时,将pH=2的硫酸溶液与pH=10的KOH溶液等体积混合后,溶液显中性8. 已知下列反应的平衡常数:① , ;② , ;则反应的平衡常数是A、 B、 C、 D、9. 25℃时,等物质的量浓度的下列三种溶液:①HCl溶液②溶液③溶液,其中水的电离程度按由大到小顺序排列的一组是A、②>①>③ B、③>②>① C、①=③<② D、②>③>①10. 某短周期元素R的各级电离能数据(用、……表示,单位为kJ·mol)如表所示。关于元素R的判断中正确的是
A、图中五点间的关系:B>C>A=D=E B、若从A点到达C点,可采用的方法:温度不变在水中加少量NaCl固体 C、向E点对应的醋酸钠溶液中滴加HCl溶液至A点,此时 D、若处在B点时,将pH=2的硫酸溶液与pH=10的KOH溶液等体积混合后,溶液显中性8. 已知下列反应的平衡常数:① , ;② , ;则反应的平衡常数是A、 B、 C、 D、9. 25℃时,等物质的量浓度的下列三种溶液:①HCl溶液②溶液③溶液,其中水的电离程度按由大到小顺序排列的一组是A、②>①>③ B、③>②>① C、①=③<② D、②>③>①10. 某短周期元素R的各级电离能数据(用、……表示,单位为kJ·mol)如表所示。关于元素R的判断中正确的是电离能
R
740
1500
7700
10500
A、R元素基态原子的价电子排布式为 B、R的最高正价为+2价 C、R元素可能属于非金属元素 D、R元素位于元素周期表中第ⅠA族11. 如图,拴上金属条的铁钉插在含有酚酞的 NaCl 溶液中,可以看到在贴近金属条一边的 溶液出现粉红色。该金属条可能是 A、铜 B、铁 C、铝 D、锌12. NH4Al(SO4)2(俗名铵明矾)是食品加工中最为快捷的食品添加剂,常用于焙烤食品中;NH4Al(SO4)2在分析试剂、医药、电子工业中用途广泛。下列有关叙述错误的是A、NH4Al(SO4)2可做净水剂,其理由是Al3+水解生成的Al(OH)3胶体具有吸附性 B、相同条件下,0.1mol·L-1NH4Al(SO4)2中c(NH)小于0.1mol·L-1NH4HSO4中c(N) C、NH4Al(SO4)2溶液中加入盐酸抑制水解,酸性减弱 D、20℃时0.1mol·L-1NH4Al(SO4)2溶液的pH为3,则溶液中2c(SO)-c(NH)-3c(Al3+)≈10-3mol·L-113. 将0.05 mol·L的KI溶液和0.2 mol·L的溶液等体积混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡的是
A、铜 B、铁 C、铝 D、锌12. NH4Al(SO4)2(俗名铵明矾)是食品加工中最为快捷的食品添加剂,常用于焙烤食品中;NH4Al(SO4)2在分析试剂、医药、电子工业中用途广泛。下列有关叙述错误的是A、NH4Al(SO4)2可做净水剂,其理由是Al3+水解生成的Al(OH)3胶体具有吸附性 B、相同条件下,0.1mol·L-1NH4Al(SO4)2中c(NH)小于0.1mol·L-1NH4HSO4中c(N) C、NH4Al(SO4)2溶液中加入盐酸抑制水解,酸性减弱 D、20℃时0.1mol·L-1NH4Al(SO4)2溶液的pH为3,则溶液中2c(SO)-c(NH)-3c(Al3+)≈10-3mol·L-113. 将0.05 mol·L的KI溶液和0.2 mol·L的溶液等体积混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡的是实验编号
实验操作
实验现象
①
滴入KSCN溶液
溶液变红色
②
滴入溶液
有黄色沉淀生成
③
滴入溶液
有蓝色沉淀生成
④
滴入淀粉溶液
溶液变蓝色
A、① B、② C、③④ D、①②14. 已知: , 一定条件下与0.3molY(g)在体积为1L的密闭容器中发生反应,则下列图示中肯定合理的是A、 B、
B、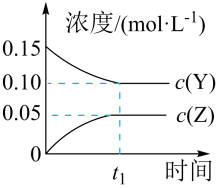 C、
C、 D、
D、
二、填空题
-
15. 氢能的优点是燃烧热值高,无污染。目前工业制氢气的一个重要反应为 △H,反应的能量关系如图所示:
 (1)、 △H0(填“>”“<”或“=”)。(2)、过程Ⅱ是加入催化剂后的反应过程,则过程Ⅰ和Ⅱ的反应热(填“相等”或“不相等”),过程Ⅱ活化能kJ/mol。(3)、已知: kJ·mol
(1)、 △H0(填“>”“<”或“=”)。(2)、过程Ⅱ是加入催化剂后的反应过程,则过程Ⅰ和Ⅱ的反应热(填“相等”或“不相等”),过程Ⅱ活化能kJ/mol。(3)、已知: kJ·molkJ·mol
则H2(g)燃烧生成H2O(l)的热化学方程式为。
(4)、向1 L 1 mol·L的NaOH溶液中分别加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应△H1、△H2、△H3的由小到大的顺序为。16. 按要求回答下列问题:(1)、研究发现,在低压合成甲醇反应()中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布式为。在上述反应中,非金属元素的电负性最大的是 , 在周期表中Mn属于区元素。(2)、我国科学家成功合成了世界上首个五氮阴离子盐。①氮原子的价电子轨道表示式为。
②元素的基态气志原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能()。第二周期部分元素的变化趋势如图所示。氮元素的()呈现异常的原因是。
 (3)、已知As元素的相关信息如图所示,下列说法错误的是____。
(3)、已知As元素的相关信息如图所示,下列说法错误的是____。 A、推测As能形成多种氧化物 B、热稳定性:、、HCl逐渐增强 C、As的一种核素表示为,中子数为40 D、原子半径由大到小的顺序:As、Cl、Si17. 回答下列问题(1)、实验室用30%左右的硫酸溶液(约3.7 mol/L)与锌粒反应制取氢气。下列措施中能加快反应速率的是____。A、降低反应温度 B、将锌粒改为锌粉 C、将所用硫酸加水稀释 D、加入少量的硫酸铜溶液(2)、目前工业上可用来生产燃料甲醇,有关反应为:。现向体积为1 L的密闭容器中,充入1mol 和3 mol , 反应过程中测得和的浓度随时间的变化如图所示。
A、推测As能形成多种氧化物 B、热稳定性:、、HCl逐渐增强 C、As的一种核素表示为,中子数为40 D、原子半径由大到小的顺序:As、Cl、Si17. 回答下列问题(1)、实验室用30%左右的硫酸溶液(约3.7 mol/L)与锌粒反应制取氢气。下列措施中能加快反应速率的是____。A、降低反应温度 B、将锌粒改为锌粉 C、将所用硫酸加水稀释 D、加入少量的硫酸铜溶液(2)、目前工业上可用来生产燃料甲醇,有关反应为:。现向体积为1 L的密闭容器中,充入1mol 和3 mol , 反应过程中测得和的浓度随时间的变化如图所示。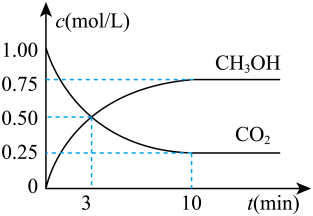
①计算3 min内用氢气表示的该反应的反应速率;3 min时,正反应速率逆反应速率(填“>”“=”或“<”)。
②10 min反应达平衡,氢气的转化率为。当反应达平衡后,维持温度和压强不变,改变其它条件使反应速率增大,采取的措施(写一条即可)
(3)、电池的发明和应用是化学家们对人类社会的重要贡献之一。每一次化学电池技术的突破,都带来了电子设备革命性的发展。最近,我国在甲烷燃料电池的相关技术上获得了新突破,原理如下图所示。
①甲烷进口为极(左图),Pt(b)电极发生反应(填“氧化”或“还原”)。
②以石墨做电极电解饱和食盐水(滴有酚酞),如图所示。电解开始后在的周围(填“阴极”或“阳极”)先出现红色。该极的电极反应式为。
18. 探究化学反应的快慢和限度具有十分重要的意义。(1)、Ⅰ.某实验小组欲通过用酸性和(草酸)反应测定单位时间内生成的体积,探究影响反应速率的因素。设计的实验方案如下(溶液已酸化),实验装置如图甲所示:
实验序号
A溶液
B溶液
①
20 mL 0.01 mol·L 溶液
30 mL 0.01 mol·L 溶液
②
20 mL 0.01 mol·L 溶液
30 mL 0.01 mol·L 溶液
完成上述反应的离子方程式为: , 该实验是探究对反应速率的影响。
(2)、若实验①在2 min末收集了4.48 mL (标准状况下,则在2 min末mol/L(假设混合溶液的体积为50 mL,反应前后体积变化忽略不计)。(3)、小组同学发现反应速率变化如图乙,其中时间内速率变快的主要原因可能是①该反应是放热反应:②。 (4)、Ⅱ.溶液中存在平衡:(橙色)(黄色)。该溶液具有强氧化性。其还原产物在水溶液中呈绿色或蓝绿色。用溶液进行下列实验:
(4)、Ⅱ.溶液中存在平衡:(橙色)(黄色)。该溶液具有强氧化性。其还原产物在水溶液中呈绿色或蓝绿色。用溶液进行下列实验: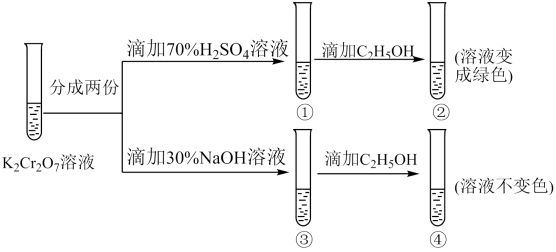
向溶液中加入30%NaOH溶液。溶液呈色:向溶液中逐滴加入溶液(已知为黄色沉淀),则平衡向着方向移动,溶液颜色变化为。