广东省茂名市电白区2022-2023学年高二上学期期末考试化学(选择性考试)试题
试卷更新日期:2023-02-10 类型:期末考试
一、单选题
-
1. 化学与生产、生活、社会密切相关。下列有关说法中,错误的是A、汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土 B、我国西周时期发明的“酒曲”酿酒工艺,是利用了催化剂使平衡正向移动的原理 C、电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法 D、利用太阳能、风能和氢能等能源替代化石能源有利于实现“低碳经济”2. 锑的相关信息如图所示,下列说法正确的是
元素符号:Sb
原子序数:51
相对原子质量:121.8
价电子排布式:5s25p3
A、Sb元素的质量数是121.8 B、Sb元素位于第五周期第VA族 C、Bi原子的5p能级上有1个未成对电子 D、Bi原子最外层有5个能量相同的电子3. 我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”也有科学道理。那么这种做法的化学原理是A、胶体的电泳 B、血液的氧化还原反应 C、胶体的聚沉 D、血液中发生复分解反应4. 下列关于元素第一电离能的说法错误的是A、钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 B、因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大 C、最外层电子排布为ns2np6(当只有K层时为1s2)的原子,第一电离能较大 D、对于同一元素而言,原子的电离能I1<I2<I3……5. 下列反应的发生与“盐类水解平衡”或“难溶电解质的溶解平衡”无关的是A、镁条与NH4Cl溶液反应生成H2 B、明矾用于净水 C、盐酸与CaCO3反应生成CO2 D、NaHSO4溶液与NaOH溶液反应生成Na2SO46. 如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( ) A、A是Zn,B是Cu,C为稀硫酸 B、A是Cu,B是Zn,C为稀硫酸 C、A是Cu,B是Fe,C为硝酸铜溶液 D、A是Fe,B是Ag,C为稀AgNO3溶液7. 下列人们在生活、生产、实验的相关措施中,不是用来调控化学反应速率的是( )A、将食物存放在温度较低的地方 B、将氯化铁固体溶于较浓盐酸配制氯化铁溶液 C、将固体试剂溶于水配成溶液后再进行化学实验 D、通常将颗粒状的固体药品研细混匀后进行反应8. 下列实验能达到目的的是
A、A是Zn,B是Cu,C为稀硫酸 B、A是Cu,B是Zn,C为稀硫酸 C、A是Cu,B是Fe,C为硝酸铜溶液 D、A是Fe,B是Ag,C为稀AgNO3溶液7. 下列人们在生活、生产、实验的相关措施中,不是用来调控化学反应速率的是( )A、将食物存放在温度较低的地方 B、将氯化铁固体溶于较浓盐酸配制氯化铁溶液 C、将固体试剂溶于水配成溶液后再进行化学实验 D、通常将颗粒状的固体药品研细混匀后进行反应8. 下列实验能达到目的的是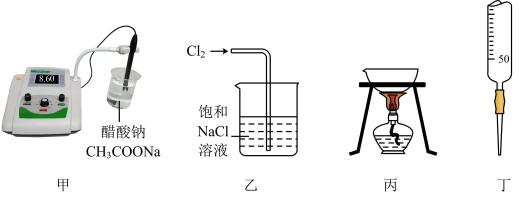 A、装置甲证明醋酸为弱酸 B、装置乙处理Cl2尾气 C、装置丙除去乙醇中少量的水 D、装置丁准确量取一定体积的酸性KMnO4标准溶液9. 在空气中直接蒸发下列盐的溶液:①Fe2(SO4)3、②Na2CO3、③KCl、④AlCl3、⑤NaHCO3可以得到相应盐的晶体(可以含有结晶水)的是A、①②③ B、①③⑤ C、②④ D、①③④⑤10. 相同材质的铁在图中的四种情况下腐蚀最快的是( )A、
A、装置甲证明醋酸为弱酸 B、装置乙处理Cl2尾气 C、装置丙除去乙醇中少量的水 D、装置丁准确量取一定体积的酸性KMnO4标准溶液9. 在空气中直接蒸发下列盐的溶液:①Fe2(SO4)3、②Na2CO3、③KCl、④AlCl3、⑤NaHCO3可以得到相应盐的晶体(可以含有结晶水)的是A、①②③ B、①③⑤ C、②④ D、①③④⑤10. 相同材质的铁在图中的四种情况下腐蚀最快的是( )A、 B、
B、 C、
C、 D、
D、 11. 下列实验操作对应的现象与结论均正确的是
11. 下列实验操作对应的现象与结论均正确的是选项
实验操作
现象
结论
A
常温下将Ba(OH)2•8H2O晶体与NH4Cl晶体在小烧杯中混合
烧杯壁变凉
该反应是吸热反应
B
将充有NO2的密闭烧瓶放入热水中
烧瓶内气体颜色变深
NO2生成N2O4的反应中,△H>0
C
将0.1mol/L的弱酸HA稀释成0.01mol/L,测量稀释前后溶液pH
pH增大
稀释后HA电离程度减小
D
常温下向物质的量浓度均为0.1mol/L的NaCl和NaI混合溶液中逐滴滴入AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)<Ksp(AgI)
A、A B、B C、C D、D12. “氮的固定”是将空气中游离态的氮转化为含氮化合物的过程,对保障人类生存具有重大意义。一种新型合成氨的原理如图所示: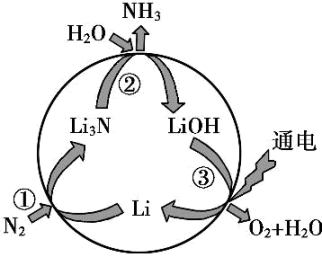
下列说法正确的是( )
A、过程①中每吸收2.24 L氮气转移0.3 mol电子 B、过程②每生成1 mol氨,有1 mol Li3N被氧化 C、过程③化学能转化为了电能 D、图中所示过程的总反应方程式为:2N2 + 6H2O4NH3 +3O213. 一种可充电电池放电时的电极反应为H2-2e-+2OH-=2H2O,NiO(OH)+H2O+e-=Ni(OH)2+OH-。当电池充电时,与外接电源负极相连的电极上发生的反应是( )A、H2被氧化 B、H2O被还原 C、Ni(OH)2被氧化 D、NiO(OH)被还原14. 20℃时向 20mL 0.1mol·L-1 醋酸溶液中不断滴入0.1mol·L-1 NaOH 溶液,溶液 pH 变化如图所示。此过程中溶液中离子浓度的关系错误的是( ) A、a 点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) B、b 点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) C、c 点:c(H+)=c(CH3COO-)+c(OH-) D、d 点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)15. 下列有关合理用药的说法中正确的是A、长期服用阿司匹林可预防某些疾病,没有副作用 B、每日早、中、晚三次与每隔8小时一次,服药效果相同 C、一次忘记服药,下次可以增加一倍剂量服用 D、非处方药的包装上印有“OIC”标识16. 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
A、a 点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) B、b 点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) C、c 点:c(H+)=c(CH3COO-)+c(OH-) D、d 点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)15. 下列有关合理用药的说法中正确的是A、长期服用阿司匹林可预防某些疾病,没有副作用 B、每日早、中、晚三次与每隔8小时一次,服药效果相同 C、一次忘记服药,下次可以增加一倍剂量服用 D、非处方药的包装上印有“OIC”标识16. 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是 A、图中a和b分别为T1、T2温度下CdS在水中的溶解度 B、图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q) C、向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 D、温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
A、图中a和b分别为T1、T2温度下CdS在水中的溶解度 B、图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q) C、向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 D、温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动二、填空题
-
17. 完成下列填空。(1)、某元素气态氢化物溶于水后溶液显碱性,其元素符号为;其轨道表示式为。(2)、B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 , C+的结构示意图为。(3)、某元素的原子最外层电子排布式为nsnnpn+2 , 则n=;该元素符号为。(4)、某元素的正三价离子的3d能级为半充满,D的元素符号为 , 其基态原子的电子排布式为。(5)、某元素基态原子的M层全充满,N层没有成对电子且只有一个未成对电子,其元素符号为 , 该元素分布在区。18. 利用图,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题:
 (1)、丙的化学式为;丁属于(“酸性”或“碱性”)氧化物。(2)、图中甲、乙、丁、戊中,属于电解质的是(填化学式);根据氯元素的化合价判断,乙物质的性质(填标号)。
(1)、丙的化学式为;丁属于(“酸性”或“碱性”)氧化物。(2)、图中甲、乙、丁、戊中,属于电解质的是(填化学式);根据氯元素的化合价判断,乙物质的性质(填标号)。a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性
(3)、物质己的化学式为HClO4 , 电解甲溶液制备己的化学反应为:甲+H2O己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是。(4)、庚是家庭中常用消毒液的有效成分NaClO,用乙制取庚的化学方程式为。NaClO溶液中显碱性原因:(用离子方程式表示)。(5)、辛在MnO2催化下受热分解可用于制备氧气,每生成1.204×1024氧气分子,转移e-的个数为。三、综合题
-
19. 《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。(1)、查阅高中教材得知铜锈为Cu2(OH)2CO3 , 俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。请写出Cu在空气中生成铜锈的方程式。(2)、继续查阅资料,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学者将铜锈分为无害锈和有害锈,结构如图所示:

Cu2(OH)3Cl属于(填“无害锈”和“有害锈”),请解释原因。
(3)、文献显示Cu2(OH)3Cl的形成过程中会产生CuCl(白色不溶于水的固体),请结合如图回答:
①过程I的正极反应物是。
②过程I负极的电极反应式是。
(4)、青铜器的修复有以下三种方法:i.柠檬酸浸法:将腐蚀文物直接放在2%—3%的柠檬酸溶液中浸泡除锈;
ii.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)3Cl;
iii.BTA保护法:

请回答下列问题:
①写出碳酸钠法的离子方程式。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl- , 能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
20. 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)(绿色)、Cr2O(橙红色)、CrO(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(1)、Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可察到的现象是。(2)、CrO和Cr2O在溶液中可相互转化室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(Cr2O)随c(H+)的变化如图所示。
①用离子方程式表示溶液中的转化反应。
②由图可知,溶液酸性增大,CrO的平衡转化率填(“增大”“减小”或“不变”)根据A点数据,计算出该转化反应的平衡常数为。
③升高温度,溶液中的平衡转化率减小,则该反应的0(填“大于”“小于”或“等于”)。
(3)、在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl- , 利用Ag+与CrO生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol•L-1)时,溶液中c(Ag+)为mol•L-1 , 此时溶液中c(CrO)等于mol•L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和×10-10)。