天津市红桥区2022-2023学年度高二上学期期末考试化学试题
试卷更新日期:2023-02-10 类型:期末考试
一、单选题
-
1. 下列过程不需要通电就能够实现的是A、电离 B、电镀 C、电治金 D、电解饱和食盐水2. 室温下,柠檬水溶液的pH=3,其中c(OH-)为多少( )A、0.1mol/L B、1×10-3mol/L C、1×10-7mol/L D、1×10-11mol/L3. 下列各组元素中,电负性依次减小的是A、F、N、O B、Cl、C、F C、Cl、S、P D、P、N、H4. 下列物质溶于水,能使水的电离平衡向左移动的是A、 B、NaOH C、 D、5. 中和反应反应热的测定中需要用到的实验仪器有A、秒表 B、滴定管 C、胶头滴管 D、简易量热计6. 二氧化硫催化氧化反应为: , 下列措施既能加快反应速率又能提高平衡转化率的是A、升高温度 B、增大压强 C、分离出 D、使用催化剂7. 下列过程中,化学反应速率的增大对人类有益的是A、金属的腐蚀 B、橡胶的老化 C、氨的合成 D、食物的腐败8. 化学与生产生活密切相关。下列说法错误的是A、用硫酸铁除去水中的悬浮物 B、明矾可用作净水剂和消毒剂 C、用纯碱溶液除油污,加热可提高去污能力 D、镀锡铁皮的镀层破损后,铁皮会加速腐蚀9. 有关反应条件改变使反应速率增大的原因分析中,错误的是A、加入适宜的催化剂,能提高活化分子的百分数 B、增大反应物浓度,单位体积内活化分子数增大 C、升高温度,单位时间内有效碰撞次数增加 D、增大压强,活化分子的百分数增大10. 某反应过程的能量变化如图所示,下列说法错误的是
 A、该反应为放热反应 B、曲线B为使用催化剂的反应历程,且包含多个基元反应 C、使用合适的催化剂可以降低反应的活化能 D、活化分子间发生的碰撞不一定是有效碰撞11. 理论研究表明,在101 kPa和298 K下,异构化反应过程能量变化如图所示。下列说法错误的是
A、该反应为放热反应 B、曲线B为使用催化剂的反应历程,且包含多个基元反应 C、使用合适的催化剂可以降低反应的活化能 D、活化分子间发生的碰撞不一定是有效碰撞11. 理论研究表明,在101 kPa和298 K下,异构化反应过程能量变化如图所示。下列说法错误的是 A、HCN比HNC稳定 B、该反应难自发进行 C、该异构化反应的 kJ⋅mol D、使用合适的催化剂,可以改变反应的转化率12. 室温下,下列有关两种溶液的说法错误的是( )
A、HCN比HNC稳定 B、该反应难自发进行 C、该异构化反应的 kJ⋅mol D、使用合适的催化剂,可以改变反应的转化率12. 室温下,下列有关两种溶液的说法错误的是( )序号
①
②
pH
11
11
溶液
氨水
氢氧化钠溶液
A、①和②两溶液中c(OH-)相等 B、①溶液的物质的量浓度为0.001mol·L-1 C、①和②两溶液分别加水稀释10倍,稀释后溶液的pH:①>② D、等体积的①和②两溶液分别与相同浓度的盐酸恰好完全中和,消耗盐酸的体积:①>②二、综合题
-
13. A、B、C、D、E、F为6种原子序数依次增大的前36号元素,其性质或结构的信息如下表:
元素
性质或结构信息
A
该元素形成的化合物种类最多
B
原子核外p轨道电子为半满
C
地壳中元素含量最高的元素
D
前四周期中,轨道末成对电子数最多的元素
E
位于元素周期表的第8列
回答下列问题:
(1)、A基态原子中能量最高的电子,其电子云在空间有个伸展方向,该原子轨道的形状为。(2)、 A,B,C三种元素第一电离能由大到小的顺序为 , 原子半径由大到小的顺序为(用元素符号表示)。(3)、D基态原子的电子排布式为 , 其电子的空间运动状态有种。(4)、E在元素周期表中的位置 , 其基态原子价电子的轨道表示式为。14. 请按要求回答下列问题:(1)、甲烷的标准燃烧热为kJ⋅mol , 则表示甲烷燃烧热的热化学方程式:。(2)、 kJ/molkJ/mol
写出与反应生成和水蒸气的热化学反应方程式。
(3)、铁片镀铜实验中(装置如图所示),b接电源的极,铁片上发生的电极反应式为。电镀过程中(填“变大”、“变小”或“基本保持不变”)。 (4)、新冠疫情期间,某同学设计了一个电解装置如图,用于制备“84”消毒液的有效成分,则c为电源的极;该发生器阴极电极反应式为。(5)、如图装置利用与Cu发生的反应,设计一个可正常工作的电池,补全该电化学装置示意图。(供选择的实验用品为:石墨棒、铜棒、溶液、溶液)
(4)、新冠疫情期间,某同学设计了一个电解装置如图,用于制备“84”消毒液的有效成分,则c为电源的极;该发生器阴极电极反应式为。(5)、如图装置利用与Cu发生的反应,设计一个可正常工作的电池,补全该电化学装置示意图。(供选择的实验用品为:石墨棒、铜棒、溶液、溶液) 15. 回答下列问题(1)、工业上用二氧化碳催化加氢可合成乙醇,其反应原理为:
15. 回答下列问题(1)、工业上用二氧化碳催化加氢可合成乙醇,其反应原理为:。
温度/
400
500
平衡常数K
9
5.3
通过表格中的数值可以推断:该反应的0(填“>”、“<”、或“=”),其正反应在(填“高温”、“低温”或“任何温度”)下能自发进行。若达到平衡时,液化分离出 , 反应速率将(填“增大”、“减小”或“不变”)。
(2)、工业上也可以利用和合成甲醇:。某1 L恒温恒容密闭容器中充入1 mol 和3 mol 发生反应,测得和浓度随时间变化如图所示:
①0∼3 min内,的平均反应速率为 , 该温度下的平衡常数为(单位可忽略)。若达平衡时,保持温度不变,向容器中再充入、、和各0.25 mol,则此时QK,v正v逆(填“>”、“<”、或“=”)。
②下列说法能说明反应达到化学平衡状态的是
A.的消耗速率与的消耗速率之比为3∶1
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.和的浓度相等时
16. 室温下,用0.1000 mol⋅L NaOH溶液滴定20.00 mL 0.1000 mol⋅L HCl溶液过程中,溶液的pH随NaOH溶液体积的变化如图所示: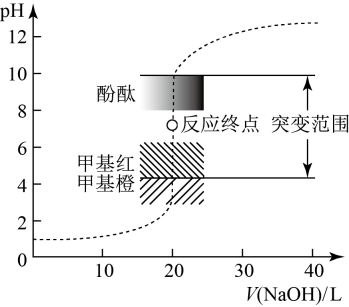 (1)、滴定管在加溶液滴定前,需要进行的操作是和。
(1)、滴定管在加溶液滴定前,需要进行的操作是和。当 mL时,溶液中所有离子的浓度存在的关系是。
(2)、已知。当加入的mL时,溶液中(3)、下列说法错误的是____A、NaOH与盐酸恰好完全反应时, B、选择甲基红指示反应终点,误差比甲基橙的大 C、当接近滴定终点时,极少量的碱就会引起溶液的pH突变 D、选择变色范围在pH突变范围内的指示剂,可减小实验误差(4)、在化学分析中,以标准溶液滴定溶液中的时,采用为指示剂,利用和反应生成砖红色沉淀表示滴定终点。当溶液中的恰好完全沉淀时,溶液中的mol/L;mol/L。已知:①25℃时, ,
②当溶液中某种离子的浓度等于或小于 mol/L时,可认为已完全沉淀。