江苏省南通市如皋市2022-2023学年高二上学期1月期末考试化学试题
试卷更新日期:2023-02-10 类型:期末考试
一、单选题
-
1. 保护钢铁有利于节约资源、保护环境,下列钢铁的保护方法中错误的是A、铁栅栏上涂上油漆 B、铁闸与直流电源正极相连 C、轮船底部焊接镁块 D、家用铁锅水洗后及时擦干2. 反应可用于制取高纯度的硅。下列说法正确的是A、的电子式为
 B、原子的结构示意图为
B、原子的结构示意图为 C、含18个中子的原子可表示为
D、的电离方程式为
3. 短周期主族元素X、Y、Z的原子序数依次增大,X原子最外层电子数是次外层电子数的3倍,Y是短周期中金属性最强的元素,Z与X位于同一主族。下列叙述正确的是A、原子半径: B、X的简单气态氢化物的热稳定性比Z弱 C、化合物水溶液呈碱性 D、Y形成的最高价氧化物的水化物是弱碱4. 在给定条件下,下列选项所示的物质间转化均能实现的是A、 B、 C、 D、5. 工业上通常采用铁触媒、在和的条件下合成氨。合成氨的反应为。下列说法正确的是A、的 B、采用的高温是有利于提高平衡转化率 C、采用的高压能增大反应的平衡常数 D、使用铁触媒可以降低反应的活化能6. 一种药物中间体X的结构如下图所示。下列关于X的说法正确的是
C、含18个中子的原子可表示为
D、的电离方程式为
3. 短周期主族元素X、Y、Z的原子序数依次增大,X原子最外层电子数是次外层电子数的3倍,Y是短周期中金属性最强的元素,Z与X位于同一主族。下列叙述正确的是A、原子半径: B、X的简单气态氢化物的热稳定性比Z弱 C、化合物水溶液呈碱性 D、Y形成的最高价氧化物的水化物是弱碱4. 在给定条件下,下列选项所示的物质间转化均能实现的是A、 B、 C、 D、5. 工业上通常采用铁触媒、在和的条件下合成氨。合成氨的反应为。下列说法正确的是A、的 B、采用的高温是有利于提高平衡转化率 C、采用的高压能增大反应的平衡常数 D、使用铁触媒可以降低反应的活化能6. 一种药物中间体X的结构如下图所示。下列关于X的说法正确的是 A、X分子中所有原子可能在同一平面上 B、X能发生消去反应 C、X能与发生显色反应 D、最多能与反应7. 下列有关化学用语表示正确的是A、已知的燃烧热为 , 则燃烧的热化学方程式可表示为 B、用惰性电极电解溶液的化学方程式为 C、水解的离子方程式: D、铅蓄电池(作电解质)放电时的正极反应式:8. 室温时,含和的溶液中,、的物质的量分数随的变化如下图所示。下列说法正确的是
A、X分子中所有原子可能在同一平面上 B、X能发生消去反应 C、X能与发生显色反应 D、最多能与反应7. 下列有关化学用语表示正确的是A、已知的燃烧热为 , 则燃烧的热化学方程式可表示为 B、用惰性电极电解溶液的化学方程式为 C、水解的离子方程式: D、铅蓄电池(作电解质)放电时的正极反应式:8. 室温时,含和的溶液中,、的物质的量分数随的变化如下图所示。下列说法正确的是 A、曲线I代表的物质是 B、室温时,的电离平衡常数 C、室温时,的水解平衡常数 D、室温时,将浓度均为和等体积混合,溶液呈酸性9. 常温下,将溶液置于锥形㼛中,将溶液置于滴定管中,用溶液滴定 , 实验中的下列情形会导致达到滴定终点时,消耗溶液体积小于的是A、装溶液的滴定管水洗后未用待装液润洗 B、滴定管滴定前尖嘴处有气泡,滴定后气泡消失 C、滴定过程中,用蒸馏水将附着在瓶壁上的液体冲入溶液中 D、滴定结束时,俯视滴定管进行读数10. 温度为时,向恒容密闭容器中充入和 , 发生反应: , 反应过程中的物质的量与部分时间的关系如下图所示。下列说法正确的是
A、曲线I代表的物质是 B、室温时,的电离平衡常数 C、室温时,的水解平衡常数 D、室温时,将浓度均为和等体积混合,溶液呈酸性9. 常温下,将溶液置于锥形㼛中,将溶液置于滴定管中,用溶液滴定 , 实验中的下列情形会导致达到滴定终点时,消耗溶液体积小于的是A、装溶液的滴定管水洗后未用待装液润洗 B、滴定管滴定前尖嘴处有气泡,滴定后气泡消失 C、滴定过程中,用蒸馏水将附着在瓶壁上的液体冲入溶液中 D、滴定结束时,俯视滴定管进行读数10. 温度为时,向恒容密闭容器中充入和 , 发生反应: , 反应过程中的物质的量与部分时间的关系如下图所示。下列说法正确的是 A、0~50s时,的平均速率 B、时,容器中的物质的量可能为 C、时,起始向容器中充入和 , 达平衡时,的物质的量大于 D、时,起始向容器中充入、和 , 反应向正方向进行
A、0~50s时,的平均速率 B、时,容器中的物质的量可能为 C、时,起始向容器中充入和 , 达平衡时,的物质的量大于 D、时,起始向容器中充入、和 , 反应向正方向进行二、多选题
-
11. 常温下,的沉淀溶解平衡曲线如下图所示,下列说法正确的是
 A、 B、Y点表示的不饱和溶液 C、向X点中加入溶液,当达到新平衡时,可能处于Z点 D、在溶液中的溶解度大于在水中的溶解度12. 常温下,将溶液置于锥形㼛中,将溶液置于滴定管中,用溶液滴定 , 所得溶液的与的体积关系如下图所示。已知Ka(CH3COOH)=1.8×10-5。下列说法正确的是
A、 B、Y点表示的不饱和溶液 C、向X点中加入溶液,当达到新平衡时,可能处于Z点 D、在溶液中的溶解度大于在水中的溶解度12. 常温下,将溶液置于锥形㼛中,将溶液置于滴定管中,用溶液滴定 , 所得溶液的与的体积关系如下图所示。已知Ka(CH3COOH)=1.8×10-5。下列说法正确的是 A、滴定过程中始终存在等式: B、点①溶液中存在等式: C、点③溶液中存在等式: D、点③溶液中存在:13. 控制压强分别为和 , 将丁烷和氢气(氢气可以活化催化剂)以一定的比例通过填充有催化剂的反应器,发生脱氢反应: , 测得不同压强下平衡体系中和的物质的量分数如下图所示,下列说法正确的是
A、滴定过程中始终存在等式: B、点①溶液中存在等式: C、点③溶液中存在等式: D、点③溶液中存在:13. 控制压强分别为和 , 将丁烷和氢气(氢气可以活化催化剂)以一定的比例通过填充有催化剂的反应器,发生脱氢反应: , 测得不同压强下平衡体系中和的物质的量分数如下图所示,下列说法正确的是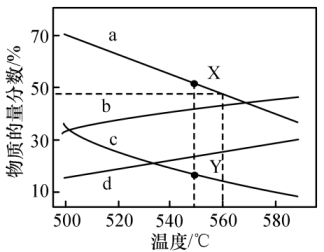 A、图中曲线a、c表示的物质是 , 曲线a对应的压强是 B、平衡常数 C、、时,的平衡转化率小于 D、研发和使用低温下活性高的催化剂,既有利于加快反应速率,也有利于提高反应平衡转化率
A、图中曲线a、c表示的物质是 , 曲线a对应的压强是 B、平衡常数 C、、时,的平衡转化率小于 D、研发和使用低温下活性高的催化剂,既有利于加快反应速率,也有利于提高反应平衡转化率三、综合题
-
14. 以含锌废渣(主要成分为 , 另含少量、、等)为原料可生产草酸锌晶体( , 微溶于水),其工艺流程为:

常温时,部分金属离子开始沉淀及沉淀完全的如下表所示(浓度时可认为金属离子沉淀完全):
沉淀
开始沉淀时的
恰好完全沉淀时的
(1)、酸浸时应适当增大盐酸的浓度,原因是和。(2)、氧化时反应的离子方程式为。(3)、为不引入杂质,物质X可以是(填化学式)。(4)、“调”时应控制溶液的范围是。(5)、将过滤II所得滤液与草酸钠溶液按一定方式混合,可析出草酸锌晶体。①滤液与草酸钠溶液混合方式不正确,会生成杂质沉淀。则滤液与草酸钠溶液的正确混合方式为。
②若将草酸钠换成草酸铵溶液,则不同的混合方式均不会生成杂质沉淀,原因是。
(6)、根据表格数据可知常温下,。15. 有机化合物G可通过如下路线合成: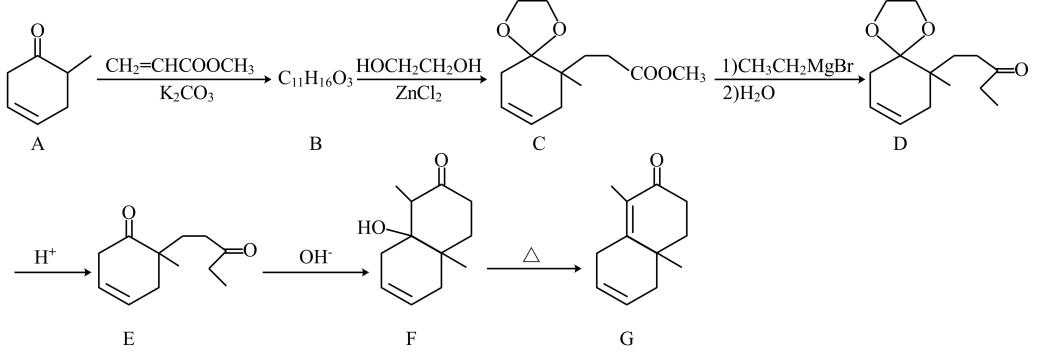 (1)、B的结构简式为。(2)、F→G的反应类型为反应。(3)、A的一种同分异构体符合下列条件,写出该同分异构体的结构简式:。(4)、I.能使溴的四氯化碳溶液褪色;
(1)、B的结构简式为。(2)、F→G的反应类型为反应。(3)、A的一种同分异构体符合下列条件,写出该同分异构体的结构简式:。(4)、I.能使溴的四氯化碳溶液褪色;II.分子中不存在环状结构,含有2种化学环境不同的氢原子。
设计以、、为原料制取的路线图(无机试剂及有机溶剂任用)。
16. 能有效杀灭包含新冠病毒在内的多种病毒,可用于环境消毒。实验室可以通过多种方法进行制取。(1)、一种制取的方法如下图甲所示,已知温度高于时,会分解生成和。装置A中反应的化学方程式为。 (2)、图乙所示装置也可用于制取。
(2)、图乙所示装置也可用于制取。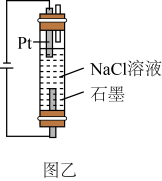
①图乙装置中所发生总反应的化学方程式为。
②与图甲所示方法相比,图乙所示方法的优点除装置简单外,还有:。
(3)、中含有会影响产品的品质。测定样品中的质量分数的方法如下:取样品,加水溶解,加入过量 , 充分反应后,将溶液加热煮沸除去剩余的 , 冷却至室温,加入硫酸酸化,再加入标准溶液 , 充分反应后,用酸性溶液滴定过量的溶液至终点,到达滴定终点时消耗溶液的体积为。已知:酸性条件下与和反应的离子方程式如下:
①加入的目的是除去 , 已知反应后生成 , 写出该反应的化学方程式:。
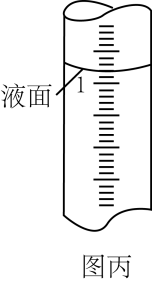
②滴定过程中,滴定管中液面如图丙所示。此时读数为。
③滴定终点的实验现象是。
④计算样品中的质量分数(写出计算过程)。
17. 乙烯主要用于有机合成,可以以乙烷为原料制备。(1)、乙烷裂解法:。①部分物质的能量大小如图所示。

则的。
②已知键能 , , 则。
③ , 维持温度和压强不变,向反应体系中充入大量水蒸气(不参与反应),目的是。
(2)、乙烷氧化法:。一定温度下,向装有催化剂的恒容密闭容器中充入物质的量之比为的和 , 反应相同时间,测得乙烯的产率与温度的关系如图所示。
①图中A点反应一定未达平衡,原因是。
②若C点反应也未达平衡,可能的原因是。
(3)、我国科研工作者研制出一种电极材料,将该材料与电源负极相连,向电极处通入 , 在酸性溶液中电极表面生成。写出电解时阴极的电极反应式:。