山东省曹县2022-2023学年高三下学期开学考试化学试卷
试卷更新日期:2023-02-10 类型:开学考试
一、选择题:本题共10小题,每小题2分,共20分.每小题只有一个选项符合题目要求.
-
1. 古代化学源远流长。下列说法错误的是( )A、“熬胆矾铁釜,久之亦化为铜”,说明铁能置换出铜;这样铁釜能减缓锈蚀 B、“欲试药金(铜锌合金),烧火有五色气起”,通过焰色反应可检验金属元素 C、“龙泉水,可以淬刀剑”,高温的铁与水反应生成 D、“取朴硝(含有)以温汤溶解,次早结块”,该过程为重结晶2. 下列试剂实验室保存方法错误的是( )A、浓硝酸保存在棕色细口瓶中 B、氢氧化钠固体保存在广口塑料瓶中 C、四氯化碳保存在广口塑料瓶中 D、高锰酸钾固体保存在棕色广口瓶中3.
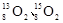 的半衰期很短,自然界中不能稳定存在。人工合成反应如下:;。下列说法正确的是( ) A、X的中子数为2 B、X、Y互为同位素 C、可用作示踪原子研究化学反应历程 D、自然界不存在分子是因其化学键不稳定4. X、Y、Z、W是短周期同一周期的主族元素,原子序数依次增大;基态X的价电子轨道表示式为
的半衰期很短,自然界中不能稳定存在。人工合成反应如下:;。下列说法正确的是( ) A、X的中子数为2 B、X、Y互为同位素 C、可用作示踪原子研究化学反应历程 D、自然界不存在分子是因其化学键不稳定4. X、Y、Z、W是短周期同一周期的主族元素,原子序数依次增大;基态X的价电子轨道表示式为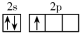 , Z最外层电子数是其次外层电子数的3倍;四种元素与锂组成的化合物结构如图(箭头表示配位键)。下列说法正确的是( )
, Z最外层电子数是其次外层电子数的3倍;四种元素与锂组成的化合物结构如图(箭头表示配位键)。下列说法正确的是( ) 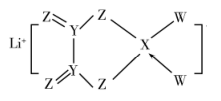 A、四种元素中第一电离能最大的是Z B、Y和Z形成的化合物常温下均易溶于水 C、X的最高价氧化物的水化物是一种强酸 D、Z和W分别与氢元素形成的10电子化合物的沸点:前者高于后者5. 用下列实验装置进行有关实验能达到实验目的的是( )A、检验溶液中是否有
A、四种元素中第一电离能最大的是Z B、Y和Z形成的化合物常温下均易溶于水 C、X的最高价氧化物的水化物是一种强酸 D、Z和W分别与氢元素形成的10电子化合物的沸点:前者高于后者5. 用下列实验装置进行有关实验能达到实验目的的是( )A、检验溶液中是否有
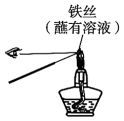 B、证明蔗糖属于还原性糖
B、证明蔗糖属于还原性糖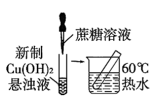 C、制备
C、制备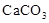
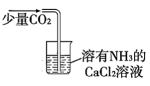 D、用标准
D、用标准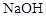 溶液滴定锥形瓶中的盐酸
溶液滴定锥形瓶中的盐酸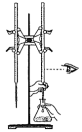 6. 化合物Y能用于高性能光学树脂的合成,可由化合物X与2-甲基丙烯酰氯在一定条件下反应制得:
6. 化合物Y能用于高性能光学树脂的合成,可由化合物X与2-甲基丙烯酰氯在一定条件下反应制得: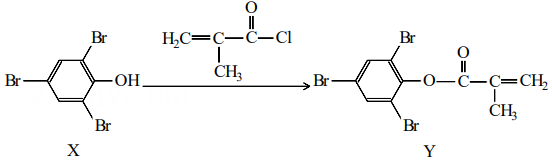
下列有关化合物X、Y的说法错误的是( )
A、Y与的加成产物分子中含有手性碳原子 B、X分子具有亲水基团,可溶于水 C、可用溶液鉴别X、Y D、Y不存在顺反异构7. 某同学进行海带提碘实验,部分实验操作如下:将灼烧后的海带灰放入烧杯中,加入蒸馏水充分浸泡后放置在泥三角上,煮沸2~3分钟,冷却后过滤。将适量稀硫酸与双氧水滴入滤液,充分反应后转移至分液漏斗,打开盛有的试剂瓶,将橡胶塞倒放,取少量加入分液漏斗中,塞紧瓶塞,将分液漏斗多次振荡放气后静置分液,层从上口倒出。实验中存在错误的有几处( )A、1 B、2 C、3 D、48. 氢能源是最具应用前景的能源之一。可利用太阳能光伏电池电解水制高纯氢,工作原理如图所示(电极l、电极2均为惰性电极)。下列说法错误的是( )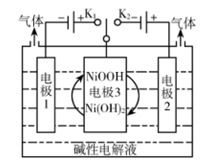 A、控制连接开关或 , 可交替得到和 B、碱性电解液改为酸性电解池能达到同样目的 C、接通时电极3上的电极反应式为 D、电极3在交替连接或过程中得以循环使用9. 向7.5mL0.03的溶液中,逐滴加入相同浓度的NaOH溶液,溶液pH与NaOH溶液体积关系如图所示,已知 , 下列说法错误的是( )
A、控制连接开关或 , 可交替得到和 B、碱性电解液改为酸性电解池能达到同样目的 C、接通时电极3上的电极反应式为 D、电极3在交替连接或过程中得以循环使用9. 向7.5mL0.03的溶液中,逐滴加入相同浓度的NaOH溶液,溶液pH与NaOH溶液体积关系如图所示,已知 , 下列说法错误的是( )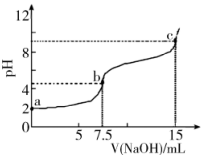 A、第一级电离平衡常数的数量级为 B、水的电离程度:b<c C、b点溶液中离子浓度: D、c点溶液中:10. 硫代硫酸钠()可作为照相业的定影剂,反应的化学方程式为:。下列说法正确的是( )A、基态Br原子中电子的空间运动状态有35种 B、中含有离子键、共价键、配位键 C、中心原子S的杂化方式为 D、非金属元素S、O、Br中电负性最大的是Br
A、第一级电离平衡常数的数量级为 B、水的电离程度:b<c C、b点溶液中离子浓度: D、c点溶液中:10. 硫代硫酸钠()可作为照相业的定影剂,反应的化学方程式为:。下列说法正确的是( )A、基态Br原子中电子的空间运动状态有35种 B、中含有离子键、共价键、配位键 C、中心原子S的杂化方式为 D、非金属元素S、O、Br中电负性最大的是Br二、选择题:本题共5小题,每小题4分,共20分.每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分.
-
11. 下列说法中正确的是( )A、向溶液中通入 , 可能发生反应: B、
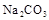 溶解度大于 , 则
溶解度大于 , 则 溶解度大于
C、的浓硫酸与足量铜粉在加热条件下反应,转移电子数为
D、烯烃可通过加成、消去、取代反应制得
12. 下列离子方程式书写正确的是( )A、向溶液中通入少量 B、用白醋浸泡过的淀粉-试纸检验加碘盐中的 C、向溶液中通入气体产生白色沉淀: D、的溶液和的溶液等体积混合:13. 萤石是制作光学玻璃的原料之一,其主要成分氟化钙的晶胞结构如图所示。下列说法错误的是( )
溶解度大于
C、的浓硫酸与足量铜粉在加热条件下反应,转移电子数为
D、烯烃可通过加成、消去、取代反应制得
12. 下列离子方程式书写正确的是( )A、向溶液中通入少量 B、用白醋浸泡过的淀粉-试纸检验加碘盐中的 C、向溶液中通入气体产生白色沉淀: D、的溶液和的溶液等体积混合:13. 萤石是制作光学玻璃的原料之一,其主要成分氟化钙的晶胞结构如图所示。下列说法错误的是( )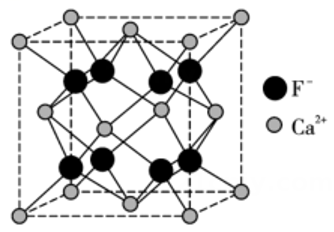 A、Ca位于元素周期表s区 B、每个周围距离最近且等距的有4个 C、位于构成的四面体空隙 D、基态氟原子核外电子的原子轨道有四种伸展方向14. 相同金属在其不同浓度盐溶液中可形成浓差电池。如下图所示装置是利用浓差电池电解
A、Ca位于元素周期表s区 B、每个周围距离最近且等距的有4个 C、位于构成的四面体空隙 D、基态氟原子核外电子的原子轨道有四种伸展方向14. 相同金属在其不同浓度盐溶液中可形成浓差电池。如下图所示装置是利用浓差电池电解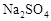 溶液(a、b电极均为石墨电极),可以制得和NaOH。下列说法错误的是( )
溶液(a、b电极均为石墨电极),可以制得和NaOH。下列说法错误的是( ) 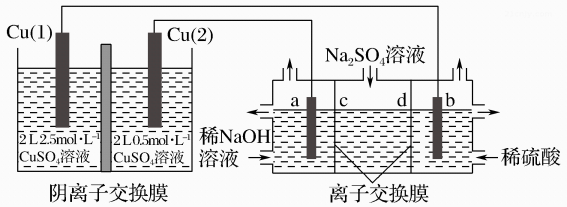 A、a电极的电极反应式为 B、电池放电过程中,Cu(1)电极上的电极反应式为 C、c、d离子交换膜依次为阴离子交换膜和阳离子交换膜 D、电池从开始工作到停止放电,电解池理论上可制得320gNaOH15. 已知:25 ℃时,约为1×10-10 ,
A、a电极的电极反应式为 B、电池放电过程中,Cu(1)电极上的电极反应式为 C、c、d离子交换膜依次为阴离子交换膜和阳离子交换膜 D、电池从开始工作到停止放电,电解池理论上可制得320gNaOH15. 已知:25 ℃时,约为1×10-10 ,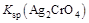 约为。下列有关电解质溶液的说法正确的是( ) A、
约为。下列有关电解质溶液的说法正确的是( ) A、 的溶液中:
B、pH相同的①
的溶液中:
B、pH相同的①  、② NaOH、③NaClO三种溶液中:③ >① >②
C、向浓度均为
、② NaOH、③NaClO三种溶液中:③ >① >②
C、向浓度均为 的NaCl和混合液中滴加
的NaCl和混合液中滴加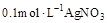 溶液,先沉淀
D、
溶液,先沉淀
D、 氨水和
氨水和
 溶液等体积混合:
溶液等体积混合:
三、非选择题:本题共5小题,共60分。
-
16. 钒广泛应用于钢铁工业,钒的氧化物在化学工业常用作催化剂。某沉钒废水(含)钒含量约为2%。从该沉钒废水中分离出铁元素并制备的流程如下所示:
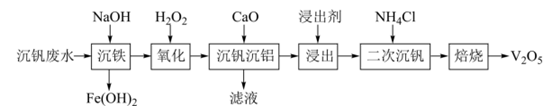
已知:①钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数与pH的关系如图所示。
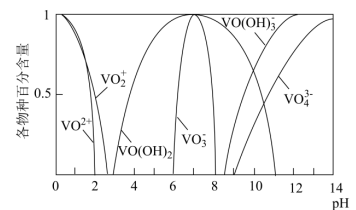
②
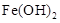 完全沉淀的pH为8.4;
完全沉淀的pH为8.4;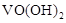 完全溶解的pH约为11。
完全溶解的pH约为11。③吉布斯自由能(
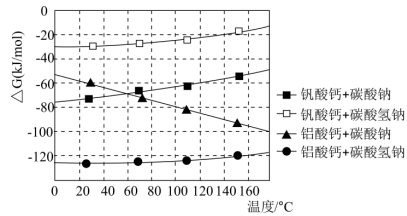
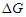 )可以用来判断反应进行的方向。一个反应的越小,反应发生的可能性越大。(1)、写出基态V原子的核外电子排布式。(2)、“沉铁”时调节pH时不能用氨水代替氢氧化钠的原因是。(3)、写出“氧化”时发生的离子方程式。(4)、①“沉钒沉铝”中所得沉淀物与浸出剂反应与温度的关系如图所示。“浸出”时应控制温度低于60℃,原因是。
)可以用来判断反应进行的方向。一个反应的越小,反应发生的可能性越大。(1)、写出基态V原子的核外电子排布式。(2)、“沉铁”时调节pH时不能用氨水代替氢氧化钠的原因是。(3)、写出“氧化”时发生的离子方程式。(4)、①“沉钒沉铝”中所得沉淀物与浸出剂反应与温度的关系如图所示。“浸出”时应控制温度低于60℃,原因是。②若“浸出”时浸出剂中添加NaOH固体,并边浸出边通入 , 可大大提高钒的浸出率,原因是。
 (5)、“二次沉钒”时,先调节pH约为6~8,得到含钒铵盐沉淀,写出“焙烧时该铵盐沉淀发生分解的化学方程式。17. 乙酰乙酸乙酯(A)是有机合成的原料,以下是以A为原料合成有机物F的合成路线:
(5)、“二次沉钒”时,先调节pH约为6~8,得到含钒铵盐沉淀,写出“焙烧时该铵盐沉淀发生分解的化学方程式。17. 乙酰乙酸乙酯(A)是有机合成的原料,以下是以A为原料合成有机物F的合成路线: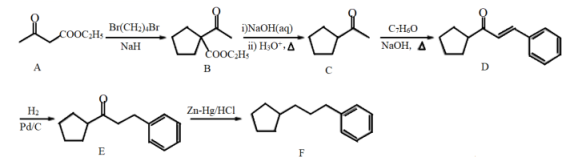
完成下列填空:
(1)、A中的官能团有。(2)、E→F的反应类型是。(3)、制备A的化学方程式: , 则X的结构简式是。(4)、B的同分异构体G满足以下条件:①含六元环;②含5种不同化学环境的H原子;③有酸性且在一定条件下能发生银镜反应。写出G的结构简式。(5)、参照(3)和流程所给信息,请写出以已二酸()、乙醇为原料合成B的同分异构体的合成路线。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。18. 草酸亚铁晶体()是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究草酸亚铁晶体的热分解的产物,设计装置图如下。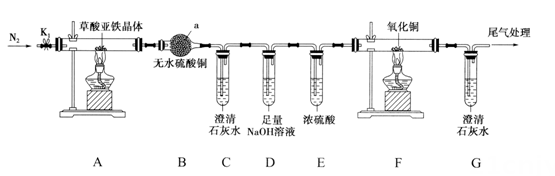 回答下列问题:(1)、装置a的名称是;检验产物是否有水时存在一定的缺陷,改进方法为。(2)、为了保证实验结果的准确性,同时防止加热时发生爆炸,实验前应进行的操作是。实验时夹紧 , 点燃A处与F处的酒精灯进行实验,当观察到(填现象)时,证明气体产物中含有CO。结束时,应首先熄灭(填“A”或“F”)处的酒精灯。(3)、工业制得的草酸亚铁晶体中常含有杂质,测定其纯度的流程如下图:
回答下列问题:(1)、装置a的名称是;检验产物是否有水时存在一定的缺陷,改进方法为。(2)、为了保证实验结果的准确性,同时防止加热时发生爆炸,实验前应进行的操作是。实验时夹紧 , 点燃A处与F处的酒精灯进行实验,当观察到(填现象)时,证明气体产物中含有CO。结束时,应首先熄灭(填“A”或“F”)处的酒精灯。(3)、工业制得的草酸亚铁晶体中常含有杂质,测定其纯度的流程如下图:
①准确量取25.00mL样品溶液的玻璃仪器是;第二次滴定达到终点的现象是。②以M为草酸亚铁晶体的相对质量,该样品的纯度为(用代数式表示),若配制溶液时被氧化,则测定结果将(填“偏高”“偏低”或“不变”)。
19. Co、Al、Si形成的合金是一种高性能的热电材料,备受研究人员关注。回答下列问题:(1)、基态Co原子的价电子排布式为 , 处于元素周期表的区。(2)、下列各状态的铝中,再电离出一个电子所需能量最小的是(填序号)。 (3)、 是某些有机反应的催化剂,如苯酚(
(3)、 是某些有机反应的催化剂,如苯酚( )与乙酰氯(
)与乙酰氯( )反应的部分历程为
)反应的部分历程为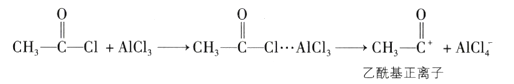
①乙酰氯分子中碳原子的杂化类型为。
②乙酰氯分子中C—C键与C—Cl键的夹角120°(填“大于”“等于”或“小于”),判断理由是。
③的空间构型为。
(4)、金刚石、金刚砂(SiC)、单晶硅的熔点由高到低的顺序为。(5)、Co、Al、Si形成的一种合金的晶胞结构如图所示 (若不看
(若不看 , 该晶胞具有萤石结构),1号原子、2号原子、Al原子的分数坐标分别为(0,1,0)、、 , 则3号原子的分数坐标为;若晶胞参数为 , 则该合金的密度为(表示阿伏加德罗常数的值,只需列出式子)。 20. 乙烯是制造塑料、合成橡胶和合成纤维等化学产品的基本原料,乙烷直接裂解、乙烷二氧化碳氧化裂解和乙烷氧气氧化裂解和乙烷氧气氧化裂解制备乙烯的反应如下:
, 该晶胞具有萤石结构),1号原子、2号原子、Al原子的分数坐标分别为(0,1,0)、、 , 则3号原子的分数坐标为;若晶胞参数为 , 则该合金的密度为(表示阿伏加德罗常数的值,只需列出式子)。 20. 乙烯是制造塑料、合成橡胶和合成纤维等化学产品的基本原料,乙烷直接裂解、乙烷二氧化碳氧化裂解和乙烷氧气氧化裂解和乙烷氧气氧化裂解制备乙烯的反应如下:(Ⅰ)
(II)
(III)
回答下列问题:
(1)、已知键能: , , 由此计算生成碳碳键放出的能量为kJ。(2)、上述反应体系在一定条件下建立平衡后,下列说法正确的是___________(填序号)。A、反应(I)加入催化剂,可降低反应的焓变 B、恒压掺入Ar能提高反应(II)的平衡产率 C、降低温度,反应(II)的正反应速率降低、逆反应速率增大 D、增加乙烷的浓度,反应(I)和(II)的平衡均向右移动(3)、K为平衡常数,与温度的倒数的变化如图所示,a,b两条直线中表示反应(II)的直线是(填字母),理由是。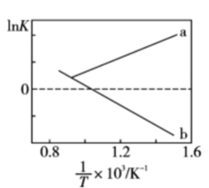 (4)、 时,将乙烷与氦气的混合气体(乙烷的物质的量分数为m%)通入一密闭容器中发生反应(I)。平衡时容器压强为 , 此时乙烷的平衡转化率为 , 反应的平衡常数=(用题中所给字母表示,并化简,分压=总压×物质的量分数)。(5)、已知Arrhenius经验公式(为活化能,k为速率常数,R和C为常数),反应(II)的Arrhenius经验公式实验数据如图甲中直线a所示,该反应的活化能=。当改变外界条件时,实验数据如图中直线b所示,则实验可能改变的外界条件是。
(4)、 时,将乙烷与氦气的混合气体(乙烷的物质的量分数为m%)通入一密闭容器中发生反应(I)。平衡时容器压强为 , 此时乙烷的平衡转化率为 , 反应的平衡常数=(用题中所给字母表示,并化简,分压=总压×物质的量分数)。(5)、已知Arrhenius经验公式(为活化能,k为速率常数,R和C为常数),反应(II)的Arrhenius经验公式实验数据如图甲中直线a所示,该反应的活化能=。当改变外界条件时,实验数据如图中直线b所示,则实验可能改变的外界条件是。 (6)、电有机合成是制备有机物的一种常用方法,相关研究团队利用电化学装置实现和两种分子的耦合转化来制备乙烯等物质,其原理如图乙所示。阴极上的电极反应式为。若生成的乙烯和乙烷的体积比为3:1,则消耗的和 , 物质的量之比为。
(6)、电有机合成是制备有机物的一种常用方法,相关研究团队利用电化学装置实现和两种分子的耦合转化来制备乙烯等物质,其原理如图乙所示。阴极上的电极反应式为。若生成的乙烯和乙烷的体积比为3:1,则消耗的和 , 物质的量之比为。