上海市松江区2022-2023年高考化学一模卷
试卷更新日期:2023-02-10 类型:高考模拟
一、选择题(本题共40分,每小题2分,每小题只有一个符合题意选项)
-
1. C919大型客机制造研制成功,下列哪种材料一般不会在C919上使用的是A、碳纤维复合材料 B、第三代铝锂合金 C、高密度不锈钢 D、钛合金2. 下列所加物质的作用与其还原性有关的是A、腌咸菜加氯化钠 B、红酒中添加 C、食用盐中加碘酸钾 D、泡打粉加碳酸氢钠3. 下列事实不能用元素周期律解释的是( )A、酸性:HClO4 > H2SO3 B、碱性:NaOH > Mg(OH)2 C、气态氢化物的稳定性:H2O > H2S D、Cl2从NaBr溶液中置换出Br24. 为ⅠA族元素,可用于癌症治疗。有关说法错误的是A、质量数为137 B、核外电子数为54 C、原子半径: D、碱性:5. 我国“十四五”规划中提出“碳中和”,“碳”即 , 有关的说法错误的是A、是碳酸的酸酐 B、只含极性共价键 C、是非极性分子 D、是电解质6. 下列分子结构的空间构型为正四面体的是A、四氯化碳 B、1,2-二氯乙烯 C、二氯甲烷 D、氨气7. 将4份等量的铝片分别加到足量的下列溶液中充分反应后,产生氢气量最快的是A、溶液 B、溶液 C、溶液 D、溶液8. 工业生产中,主要反应原理不涉及氧化还原反应的是A、海水提溴 B、纯碱工业 C、硫酸工业 D、合成氨工业9. 如图是制取和收集某气体的实验装置,该装置可用于
 A、用浓硫酸和氯化钠制取 B、用浓氨水和生石灰制取 C、用浓硝酸与铜制取 D、用双氧水和二氧化锰制取10. 丁苯橡胶的化学组成为
A、用浓硫酸和氯化钠制取 B、用浓氨水和生石灰制取 C、用浓硝酸与铜制取 D、用双氧水和二氧化锰制取10. 丁苯橡胶的化学组成为 , 其单体一定有( ) A、2﹣丁炔 B、1,3﹣丁二烯 C、乙苯 D、乙烯11. 充分利用已有的数据是解决化学问题的重要途径。下列数据的利用正确的是A、利用化学平衡常数判断化学反应进行的快慢 B、利用元素最高化合价判断物质氧化性的强弱 C、利用沸点数据设计互溶液体混合物的分离方法 D、利用物质的摩尔质量判断相同状态下物质密度的大小12. 除杂和配制试剂是中学化学中常见的实验。对实验方法描述正确的是A、通过加热蒸发、冷却结晶、过滤洗涤除去中少量的 B、用加入溶液并分液的方法除去乙酸乙酯中少量的乙酸 C、称取 , 配制的溶液 D、在10%的溶液中滴入3滴2%的溶液,配制检验醛基的试剂13. 有机物W在工业上常用作溶剂和香料,其合成方法如下:
, 其单体一定有( ) A、2﹣丁炔 B、1,3﹣丁二烯 C、乙苯 D、乙烯11. 充分利用已有的数据是解决化学问题的重要途径。下列数据的利用正确的是A、利用化学平衡常数判断化学反应进行的快慢 B、利用元素最高化合价判断物质氧化性的强弱 C、利用沸点数据设计互溶液体混合物的分离方法 D、利用物质的摩尔质量判断相同状态下物质密度的大小12. 除杂和配制试剂是中学化学中常见的实验。对实验方法描述正确的是A、通过加热蒸发、冷却结晶、过滤洗涤除去中少量的 B、用加入溶液并分液的方法除去乙酸乙酯中少量的乙酸 C、称取 , 配制的溶液 D、在10%的溶液中滴入3滴2%的溶液,配制检验醛基的试剂13. 有机物W在工业上常用作溶剂和香料,其合成方法如下:
下列说法正确的是
A、W的分子式为 B、三者均能发生加成反应和取代反应 C、M的一氯代物有3种 D、N、W组成上相差一个原子团,所以互为同系物14. 下列各组物质的稀溶液相互反应,把前者逐滴滴入后者与把后者逐滴滴入前者,边滴边振荡,所产生的现象相同的是A、和 B、和 C、氨水和 D、和15. 甲、乙、丙、丁四种物质之间的转化关系如图所示,则下列选项错误的是
选项
甲
乙
A
B
C
溶液
D
溶液
稀盐酸
A、A B、B C、C D、D16. 有一澄清透明的溶液,只可能含有大量的、、、、、、七种离子中的几种,向该溶液中逐滴滴入溶液一定体积后才产生沉淀。则下列判断正确的是A、溶液中可能含有 B、溶液中可能含有 C、溶液中一定不含 D、溶液中一定含有17. 利用如图装置探究铁在海水中的电化学防护,下列说法错误的是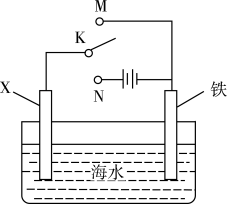 A、若X为锌棒,开关K置于M处,可减缓铁的腐蚀 B、若X为锌棒,开关K置于M处,海水降低 C、若X为碳棒,开关K置于N处,可减缓铁的腐蚀 D、若X为碳棒,开关K置于N处,碳棒上发生氧化反应18. 室温下,取溶液,逐滴加入溶液。已知: , 。下列说法正确的是A、溶液中有 B、当滴加至中性时,用去溶液的体积小于 C、当用去溶液时,此时溶液中有 D、当用去溶液时,此时溶液中有19. 在高温高压的水溶液中,与发生反应沉积出磁铁矿(主要成分)和金矿(含单质),且硫元素全部转化为气体放出。对于该反应的说法一定正确的是A、反应后溶液的降低 B、每生成气体,转移电子数为 C、既作氧化剂又作还原剂 D、氧化剂和还原剂的物质的量之比20. 一定条件下合成乙烯:。已知其它条件不变时,温度对的平衡转化率和催化剂催化效率的影响如图所示。下列说法一定正确的是
A、若X为锌棒,开关K置于M处,可减缓铁的腐蚀 B、若X为锌棒,开关K置于M处,海水降低 C、若X为碳棒,开关K置于N处,可减缓铁的腐蚀 D、若X为碳棒,开关K置于N处,碳棒上发生氧化反应18. 室温下,取溶液,逐滴加入溶液。已知: , 。下列说法正确的是A、溶液中有 B、当滴加至中性时,用去溶液的体积小于 C、当用去溶液时,此时溶液中有 D、当用去溶液时,此时溶液中有19. 在高温高压的水溶液中,与发生反应沉积出磁铁矿(主要成分)和金矿(含单质),且硫元素全部转化为气体放出。对于该反应的说法一定正确的是A、反应后溶液的降低 B、每生成气体,转移电子数为 C、既作氧化剂又作还原剂 D、氧化剂和还原剂的物质的量之比20. 一定条件下合成乙烯:。已知其它条件不变时,温度对的平衡转化率和催化剂催化效率的影响如图所示。下列说法一定正确的是 A、平衡常数 B、反应速率: C、所含总能量: D、经过相同时间后得到乙烯的量:X>Y
A、平衡常数 B、反应速率: C、所含总能量: D、经过相同时间后得到乙烯的量:X>Y二、综合分析题(共60分)
-
21. 新工艺采用金属氧化物催化尿素与甲醇合成碳酸二甲酯 , 副产物氨气回收重新生成尿素,有关的方程式如下:
反应①:
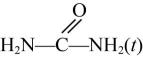 +2CH3OH(g)
+2CH3OH(g)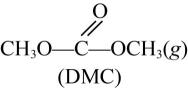 +2NH3(g)
+2NH3(g)反应②:2NH3(g)+CO2(g)
 +H2O(l)
+H2O(l)完成下列填空:
(1)、C原子核外能量最高的电子有个,比较、N、O简单离子的半径大小。(2)、下列事实能说明氮的非金属性比碳强的是(选填编号)。a.酸性: b.最高正价:氮>碳
c.沸点: d.吸引电子能力强弱:氮>碳
(3)、达到平衡时,反应①碳酸二甲酯的产率随温度T的变化关系如图所示,则反应是反应(选填“放热”或“吸热”),(选填“>”或“<”)。 (4)、某一恒温恒容装置内,与发生反应②,后,气体的密度减少 , 则内氨气的平均反应速率为。(5)、传统合成DMC的方法是以光气( , 有剧毒)和甲醇为原料,请写出相应的化学方程式。(6)、新工艺合成DMC的方法和传统方法相比,优点有(任写两点)。22. 氰化提金工艺在黄金生产领域仍占主导地位,但会产生大量含氰废水,含氰低于废水才可排放,研究发现可以用亚硫酸盐——空气法等处理含氰废水。
(4)、某一恒温恒容装置内,与发生反应②,后,气体的密度减少 , 则内氨气的平均反应速率为。(5)、传统合成DMC的方法是以光气( , 有剧毒)和甲醇为原料,请写出相应的化学方程式。(6)、新工艺合成DMC的方法和传统方法相比,优点有(任写两点)。22. 氰化提金工艺在黄金生产领域仍占主导地位,但会产生大量含氰废水,含氰低于废水才可排放,研究发现可以用亚硫酸盐——空气法等处理含氰废水。完成下列填空:
(1)、室温下,溶液呈碱性,溶液中离子浓度从大到小关系为 , 向溶液中加入盐酸溶液 , 使溶液显中性,则溶液中。物质的量之比为的溶液呈碱性,原因是。(2)、含氰废水中加入足量的 , 发生反应的离子方程式为。理论上处理含氰废水(含100gCN-),需要消耗(保留2位小数)。按照理论值投放,含氰废水处理效果并不理想,请分析原因。多种含氯氧化剂均可以处理含氰废水,比如漂粉精、二氧化氯等。(3)、漂粉精的有效成分为(填写化学式)。(4)、请配平下列方程式:CN-+ClO-+H2O→CO2+N2+Cl-+OH-。若上述反应恰好完全,写出检验反应后溶液中Cl-的方法。23. 某实验小组把氯气与铁反应后的固体快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:。 (1)、试剂X的化学式为。有同学根据实验现象分析淡黄色溶液中含有 , 你认为(填“合理”或“不合理”)。(2)、加入少许植物油的作用是。某小组同学实验时在加入新制氯水后,并未得到深红色溶液,请帮助他们分析原因, , 并设计实验对所分析的原因进行验证,简要写出实验方案。为分析某补血剂(主要成分为亚铁盐)中铁元素的质量百分含量,可以用酸性标准溶液进行氧化还原滴定。(3)、实验前,首先要精确配制一定物质的量浓度的KMnO4溶液500mL,配制时需要用的仪器除电子天平、药匙、玻璃棒、烧杯、胶头滴管外,还需。配制时要用硫酸酸化KMnO4 , 不能用盐酸酸化的原因是。(4)、称取12.0g补血剂在容量瓶中配成200mL溶液,量取25.00mL试样溶液,用0.100mol/LKMnO4标准溶液滴定,判断到达滴定终点的实验现象是 , 达到滴定终点时,消耗标准溶液20.00mL,则所测补血剂中铁元素的质量百分含量是(结果精确到0.1%)。24. 有机化合物E的一种合成路线如下:
(1)、试剂X的化学式为。有同学根据实验现象分析淡黄色溶液中含有 , 你认为(填“合理”或“不合理”)。(2)、加入少许植物油的作用是。某小组同学实验时在加入新制氯水后,并未得到深红色溶液,请帮助他们分析原因, , 并设计实验对所分析的原因进行验证,简要写出实验方案。为分析某补血剂(主要成分为亚铁盐)中铁元素的质量百分含量,可以用酸性标准溶液进行氧化还原滴定。(3)、实验前,首先要精确配制一定物质的量浓度的KMnO4溶液500mL,配制时需要用的仪器除电子天平、药匙、玻璃棒、烧杯、胶头滴管外,还需。配制时要用硫酸酸化KMnO4 , 不能用盐酸酸化的原因是。(4)、称取12.0g补血剂在容量瓶中配成200mL溶液,量取25.00mL试样溶液,用0.100mol/LKMnO4标准溶液滴定,判断到达滴定终点的实验现象是 , 达到滴定终点时,消耗标准溶液20.00mL,则所测补血剂中铁元素的质量百分含量是(结果精确到0.1%)。24. 有机化合物E的一种合成路线如下:
完成下列填空:
(1)、A的结构简式为 , D中的含氧官能团名称为;反应④所需要的试剂与条件为。(2)、①的反应类型 , ②的反应类型。(3)、反应③的化学方程式为。(4)、反应⑤可能产生与E互为同分异构体的副产物,其结构简式为(任写一种)。(5)、A的同分异构体中,能发生银镜反应且有三种氢的分子结构简式为。(6)、参照上述合成路线,设计由 合成
合成 的路线(乙酸及无机试剂任选)。
的路线(乙酸及无机试剂任选)。