山东省泰安市新泰市2022-2023学年九年级上学期期末化学试题
试卷更新日期:2023-02-08 类型:期末考试
一、单选题
-
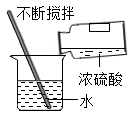
1. 2022年6月5日世界环境日中国主题是“共建清洁美丽世界”。下列做法不符合这一主题的是( )A、废气达标排放 B、用氢气做燃料 C、工地洒水除尘 D、垃圾分类焚烧2. 下列有关溶液的说法错误的是( )A、外界条件不改变,溶质不会从溶液中分离出来 B、物质的溶解过程通常会伴随着能量的变化 C、凡是无色、澄清透明的液体都是溶液 D、溶液和浊液特征的不同主要与物质分散在液体中的颗粒大小有关3. 中和反应广泛应用于生活和生产中,下列做法不合理的是( )A、用熟石灰改良酸性土壤 B、用稀硫酸处理碱性废水 C、用氢氧化钠中和胃酸过多 D、用肥皂水擦拭蚊虫叮咬处4. 规范实验操作是保证安全和实验成败的关键,下列实验操作正确的是( )A、稀释浓硫酸
 B、称量氢氧化钠
B、称量氢氧化钠 C、吸取药液
C、吸取药液 D、测定溶液pH
D、测定溶液pH 5. 下列清洗方法中,利用乳化原理的是( )A、用自来水洗手 B、用汽油清洗油污 C、用食醋除水垢 D、用洗涤剂清洗餐具6. 婷婷周一的早餐是:油条、豆浆和豆腐乳。分析她的早餐中缺少的营养成分是( )A、糖类 B、蛋白质 C、油脂 D、维生素7. 人类的发展史也是人类利用材料的历史,下列材料属于天然材料的是( )A、石器 B、青铜器 C、铁器 D、计算机芯片8. 在粗盐提纯的实验中,下列操作正确的是( )A、
5. 下列清洗方法中,利用乳化原理的是( )A、用自来水洗手 B、用汽油清洗油污 C、用食醋除水垢 D、用洗涤剂清洗餐具6. 婷婷周一的早餐是:油条、豆浆和豆腐乳。分析她的早餐中缺少的营养成分是( )A、糖类 B、蛋白质 C、油脂 D、维生素7. 人类的发展史也是人类利用材料的历史,下列材料属于天然材料的是( )A、石器 B、青铜器 C、铁器 D、计算机芯片8. 在粗盐提纯的实验中,下列操作正确的是( )A、 粗盐称量
B、
粗盐称量
B、 租盐溶解
C、
租盐溶解
C、 浊液过滤
D、
浊液过滤
D、 蒸发结晶
9. 要使下图装置中的小气球鼓起来,则使用的固体和液体可以是下列组合中的( )
蒸发结晶
9. 要使下图装置中的小气球鼓起来,则使用的固体和液体可以是下列组合中的( ) A、硝酸铵固体和水 B、氯化钠固体和水 C、氢氧化钠固体和水 D、蔗糖固体和水10. 下列离子在溶液中能大量共存的是A、K+、Na+、、Cl- B、Na+、H+、、 C、、K+、OH-、 D、Ag+ , Mg2+、、Cl-11. 下列有关合金的叙述,正确的有( )
A、硝酸铵固体和水 B、氯化钠固体和水 C、氢氧化钠固体和水 D、蔗糖固体和水10. 下列离子在溶液中能大量共存的是A、K+、Na+、、Cl- B、Na+、H+、、 C、、K+、OH-、 D、Ag+ , Mg2+、、Cl-11. 下列有关合金的叙述,正确的有( )①合金中至少含有两种金属
②合金一定是混合物
③合金中的元素以化合物的形式存在
④合金一般比组成它们的纯金属硬度更高,熔点更低
⑤合金中各成分保持自己原有的化学性质
A、①②④ B、②④⑤ C、②③⑤ D、①③④12. 编号为甲、乙、丙、丁的4种无色溶液,分别是氯化钙、硝酸银、盐酸、碳酸钠中的一种,将它们两两混合后的现象如下表所示。根据实验现象判断乙溶液中溶质的化学式是实验顺序
实验内容
实验现象
①
甲+乙
有气泡产生
②
甲+丙
有沉淀产生
③
丙+丁
有沉淀产生
④
乙+丙
无明显现象发生
A、Na2CO3 B、AgNO3 C、HCl D、CaCl213. 下图是A、B两种物质的溶解度曲线,下列叙述错误的是( ) A、30℃时,向100克水中加入25克A物质,充分溶解后所得溶液是饱和溶液 B、30℃时,两物质中A物质的质量分数一定大于B物质的质量分数 C、B物质的饱和溶液从30℃降温到20℃,其溶质质量分数减小 D、30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂的方法14. 向100gCuCl2溶液中逐滴滴加40 g NaOH溶液并振荡,恰好充全反应。过滤,将滤渣烘干得到9.8g固体N。下列有关说法中,错误的是( )A、该反应的类型是中和反应 B、固体N的颜色为蓝色 C、滤液中的溶质为NaCl D、40gNaOH溶液中溶质的质量分数为20%15. 证据推理是化学学科核心素养的重要内容。下列推理中正确的是( )A、碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液一定呈碱性 B、碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐 C、中和反应一定生成盐和水,所以有盐和水生成的反应一定是中和反应 D、溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数也一定减小16. 下列除去杂质的方法正确的是
A、30℃时,向100克水中加入25克A物质,充分溶解后所得溶液是饱和溶液 B、30℃时,两物质中A物质的质量分数一定大于B物质的质量分数 C、B物质的饱和溶液从30℃降温到20℃,其溶质质量分数减小 D、30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂的方法14. 向100gCuCl2溶液中逐滴滴加40 g NaOH溶液并振荡,恰好充全反应。过滤,将滤渣烘干得到9.8g固体N。下列有关说法中,错误的是( )A、该反应的类型是中和反应 B、固体N的颜色为蓝色 C、滤液中的溶质为NaCl D、40gNaOH溶液中溶质的质量分数为20%15. 证据推理是化学学科核心素养的重要内容。下列推理中正确的是( )A、碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液一定呈碱性 B、碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐 C、中和反应一定生成盐和水,所以有盐和水生成的反应一定是中和反应 D、溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数也一定减小16. 下列除去杂质的方法正确的是选项
物质(括号内为杂质)
除去杂质的方法
A
K2SO4溶液(KCl)
加入适量的硝酸银溶液,过滤
B
CaO(CaCO3)
加水溶解、过滤
C
CO2(CO)
点燃混合气体
D
KCl固体(K2CO3)
先加水溶解,再加稍过量的稀盐酸,蒸发结晶
A、A B、B C、C D、D17. 如图是某化学小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )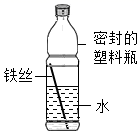
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀最严重
③铁锈的主要成分是四氧化三铁
④一段时间后,塑料瓶可能会变瘪
A、②④ B、①② C、②③ D、③④18. 下图是分离与提纯海水的流程:
下列有关认识错误的是( )
A、通常在苦卤中加入熟石灰制取氢氧化镁 B、粗盐提纯为较纯净的食盐晶体的操作为溶解、过滤、蒸发 C、常用于淡化海水的方法有蒸馏法、过滤法等 D、海水中的食盐用途广泛,例如侯德榜利用食盐为原料制得了纯碱19. 如图是室温下稀盐酸与氢氧化钠溶液反应过程中pH变化的曲线图,下列说法错误的是( ) A、图中x是氢氧化钠溶液 B、a点溶液中含有两种溶质 C、b点表示两溶液恰好完全反应 D、滴加方式是将稀盐酸滴入到氢氧化钠溶液中20. 中国将力争2030年前实现碳达峰,2060年实现碳中和。科研人员正致力于甲醇(CH3OH)——氢气能源体系(如图)的研究〔原位制氢:甲醇与水蒸气混合物在加压催化的条件下裂解和转化,总反应为〕。下列关于该方案的说法错误的是( )
A、图中x是氢氧化钠溶液 B、a点溶液中含有两种溶质 C、b点表示两溶液恰好完全反应 D、滴加方式是将稀盐酸滴入到氢氧化钠溶液中20. 中国将力争2030年前实现碳达峰,2060年实现碳中和。科研人员正致力于甲醇(CH3OH)——氢气能源体系(如图)的研究〔原位制氢:甲醇与水蒸气混合物在加压催化的条件下裂解和转化,总反应为〕。下列关于该方案的说法错误的是( ) A、该研究有利于控制二氧化碳排放实现碳达峰 B、有望解决氢气应用中储存和输送的瓶颈问题 C、用甲醇制氢过程将CH3OH分解成H2和CO2 D、经压缩机形成高压氢过程中分子间空隙变小
A、该研究有利于控制二氧化碳排放实现碳达峰 B、有望解决氢气应用中储存和输送的瓶颈问题 C、用甲醇制氢过程将CH3OH分解成H2和CO2 D、经压缩机形成高压氢过程中分子间空隙变小二、填空题
-
21. 生活离不开化学,处处留心皆学问,请用下列物质的序号填空.
a.甲烷 b.熟石灰 c.干冰 d.活性炭
(1)、可用于改良酸性土壤的是;(2)、新农村建设中,许多家庭建了沼气池,沼气的主要成分是;(3)、可用于净水的是;(4)、可用于人工降雨的是 .三、综合题
-
22. 如图为某学习小组探究金属化学性质时所做的四个实验,仔细分析后回答下列问题:
 (1)、描述A中的实验现象 .(2)、B中的实验现象 .(3)、写出C中反应的化学方程式 .(4)、要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是(填字母).23. 溶液在日常生活、工农业生产和科学研究中具有广泛的用途。小刚在实验室里配制100g10%的氯化钠溶液,操作如下图,请回答下列问题:
(1)、描述A中的实验现象 .(2)、B中的实验现象 .(3)、写出C中反应的化学方程式 .(4)、要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是(填字母).23. 溶液在日常生活、工农业生产和科学研究中具有广泛的用途。小刚在实验室里配制100g10%的氯化钠溶液,操作如下图,请回答下列问题: (1)、该实验操作顺序为(填序号)。配制该溶液时需要NaCl固体g。(2)、配制该溶液的主要步骤有计算、称量、、装瓶存放;操作①中玻璃棒的作用是。(3)、经检验所得溶液的溶质质量分数偏低。请从实验操作上分析造成原因。(写一点即可)(4)、取上述溶液10g加水稀释到g,可得到5%的氯化钠溶液。24. 为了除去食盐(主要成分为NaCl)样品中含有少量的氯化镁和硫酸钠杂质,某学生根据氯碱工业中精制食盐水的基本原理,运用所学知识设计了如图所示①至⑤步除杂方案:
(1)、该实验操作顺序为(填序号)。配制该溶液时需要NaCl固体g。(2)、配制该溶液的主要步骤有计算、称量、、装瓶存放;操作①中玻璃棒的作用是。(3)、经检验所得溶液的溶质质量分数偏低。请从实验操作上分析造成原因。(写一点即可)(4)、取上述溶液10g加水稀释到g,可得到5%的氯化钠溶液。24. 为了除去食盐(主要成分为NaCl)样品中含有少量的氯化镁和硫酸钠杂质,某学生根据氯碱工业中精制食盐水的基本原理,运用所学知识设计了如图所示①至⑤步除杂方案:
请根据上述除杂方案,回答下列问题:
(1)、沉淀甲是;滤液C中的溶质是;操作⑤中加入过量盐酸的作用是。(2)、若在操作②中改为加过量的KOH溶液,固体丁中可能含有的杂质是。25. 实验室里有一瓶标签残缺的试剂瓶,标签中只剩下“Na”和“10%”字样(如图所示),某兴趣小组对其组成进行如下探究.
【提出问题】这瓶试剂可能是什么溶液呢?
【查阅资料】
(1)、Ⅰ.初中化学中常见含钠的化合物有:NaCl、NaOH、Na2CO3、NaHCO3 , 其中一种物质的类别有别于其它三种物质,该物质是 .Ⅱ.NaHCO3的水溶液呈碱性.
Ⅲ.室温(20℃)时,四种物质的溶解度数据如下:
物质
NaHCO3
NaCl
NaOH
Na2CO3
溶解度g/100g水
9.6
36
109
215
【资料分析】
依据上述资料分析该瓶试剂不可能是碳酸氢钠的原因是 .
(2)、【实验探究】实验1:实验测得该溶液的pH>7,则这瓶试剂也不可能是 .
实验2:为了检验该溶液是什么溶液,又进行了如下实验:
取少量溶液于试管中,滴加足量的盐酸,有气泡产生,得出结论,该溶液是Na2CO3溶液.写出上述反应的化学方程式: .有同学对上述结论提出质疑,他认为该溶液可能由 组成,并设计如下实验.
实验3:另取样,加入过量的CaCl2溶液(呈中性),观察到有白色沉淀产生,设计这一步骤的目的是 ;静置后,取上层清液,滴入酚酞试液,溶液呈红色;得出结论,该同学的假设成立.
上述实验中,证明所加氯化钙溶液是过量的方法是 .
四、计算题
-
