北京市平谷区2022-2023学年九年级上学期期末化学试题
试卷更新日期:2023-02-08 类型:期末考试
一、选择题组
-
1. 空气的成分中,氧气的体积分数约为A、78% B、21% C、0.94% D、0.03%2. 下列符号中,表示两个氧原子的是( )A、O2 B、2O C、O2- D、2O23. 下列操作能鉴别氧气、空气、二氧化碳的是A、闻气味 B、将集气瓶倒扣在水中 C、观察颜色 D、将燃着的木条伸入集气瓶中4. 下列物质在O2中燃烧,产生大量白烟的是A、木炭 B、红磷 C、蜡烛 D、铁丝5. 下列物质中,含有氧分子的是( )A、空气 B、水 C、二氧化碳 D、过氧化氢6. 人类的生活离不开水,下图是自来水厂净水过程示意图、回答下列小题。

下列属于纯净物的是
A、蒸馏水 B、矿泉水 C、海水 D、雨水7. 硫酸铝(Al2(SO4)3)是一种常用的絮凝剂。下列关于Al2(SO4)3的说法错误的是A、由三种元素组成 B、属于氧化物 C、铝元素呈+3价 D、能使水中杂质更好地沉降8. 过滤池起到净水作用是A、吸附水中的臭味 B、去除难溶性杂质 C、去除溶解在水中的杂质 D、杀死水中的细菌9. 下列净水方法中,在自来水厂生产自来水时没有使用到的是A、沉淀 B、过滤 C、吸附 D、蒸馏10. 下列关于硬水和软水的说法错误的是A、肥皂水可鉴别硬水和软水 B、蒸馏可将硬水转化为软水 C、加入活性炭可降低水的硬度 D、加热煮沸可降低水的硬度11. 电解水实验如下图。下列说法错误的是 A、反应前后原子种类没有变化 B、该实验说明水由氢气和氧气组成 C、产生氢气与氧气的体积比约为2:1 D、可用带火星木条检验b管中生成的气体12. 化学为航空航天领域的发展提供强有力的支撑。
A、反应前后原子种类没有变化 B、该实验说明水由氢气和氧气组成 C、产生氢气与氧气的体积比约为2:1 D、可用带火星木条检验b管中生成的气体12. 化学为航空航天领域的发展提供强有力的支撑。火箭推进剂涉及的下列元素中,属于金属元素的是
A、H B、N C、O D、Al13. “嫦娥五号”探测器采集的月壤样品中含有丰富的氦-3资源,其原子的原子核内有2个质子和1个中子,则氦-3原子的核外电子数为( )A、4 B、3 C、2 D、114. “长征五号”运载火箭采用液氢和液氧作为推进剂。下列属于液氢化学性质的是( )A、沸点低 B、密度小 C、能燃烧 D、无色无味15. 我国北斗导航卫星系统使用了星载氢原子钟。氢在元素周期表中的信息如下图。下列有关氢元素的说法错误的是( ) A、元素符号为H B、原子序数为1 C、相对原子质量为1.008g D、原子中核外电子数为116. 一种宇宙飞船,依靠氢气在氧气中燃烧生成水的化学反应提供动力。下列说法中正确的是A、氢气燃烧过程中,分子种类没有改变 B、氢气燃烧过程中,原子种类没有改变 C、氢气、氧气、水均属于化合物 D、氢气由两个氢原子组成17. 下列燃料在O2中燃烧时,不会产生CO2的是A、天然气 B、煤 C、肼(N2H4) D、乙醇(C2H5OH)18. 乙烷(C2H6)是重要的化工原料,与氯气反应前后分子种类变化的微观示意图如下。下列说法正确的是
A、元素符号为H B、原子序数为1 C、相对原子质量为1.008g D、原子中核外电子数为116. 一种宇宙飞船,依靠氢气在氧气中燃烧生成水的化学反应提供动力。下列说法中正确的是A、氢气燃烧过程中,分子种类没有改变 B、氢气燃烧过程中,原子种类没有改变 C、氢气、氧气、水均属于化合物 D、氢气由两个氢原子组成17. 下列燃料在O2中燃烧时,不会产生CO2的是A、天然气 B、煤 C、肼(N2H4) D、乙醇(C2H5OH)18. 乙烷(C2H6)是重要的化工原料,与氯气反应前后分子种类变化的微观示意图如下。下列说法正确的是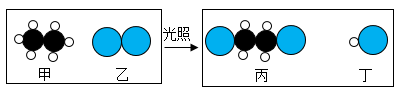
 A、甲中氢元素质量分数大 B、乙的化学式是Cl2 C、甲和丙的元素组成相同 D、生成丙与丁的分子个数比为1:119. 下列变化中属于化学变化的是A、酒精燃烧 B、纸张粉碎 C、冰雪融化 D、酒精挥发20. 下列图标中,表示“禁止吸烟”的是( )A、
A、甲中氢元素质量分数大 B、乙的化学式是Cl2 C、甲和丙的元素组成相同 D、生成丙与丁的分子个数比为1:119. 下列变化中属于化学变化的是A、酒精燃烧 B、纸张粉碎 C、冰雪融化 D、酒精挥发20. 下列图标中,表示“禁止吸烟”的是( )A、 B、
B、 C、
C、 D、
D、 21. 能闻到丁香花散发的香味,主要原因是( )A、分子之间有间隔 B、分子在不断运动 C、分子的质量很小 D、分子的体积很小22. 下列实验操作中,错误的是A、
21. 能闻到丁香花散发的香味,主要原因是( )A、分子之间有间隔 B、分子在不断运动 C、分子的质量很小 D、分子的体积很小22. 下列实验操作中,错误的是A、 检查气密性
B、
检查气密性
B、 取用固体
C、
取用固体
C、 读取液体体积
D、
读取液体体积
D、 倾倒液体
23. 冬季容易发生“煤气中毒”事件,导致人“煤气中毒”的物质是( )A、N2 B、O2 C、CO D、CO224. 下列符号既能表示一种元素,又能表示一种物质,还能表示一个原子的是A、O B、Cl C、Fe D、N25. 用下图所示装置及药品进行实验,能达到对应实验目的的是
倾倒液体
23. 冬季容易发生“煤气中毒”事件,导致人“煤气中毒”的物质是( )A、N2 B、O2 C、CO D、CO224. 下列符号既能表示一种元素,又能表示一种物质,还能表示一个原子的是A、O B、Cl C、Fe D、N25. 用下图所示装置及药品进行实验,能达到对应实验目的的是



A.验证质量守恒定律
B.证明CO2的密度比空气大
C.监控O2流速
D.验证蜡烛中含有氢、氧元素
A、 B、B C、C D、D二、应用题
-
26. 补齐连线。请从A或B两题中任选一个作答,若两题均作答,按A计。
A补齐物质与其用途的连线
B补齐标识与其含义的连线
二氧化碳 氧气 活性炭
供给呼吸 净水 灭火



可回收物 节约用水 静止烟火
27. 能源问题一直是人们关注的热点。(1)、日前人们使用的燃料大多来自化石燃料,如煤、和天然气。天然气的主要成分完全燃烧的化学方程式是。(2)、节约化石能源,减少对环境的影响是能源进一步利用和开发的重点。①H2是理想的清洁燃料。H2燃烧的化学方程式是。
②下列利用了新能源的是(填序号)。
A
 太阳能路灯 B.
太阳能路灯 B. 风力发电
风力发电C.
 核动力潜艇(3)、倡导“低碳”生活从点滴做起。下列做法符合“低碳”理念的是____(填序号)。A、外出随手关灯 B、双面使用纸张 C、骑自行车出行 D、回收喝完的矿泉水瓶28. 空气是我们熟悉的物质。(1)、氧气可用于医疗急救是因为氧气能。(2)、用微观示意图表示空气的主要成分,下图中最合理的是(填序号)。
核动力潜艇(3)、倡导“低碳”生活从点滴做起。下列做法符合“低碳”理念的是____(填序号)。A、外出随手关灯 B、双面使用纸张 C、骑自行车出行 D、回收喝完的矿泉水瓶28. 空气是我们熟悉的物质。(1)、氧气可用于医疗急救是因为氧气能。(2)、用微观示意图表示空气的主要成分,下图中最合理的是(填序号)。资料:在同温同压下,气体的体积之比等于分子个数之比。

三、科普阅读题
-
29. 阅读下面科普短文。
随着环境意识的提高,人们对室内空气质量越来越关心。下表列举了室内空气的主要污染物及来源。
污染源
污染物
建筑材料
NH3、甲醛(CH2O)、苯(C6H6)、甲苯(C7H8)、石棉纤维等
家具
甲醛(CH2O)、甲苯(C7H8)等
办公用品
O3、电磁辐射等
烹饪
CO、NO2、SO3、PM10等
室内微生物
结核杆菌、霉菌等
从上表看出室内污染物种类繁多,其中室内甲醛污染已被列入对公众健康影响最大的环境因素之一、室内空气中的甲醛主要来自于人造板材料制作的家具、地板以及胶黏剂等。这些材料用的越多,甲醛在室内空气中的浓度越高。甲醛的释放期非常长,人们打开人造板家具柜门时,闻到的刺激性气味主要是甲醛的气味。
改善室内空气质量的方法有很多。通常情况下,开窗通风是改善室内空气质量最有效的方法。
运用功能性装饰材料也可以改善室内空气质量。研究表明硅藻泥也可以净化空气。硅藻泥的主要成分是硅藻土,是由水生浮游类生物沉积而成。电子显微镜显示,硅藻土粒子表面具有无数微小的孔穴,功能与活性炭相似。正是这种多孔的结构,使硅藻泥成为具有净化空气功能的内墙装饰材料。
“光触媒技术”是20世纪70年代发展起来的一门新兴技术。“光触媒”是一种纳米级材料,具有强烈的催化分解功能。图一就是“光触媒”技术应用于分解甲醛、氨气、甲苯等有害物质的原理图。

空气净化器是净化室内空气的重要设备。图二是某品牌空气净化器的净化效果图,其中a、b、c是甲醛随开机时间浓度变化的三条曲线。
为满足人们对健康住宅的需求,提高人们的生活质量,使生活由舒适型向健康型方向发展,人们正在不断优化新的技术。
依据短文内容,回答下列问题:
(1)、甲醛(CH2O)属于(填“纯净物”或“混合物”)。(2)、一氧化碳的污染源是。(3)、下列说法正确的是(填序号)。a、甲醛易挥发
b、硅藻泥通过吸附污染物净化了空气
c、吸收、转化、降低室内污染物的浓度都可以改善室内空气质量
(4)、“光触媒技术”可将污染物转化为水和二氧化碳,请完成该化学反应方程式:CH2O + O2CO2 H2O +(5)、依据图二提出一条使用空气净化器的建议:。四、综合题
-
30. 工业上用空气等原料可以合成氨(NH3),主要流程如下:
 (1)、Ⅰ中分离液态空气主要利用氮气和氧气的沸点不同,该性质属于____(填序号)。A、物理性质 B、化学性质(2)、Ⅲ中合成氨的反应是化合反应,该反应的化学方程式为 , 反应前后化合价发生改变的元素是。31. 甲酸(HCOOH)广泛用于轻工、医药、化工等行业。甲酸钠法是最早工业化的甲酸生产工艺,主要流程如下图所示:
(1)、Ⅰ中分离液态空气主要利用氮气和氧气的沸点不同,该性质属于____(填序号)。A、物理性质 B、化学性质(2)、Ⅲ中合成氨的反应是化合反应,该反应的化学方程式为 , 反应前后化合价发生改变的元素是。31. 甲酸(HCOOH)广泛用于轻工、医药、化工等行业。甲酸钠法是最早工业化的甲酸生产工艺,主要流程如下图所示: (1)、甲酸(HCOOH)的相对分子质量为。(2)、反应器中搅拌的目的是。(3)、蒸馏分离器中发生的是(填“物理”或“化学”)变化。32. 根据下图回答问题。
(1)、甲酸(HCOOH)的相对分子质量为。(2)、反应器中搅拌的目的是。(3)、蒸馏分离器中发生的是(填“物理”或“化学”)变化。32. 根据下图回答问题。 (1)、图中仪器a的名称是。(2)、实验室用装置A制氧气,反应的化学方程式是。能用装置E收集氧气时,当气体收集完成后,应。(填字母序号)
(1)、图中仪器a的名称是。(2)、实验室用装置A制氧气,反应的化学方程式是。能用装置E收集氧气时,当气体收集完成后,应。(填字母序号)A.先把导气管移出水面,再熄灭酒精灯
B.先熄灭酒精灯,再把导气管移出水面
(3)、实验室用装置B制二氧化碳,反应的化学方程式是。用装置C收集二氧化碳,验满的操作是。33. 根据下图进行实验,将H2O2溶液推入瓶中。 (1)、H2O2制取氧气的化学方程式为。(2)、木炭燃烧阶段,观察到的现象有。(3)、烧杯中发生反应的化学方程式为。34. 用下图装置探究“燃烧的条件”。
(1)、H2O2制取氧气的化学方程式为。(2)、木炭燃烧阶段,观察到的现象有。(3)、烧杯中发生反应的化学方程式为。34. 用下图装置探究“燃烧的条件”。实验过程:①通入CO2 , 点燃酒精灯,一段时间后,a、b均无明显变化。
②熄灭酒精灯,立即改通O2 , a处无明显变化,b处红磷燃烧。
 (1)、实验过程中,能说明可燃物燃烧需要温度达到着火点的实验现象是。(2)、对比①②中b处红磷的实验现象,说明可燃物燃烧的条件是。35. 如图所示实验验证了空气中氧气的含量(用激光笔引燃白磷)。
(1)、实验过程中,能说明可燃物燃烧需要温度达到着火点的实验现象是。(2)、对比①②中b处红磷的实验现象,说明可燃物燃烧的条件是。35. 如图所示实验验证了空气中氧气的含量(用激光笔引燃白磷)。 (1)、白磷燃烧的化学方程式为。(2)、白磷熄灭、试管冷却后再打开止水来,水倒流入试管中,最终量筒中液面约降至mL刻度线处,原因是。(3)、实验结束后,同学们发现自己测定的氧气体积分数偏低,你认为造成该误差的原因可能是(填序号)。
(1)、白磷燃烧的化学方程式为。(2)、白磷熄灭、试管冷却后再打开止水来,水倒流入试管中,最终量筒中液面约降至mL刻度线处,原因是。(3)、实验结束后,同学们发现自己测定的氧气体积分数偏低,你认为造成该误差的原因可能是(填序号)。①装置气密性不好 ②白磷不足
③未冷却至室温就打开止水夹 ④止水夹没夹紧
36. 化学小组探究影响电解水反应快慢的因素。【进行实验】
20℃时,在不同条件下进行实验,数据记录如下:
组别
实验
序号
液体种类
电压(V)
时间(min)
氢气体积(mL)
氧气体积(mL)
Ⅰ
①
200mL蒸馏水
2
45
0
0
②
200mL蒸馏水
10
45
极少
极少
③
200mL蒸馏水
16
45
5
2.5
Ⅱ
④
200mL蒸馏水+1滴浓H2SO4
16
88
10
4.9
⑤
200mL蒸馏水+2滴浓H2SO4
16
68
10
4.9
⑥
200mL蒸馏水+3滴浓H2SO4
16
52
10
4.9
Ⅲ
⑦
200mL蒸馏水+0.8gNaOH
10
3.0
10
4.9
⑧
200mL蒸馏水+1.6gNaOH
x
2.6
10
4.9
⑨
200mL蒸馏水+3.2gNaOH
10
2.0
10
5.0
(1)、【解释与结论】写出电解水反应的化学方程式为。
(2)、与电源正极相连的玻璃管内产生的气体是。(3)、Ⅲ组实验⑧中的x=。(4)、对比实验②⑦,可得出的结论是。(5)、Ⅱ组实验的目的是。(6)、通过本实验得出,影响电解水反应快慢的因素有。(7)、【反思与评价】表中部分数据氢气与氧气的体积比略大于2:1,从物质性质角度分析可能的原因是____。(填字母选项)
A、相同条件下,氧气在水中的溶解能力大于氢气 B、相同条件下,氢气在水中的溶解能力大于氧气 C、氧气与水发生了化学反应 D、氢气与水发生了化学反应五、计算题
-
37. 封存是实现碳中和的途径之一、矿物质碳化封存反应之一是氧化镁与二氧化碳反应生成碳酸镁,该反应的化学方程式为。若用此方法封存22 , 计算需要氧化镁的质量(写出计算过程及结果)。
-