天津市和平区2022-2023学年高一上学期期末考试化学试题
试卷更新日期:2023-02-06 类型:期末考试
一、单选题
-
1. 碳酸钠的物质类别是( )A、酸 B、碱 C、盐 D、酸性氧化物2. 下列逻辑关系图示中正确的是( )A、
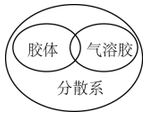 B、
B、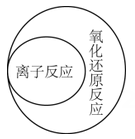 C、
C、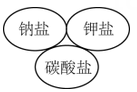 D、
D、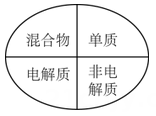 3. 当光束通过下列物质时,会出现丁达尔效应的是:①消毒用的酒精 ②Fe(OH)3胶体 ③生理食盐水 ④有色玻璃 ⑤云、雾( )A、②④⑤ B、③④⑤ C、②③④ D、①③④4. 常温下,下列物质中易溶于水的是( )A、MgSO4 B、AgCl C、Al (OH)3 D、BaCO35. 下列化学符号可以表示硫酸根离子的是A、 B、 C、 D、6. 下列物质分别加入水中,主要以离子形式存在的是( )A、CaCO3 B、Zn C、Fe2O3 D、Mg (NO3)27. 下列物质中属于碱性氧化物的是( )A、Na2O B、SO2 C、NH3 D、KOH8. 下列物质在水中发生电离的电离方程式书写正确的是A、 B、 C、 D、9. 下列叙述中,正确的是A、干燥木棍不导电,但潮湿木棍导电,说明水的导电能力非常强 B、熔融的KNO3能导电,所以KNO3是电解质 C、铜丝、石墨均能导电,所以它们都是电解质 D、NaOH溶于水,在通电条件下才能发生电离10. 下列离子反应中,属于氧化还原反应的是A、Cu2++2OH-= Cu(OH)2↓ B、H++OH- =H2O C、2H++CO32-=H2O+CO2↑ D、Cu2++Fe=Fe2++ Cu11. 在下列反应中,氢元素化合价降低的是A、NaOH + HCl = NaCl + H2O B、Zn + 2HCl =ZnCl2 + H2↑ C、MnO2 + 4HCl(浓)MnCl2 + 2H2O + Cl2↑ D、CuO + 2HCl = CuCl2 + H2O12. 下列离子能大量共存的是( )A、使酚酞溶液呈红色的溶液中: 、K+、 、 B、无色透明的溶液中: Mg2+、 K+、 、 C、含有大量Ba2+的溶液中: Na+、Cu2+、 、Cl- D、使石蕊溶液呈红色的溶液中: 、K+、 、13. 焰火与高中化学中“焰色试验”知识有关。下列有关“焰色试验”说法中正确的是( )A、烟花呈现的艳丽色彩是由锂、钠、钾、锶、钡等金属单质的燃烧呈现出来的 B、做焰色反应实验只能用铂丝蘸取溶液在外焰上灼烧 C、碳酸钾在酒精灯上灼烧时能直接观察到紫色火焰 D、NaCl与Na2SO4灼烧时火焰颜色均为黄色14. 氢化钠(NaH)可在野外用作生氢剂,其中氢元素为-1价。NaH用作生氢剂时的化学反应原理为:NaH+H2O=NaOH+H2↑。下列有关该反应的说法中,正确的是A、该反应属于置换反应 B、该反应属于复分解反应 C、NaH被氧化,作还原剂 D、H2O中的氢元素都被还原15. 下列离子方程式中,正确的是A、氧化亚铁与稀盐酸反应:FeO+2H+=Fe3++H2O B、向氯化铜溶液中加入氢氧化钠溶液:Cu2++OH-=Cu(OH)2↓ C、氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+ D、向氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl-16. 某同学将金属钠露置于空气中,观察到下列现象:银白色→变灰暗→变白色→出现液滴→白色固体。其变质过程中不可能产生的物质是A、Na2O B、NaOH C、Na2CO3 D、NaHCO317. 以下物质中,不具备消毒作用的是( )A、84消毒液 B、氯水 C、Ca(ClO)2 D、N218. 如图所示,在A处通入未经干燥的氯气。当关闭B处的弹簧夹时,C处的红布条看不到明显的现象;当打开B处的弹簧夹后,C处的红布条逐渐褪色,则D瓶中盛放的溶液可能是
3. 当光束通过下列物质时,会出现丁达尔效应的是:①消毒用的酒精 ②Fe(OH)3胶体 ③生理食盐水 ④有色玻璃 ⑤云、雾( )A、②④⑤ B、③④⑤ C、②③④ D、①③④4. 常温下,下列物质中易溶于水的是( )A、MgSO4 B、AgCl C、Al (OH)3 D、BaCO35. 下列化学符号可以表示硫酸根离子的是A、 B、 C、 D、6. 下列物质分别加入水中,主要以离子形式存在的是( )A、CaCO3 B、Zn C、Fe2O3 D、Mg (NO3)27. 下列物质中属于碱性氧化物的是( )A、Na2O B、SO2 C、NH3 D、KOH8. 下列物质在水中发生电离的电离方程式书写正确的是A、 B、 C、 D、9. 下列叙述中,正确的是A、干燥木棍不导电,但潮湿木棍导电,说明水的导电能力非常强 B、熔融的KNO3能导电,所以KNO3是电解质 C、铜丝、石墨均能导电,所以它们都是电解质 D、NaOH溶于水,在通电条件下才能发生电离10. 下列离子反应中,属于氧化还原反应的是A、Cu2++2OH-= Cu(OH)2↓ B、H++OH- =H2O C、2H++CO32-=H2O+CO2↑ D、Cu2++Fe=Fe2++ Cu11. 在下列反应中,氢元素化合价降低的是A、NaOH + HCl = NaCl + H2O B、Zn + 2HCl =ZnCl2 + H2↑ C、MnO2 + 4HCl(浓)MnCl2 + 2H2O + Cl2↑ D、CuO + 2HCl = CuCl2 + H2O12. 下列离子能大量共存的是( )A、使酚酞溶液呈红色的溶液中: 、K+、 、 B、无色透明的溶液中: Mg2+、 K+、 、 C、含有大量Ba2+的溶液中: Na+、Cu2+、 、Cl- D、使石蕊溶液呈红色的溶液中: 、K+、 、13. 焰火与高中化学中“焰色试验”知识有关。下列有关“焰色试验”说法中正确的是( )A、烟花呈现的艳丽色彩是由锂、钠、钾、锶、钡等金属单质的燃烧呈现出来的 B、做焰色反应实验只能用铂丝蘸取溶液在外焰上灼烧 C、碳酸钾在酒精灯上灼烧时能直接观察到紫色火焰 D、NaCl与Na2SO4灼烧时火焰颜色均为黄色14. 氢化钠(NaH)可在野外用作生氢剂,其中氢元素为-1价。NaH用作生氢剂时的化学反应原理为:NaH+H2O=NaOH+H2↑。下列有关该反应的说法中,正确的是A、该反应属于置换反应 B、该反应属于复分解反应 C、NaH被氧化,作还原剂 D、H2O中的氢元素都被还原15. 下列离子方程式中,正确的是A、氧化亚铁与稀盐酸反应:FeO+2H+=Fe3++H2O B、向氯化铜溶液中加入氢氧化钠溶液:Cu2++OH-=Cu(OH)2↓ C、氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+ D、向氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl-16. 某同学将金属钠露置于空气中,观察到下列现象:银白色→变灰暗→变白色→出现液滴→白色固体。其变质过程中不可能产生的物质是A、Na2O B、NaOH C、Na2CO3 D、NaHCO317. 以下物质中,不具备消毒作用的是( )A、84消毒液 B、氯水 C、Ca(ClO)2 D、N218. 如图所示,在A处通入未经干燥的氯气。当关闭B处的弹簧夹时,C处的红布条看不到明显的现象;当打开B处的弹簧夹后,C处的红布条逐渐褪色,则D瓶中盛放的溶液可能是
①饱和NaCl溶液 ②NaOH溶液 ③H2O ④浓硫酸
A、①② B、①③ C、②④ D、③④19. 实验室利用下图所示的装置制备干燥、纯净的氯气。下列有关叙述错误的是( ) A、本实验操作顺序为:检验装置气密性→添加固体药品→添加液体药品→加热 B、装置Ⅱ、Ⅲ中的试剂依次为浓硫酸、饱和NaCl溶液 C、氯气密度比空气大,故装置Ⅳ中长导管进气,短导管出气 D、装置Ⅴ中反应的离子方程式为:Cl2+2OH﹣=Cl﹣+ClO﹣+ H2O20. 下列关于铝的说法中,正确的是A、铝的化学性质不活泼 B、铝不与酸、碱反应 C、常温下铝不与氧气反应 D、铝表面容易生成一层致密的氧化铝保护膜21. 从200 mL如图所示Na2CO3溶液中取出10 mL,取出溶液中Na+的物质的量为
A、本实验操作顺序为:检验装置气密性→添加固体药品→添加液体药品→加热 B、装置Ⅱ、Ⅲ中的试剂依次为浓硫酸、饱和NaCl溶液 C、氯气密度比空气大,故装置Ⅳ中长导管进气,短导管出气 D、装置Ⅴ中反应的离子方程式为:Cl2+2OH﹣=Cl﹣+ClO﹣+ H2O20. 下列关于铝的说法中,正确的是A、铝的化学性质不活泼 B、铝不与酸、碱反应 C、常温下铝不与氧气反应 D、铝表面容易生成一层致密的氧化铝保护膜21. 从200 mL如图所示Na2CO3溶液中取出10 mL,取出溶液中Na+的物质的量为 A、0.005 mol B、0.01 mol C、0.5 mol/L D、1 mol/L22. 将30mL0.5mol/ L NaOH溶液加水稀释到 0.03 mol/L ,则选用的容量瓶规格为A、100 mL B、250 mL C、500 mL D、1000 mL23. 下列说法正确的是( )A、同温同压下甲烷和氧气的密度之比为2∶1 B、1 g甲烷和1 g氧气的原子数之比为5∶1 C、等物质的量的甲烷和氧气的质量之比为2∶1 D、在标准状况下等质量的甲烷和氧气的体积之比为1∶224. 2016年 IUPAC将第117号元素命名为Ts(中文名
A、0.005 mol B、0.01 mol C、0.5 mol/L D、1 mol/L22. 将30mL0.5mol/ L NaOH溶液加水稀释到 0.03 mol/L ,则选用的容量瓶规格为A、100 mL B、250 mL C、500 mL D、1000 mL23. 下列说法正确的是( )A、同温同压下甲烷和氧气的密度之比为2∶1 B、1 g甲烷和1 g氧气的原子数之比为5∶1 C、等物质的量的甲烷和氧气的质量之比为2∶1 D、在标准状况下等质量的甲烷和氧气的体积之比为1∶224. 2016年 IUPAC将第117号元素命名为Ts(中文名 , 音tian),TS是第七周期第ⅦA族元素。下列说法中,错误的是 A、Ts的最外层电子数是7 B、Ts原子原子半径比At原子大 C、Ts在同族元素中非金属性最弱 D、中子数为176的Ts,其核素符号是25. 下列说法正确的是A、含氧的化合物就是氧化物 B、、是同种核素 C、氧化剂的氧化性的相对强弱取决于得到电子数目的多少 D、等质量的铝分别与足量的盐酸和氢氧化钠溶液反应时逸出气体的量相等26. 下列物质含有共价键的是A、MgO B、 C、 D、KBr27. 下列关于物质性质的比较,错误的是( )A、酸性强弱: B、原子半径大小: C、碱性强弱: D、金属性强弱:28. 质量都为4.2g的A气体和B气体,在标准状况下的体积分别为3.36L和2.94L,则这两种气体的摩尔质量之比为( )A、7:8 B、8∶7 C、1∶1 D、15∶1329. 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
, 音tian),TS是第七周期第ⅦA族元素。下列说法中,错误的是 A、Ts的最外层电子数是7 B、Ts原子原子半径比At原子大 C、Ts在同族元素中非金属性最弱 D、中子数为176的Ts,其核素符号是25. 下列说法正确的是A、含氧的化合物就是氧化物 B、、是同种核素 C、氧化剂的氧化性的相对强弱取决于得到电子数目的多少 D、等质量的铝分别与足量的盐酸和氢氧化钠溶液反应时逸出气体的量相等26. 下列物质含有共价键的是A、MgO B、 C、 D、KBr27. 下列关于物质性质的比较,错误的是( )A、酸性强弱: B、原子半径大小: C、碱性强弱: D、金属性强弱:28. 质量都为4.2g的A气体和B气体,在标准状况下的体积分别为3.36L和2.94L,则这两种气体的摩尔质量之比为( )A、7:8 B、8∶7 C、1∶1 D、15∶1329. 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
以下说法错误的是
A、①中一定发生了氧化还原反应 B、污水处理中产生Fe(OH)3胶体,使悬浮物聚沉,利用了胶体具有较强吸附能力的特点 C、另一种在碱性条件下制备K2FeO4的反应可能是:2Fe(OH)3+3ClO-=2FeO42-+3Cl-+4H+ +H2O D、K2FeO4还可以用于处理废水,例如可以把废水中的CN-转化为两种无毒气体,反应过程中,CN-做还原剂,被K2FeO4氧化30. 为从粗食盐水中除去、、等离子,以制得精盐水。某同学设计如下方案:
以下说法正确的是
A、A中主要有和 , 也可能有一些 B、②中加入过量溶液的主要目的是为了除去、 C、D中有、、这3种离子 D、③中发生的反应只有二、综合题
-
31. 有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:(1)、写出下列元素的名称:A , B , C , D。(2)、D元素位于周期表中周期族。D2-的结构示意图是。(3)、AB2是(填“共价”或“离子”)化合物,C2B2所含化学键的类型是、。写出AB2与C2B2反应的化学方程式:。(4)、用电子式表示化合物C2D的形成过程:。32. 某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:
 (1)、请写出与①反应的离子方程式。(2)、请写出与铁粉反应的化学方程式。(3)、向溶液中滴加NaOH溶液最终生成浊液,该过程的现象为 , 此过程中发生的氧化还原反应为(用化学方程式表达)。(4)、将饱和溶液滴入沸水中,并继续煮沸至红褐色,此过程中发生的化学反应为(用化学方程式表达)。(5)、溶液能使酸性高锰酸钾溶液褪色,生成二价锰离子,此过程中发生的化学反应为(用离子方程式表达)。33. 实验室需要配制0.50 NaCl溶液480mL。按下列操作步骤填写适当的文字或数据,以使整个操作完整。
(1)、请写出与①反应的离子方程式。(2)、请写出与铁粉反应的化学方程式。(3)、向溶液中滴加NaOH溶液最终生成浊液,该过程的现象为 , 此过程中发生的氧化还原反应为(用化学方程式表达)。(4)、将饱和溶液滴入沸水中,并继续煮沸至红褐色,此过程中发生的化学反应为(用化学方程式表达)。(5)、溶液能使酸性高锰酸钾溶液褪色,生成二价锰离子,此过程中发生的化学反应为(用离子方程式表达)。33. 实验室需要配制0.50 NaCl溶液480mL。按下列操作步骤填写适当的文字或数据,以使整个操作完整。a.选择仪器。
完成本实验所必须用到的仪器有托盘天平(带砝码,最小砝码为5g)、药匙、烧杯、、玻璃棒、胶头滴管以及等质量的两片滤纸。
b.计算。
配制该溶液需取NaCl晶体g。
c.称量。将药品倒入烧杯中。
d.溶解、冷却。
该步实验中需要使用玻璃棒,其目的是。
e.转移、洗涤。
在转移时应使用玻璃棒引流,需要洗涤烧杯和玻璃棒2~3次,目的是。
f.振荡。轻轻摇动容量瓶,使溶液混合均匀。
g.定容。
将蒸馏水注入容量瓶至液面接近刻度线处,改用滴加,使溶液凹液面与刻度线相切
h.摇匀、装瓶
i.实验过程中的以下操作会导致最终所配溶液的浓度 (填“偏高”“偏低”或“无影响”):
实验操作
最终所配溶液的浓度
向容量瓶中移液时少量溅出
定容时俯视刻度线
定容摇匀后液面下隆再加水
未等溶液冷却就定容