陕西省宝鸡市教育联盟2022-2023学年高一上学期期末质量检测化学试题
试卷更新日期:2023-02-06 类型:期末考试
一、单选题
-
1. 化学与生活、生产密切相关。下列有关说法错误的是A、地震灾区和洪涝灾区使用漂白粉消毒是利用漂白粉的强氧化性 B、在医疗上可用于治疗胃酸过多 C、钠着火时不能用二氧化碳灭火器灭火 D、铁粉常用作食品袋内的脱氧剂2. 室温下,下列各组离子在指定溶液中能大量共存的是A、使石蕊试液显蓝色的溶液中:、、、 B、0.1mol/LNaOH溶液:、、、 C、使酚酞变红色的溶液中:、、、 D、0.1mol/LHCl溶液:、、、3. 常温下,氯气与氢氧化钠溶液反应制得的“84”消毒液能有效抑制新型冠状病毒。下列关于“84”消毒液的叙述错误的是A、该消毒液不能与洁厕灵(主要成分为盐酸)混合使用 B、NaClO属于电解质 C、暴露空气中易变质 D、“84”消毒液的主要成分为4. 反应放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是A、中子数为8的氮原子: B、、、表示同一种核素 C、的电子式:
 D、的结构示意图:
D、的结构示意图: 5. 我国在很多领域取得了举世瞩目的成就,下列使用的部分材料如表所示,其中属于金属材料的是
5. 我国在很多领域取得了举世瞩目的成就,下列使用的部分材料如表所示,其中属于金属材料的是A
B
C
D

兵马俑

C919大型客机机身蒙皮

宇航服

“独立展示”的中国国旗
硅酸盐
第三代铝锂合金
聚酯纤维
国产复合纤维
A、A B、B C、C D、D6. 下列物质中既含离子键又含共价键的是A、 B、NaCl C、HCl D、NaClO7. 舍勒发现将软锰矿和浓盐酸混合加热可产生氯气,该方法是当今实验室制备氯气的主要方法之一,除此之外还可用(浓)制得氯气。利用NaClO氧化浓盐酸制备时,下列装置能达到实验目的的是



A.制备
B.除去中的少量HCl
C.干燥
D.收集
A、A B、B C、C D、D8. 下列根据元素周期律得出的结论错误的是A、原子半径:K>Na>Li B、稳定性:HF>HCl>HBr C、碱性:KOH>NaOH>LiOH D、酸性:9. 汽车都安装有安全气囊,发生剧烈的碰撞时,安全气囊中会发生反应: , 有关该反应说法正确的是A、是还原剂 B、发生还原反应 C、既是氧化反应的产物也是还原反应的产物 D、氧化剂与还原剂的物质的量之比为5∶110. 设为阿伏加德罗常数的值。下列说法正确的是A、在标准状况下,22.4L中所含原子数为 B、28g含有的质子数为 C、溶液中所含的数目为 D、过氧化钠与水反应时,生成0.2mol氧气转移的电子数为11. 下列解释事实的离子方程式,书写正确的是A、用氢氧化铝治疗胃酸过多: B、铝制餐具不宜用来长时间存放碱性食物: C、溶液中加过量溶液: D、实验室制备氯气:12. 和广泛地应用于生产和生活中。下列有关和的说法中正确的是A、可以用澄清石灰水来鉴别溶液和溶液 B、固体中含少量杂质,可通过加热的方法除去 C、等质量的、分别与足量盐酸反应,前者产生多 D、向等物质的量浓度的和溶液中滴加等体积的酚酞溶液,溶液的红色较深13. 将一定量的金属铁、铜投入一定浓度的溶液中充分反应,下列对反应情况推断正确的是A、当铁、铜均不剩余时,溶液中一定有、 , 一定无 B、当铁、铜均剩余时,溶液中一定有、 , 一定无 C、当铜剩余,铁不剩余时,溶液中一定有 , 一定无 D、当铜剩余,铁不剩余时,溶液中一定有 , 一定无、可能含有14. 短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,Y的最高正价与最低负价代数和为0,Z与W同主族,由W、X、Y三种元素组成的化合物M的结构如图所示。下列叙述正确的是 A、元素Y位于元素周期表的第三周期第ⅣB族 B、化合物M中既有极性共价键又含有离子键 C、简单氢化物的稳定性:W<Z D、Z的最高价氧化物对应水化物为中强酸15. 用废铁屑制备磁性氧化铁(),制取过程如图:
A、元素Y位于元素周期表的第三周期第ⅣB族 B、化合物M中既有极性共价键又含有离子键 C、简单氢化物的稳定性:W<Z D、Z的最高价氧化物对应水化物为中强酸15. 用废铁屑制备磁性氧化铁(),制取过程如图:
已知:的作用是洗去废铁屑表面的油污。
下列说法错误的是
A、实验室可用铁与水蒸气在高温条件下制取 B、检验A中的可以用KSCN溶液 C、加时发生反应的方程式为 D、制备的反应是氧化还原反应二、填空题
-
16. 回答下列相关问题:(1)、以下物质:①晶体;②固体;③NaOH溶液;④熔融NaCl;⑤蔗糖;⑥液氯;⑦。能导电的是(填序号,下同);属于电解质的是;属于碱性氧化物的是。(2)、实验室用碳酸钙与盐酸反应制取气体,反应的离子方程式是。常用澄清石灰水检验气体,反应的离子方程式是。(3)、某无土栽培用的营养液,要求KCl、和三种原料的物质的量之比为1∶4∶8。
①配制该营养液后 , 溶液中。
②若采用和KCl来配制该营养液,则KCl和物质的量之比为。
三、综合题
-
17. 下表列出了①~⑩号元素在元素周期表中的位置:
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
VA
ⅥA
ⅦA
0
一
①
②
二
③
④
⑤
三
⑥
⑦
⑧
⑨
⑩
回答下列问题:
(1)、①~⑩中,元素的化学性质最不活泼的是(填元素符号,下同)。上述10种元素中,属于金属元素的有。(2)、写出①与④以原子个数比3∶1形成的化合物的电子式:。(3)、元素④、⑤、⑩分别和①组成的简单化合物中,最稳定的是(填化学式)。(4)、从元素原子得、失电子的角度看,⑤的单质具有(填“氧化性”或“还原性”)。(5)、在盛有氢氧化钠溶液的小烧杯中通入元素⑩的单质,发生反应的离子方程式为。(6)、请从原子结构的角度解释元素⑥的金属性比元素③的金属性强的原因是。18. 以绿矾(主要成分为 , 部分已被氧化为)为原料,生产铁红()的工艺流程如下: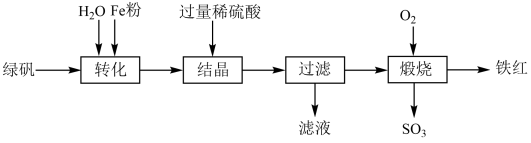
回答下列问题:
(1)、“转化”过程中,加入Fe粉的作用是。“转化”前将绿矾研碎,“转化”中进行搅拌,目的是。(2)、“结晶”时,不同温度下得到的晶体的成分不同(如下图),实验过程中控制温度为75℃左右进行结晶,故得到的晶体的主要成分为(填化学式)。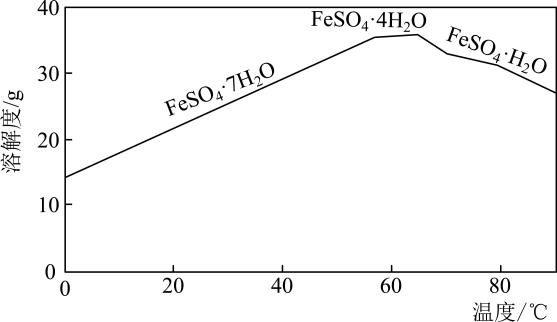 (3)、利用该滤液将工业废水中的还原为 , 然后投加石灰乳,使转化为沉淀,理论上完全反应消耗的。(4)、“煅烧”过程中,每生成1mol铁红,需消耗mol , 同时生成mol和mol。19. 利用氧化绿色的浓强碱溶液制备的装置如下图所示(加热、夹持装置略):
(3)、利用该滤液将工业废水中的还原为 , 然后投加石灰乳,使转化为沉淀,理论上完全反应消耗的。(4)、“煅烧”过程中,每生成1mol铁红,需消耗mol , 同时生成mol和mol。19. 利用氧化绿色的浓强碱溶液制备的装置如下图所示(加热、夹持装置略):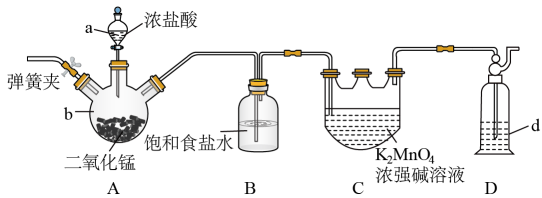 (1)、装置C中发生反应的化学方程式为。(2)、如果d中用足量的溶液吸收多余氯气,写出相应的离子方程式:。(3)、一段时间后,当仪器C中(填实验现象)即停止通氯气。熄灭A处酒精灯,再 , 待冷却后拆除装置。(4)、某同学在实验中发现,若用稀盐酸代替浓盐酸与混合加热没有氯气生成,欲探究该条件下不能生成氯气的原因,该同学提出下列假设:
(1)、装置C中发生反应的化学方程式为。(2)、如果d中用足量的溶液吸收多余氯气,写出相应的离子方程式:。(3)、一段时间后,当仪器C中(填实验现象)即停止通氯气。熄灭A处酒精灯,再 , 待冷却后拆除装置。(4)、某同学在实验中发现,若用稀盐酸代替浓盐酸与混合加热没有氯气生成,欲探究该条件下不能生成氯气的原因,该同学提出下列假设:假设1:的浓度不够大;
假设2:;
假设3:和的浓度均不够大。
设计实验方案,进行实验。在下表中写出实验步骤以及预期现象和结论。(限选实验试剂:蒸馏水、浓、NaCl固体、固体、稀盐酸、溶液、淀粉-KI溶液)
实验步骤
预期现象与结论
步骤1:取少量稀盐酸于试管A中,加入少量 , 滴加几滴浓硫酸,充分振荡,塞紧带导管的胶塞,导管插入淀粉-KI溶液中,加热
①若淀粉-KI溶液变蓝,则假设1成立
②若淀粉-KI溶液不变蓝,则假设2或假设3成立
步骤2:取少量稀盐酸于试管B中,加入少量 , 加入少量NaCl固体,充分振荡,塞紧带导管的胶塞,导管插入淀粉-KI溶液中,加热
①若淀粉-KI溶液变蓝,则成立
②若淀粉-KI溶液不变蓝,结合步骤1中的结论②,则成立
-