北京市西城区2022-2023学年高一上学期期末考试化学试题
试卷更新日期:2023-02-06 类型:期末考试
一、单选题
-
1. 合金的应用促进了人类社会的发展。下列不属于合金的是
A.青铜面具
B.铝合金滑雪杖
C.不锈钢锅
D.塑料管材



 A、A B、B C、C D、D2. 下列元素中,属于第三周期的是A、H B、N C、O D、Cl3. 用洁净的铂丝蘸取溶液放在煤气灯外焰里灼烧,可观察到火焰的颜色为( )A、紫色 B、黄色 C、绿色 D、红色4. 下列仪器不能用于加热的是( )A、
A、A B、B C、C D、D2. 下列元素中,属于第三周期的是A、H B、N C、O D、Cl3. 用洁净的铂丝蘸取溶液放在煤气灯外焰里灼烧,可观察到火焰的颜色为( )A、紫色 B、黄色 C、绿色 D、红色4. 下列仪器不能用于加热的是( )A、 B、
B、 C、
C、 D、
D、 5. 下列物质与Cl2反应,能发出苍白色火焰的是( )A、H2 B、Na C、Fe D、Cu6. 下列化学反应基本类型中一定是氧化还原反应的是A、化合反应 B、分解反应 C、复分解反应 D、置换反应7. 下列关于物质的分类的说法中,错误的是A、属于酸 B、属于碱 C、属于酸性氧化物 D、液氯属于纯净物8. 下列物质中,属于电解质的是A、 B、稀硫酸 C、 D、9. 下列粒子不具有还原性的是A、 B、 C、 D、10. 下列电离方程式书写错误的是A、 B、 C、 D、11. 下列物质放置在空气中,因发生氧化还原反应而变质的是A、 B、 C、NaCl D、12. 下列反应能用表示的是A、 B、 C、 D、13. 下列关于的说法中,错误的是A、是淡黄色固体 B、氧元素的化合价为-2价 C、能与水发生反应 D、可在潜水艇中作为氧气的来源14. 红热的铁与水蒸气反应,产物是A、、 B、、 C、、 D、、15. 实验室中,下列行为不符合安全要求的是A、在通风橱内制备有毒气体 B、稀释浓硫酸时,将水注入浓硫酸中 C、用干燥沙土覆盖少量燃着的金属钠 D、闻氯气时,用手在瓶口轻轻扇动,使极少量的氯气飘进鼻孔16. 下列化学用语错误的是A、的原子结构示意图是:
5. 下列物质与Cl2反应,能发出苍白色火焰的是( )A、H2 B、Na C、Fe D、Cu6. 下列化学反应基本类型中一定是氧化还原反应的是A、化合反应 B、分解反应 C、复分解反应 D、置换反应7. 下列关于物质的分类的说法中,错误的是A、属于酸 B、属于碱 C、属于酸性氧化物 D、液氯属于纯净物8. 下列物质中,属于电解质的是A、 B、稀硫酸 C、 D、9. 下列粒子不具有还原性的是A、 B、 C、 D、10. 下列电离方程式书写错误的是A、 B、 C、 D、11. 下列物质放置在空气中,因发生氧化还原反应而变质的是A、 B、 C、NaCl D、12. 下列反应能用表示的是A、 B、 C、 D、13. 下列关于的说法中,错误的是A、是淡黄色固体 B、氧元素的化合价为-2价 C、能与水发生反应 D、可在潜水艇中作为氧气的来源14. 红热的铁与水蒸气反应,产物是A、、 B、、 C、、 D、、15. 实验室中,下列行为不符合安全要求的是A、在通风橱内制备有毒气体 B、稀释浓硫酸时,将水注入浓硫酸中 C、用干燥沙土覆盖少量燃着的金属钠 D、闻氯气时,用手在瓶口轻轻扇动,使极少量的氯气飘进鼻孔16. 下列化学用语错误的是A、的原子结构示意图是: B、的电子式是:
C、的分子结构模型是:
B、的电子式是:
C、的分子结构模型是: D、的形成过程是:
D、的形成过程是: 17. 下列关于物质性质的比较,正确的是A、金属性:Al>Na B、稳定性:HCl<HBr C、酸性: D、碱性:18. 下列各组离子中,能在溶液中大量共存的是A、、、、 B、、、、 C、、、、 D、、、、19. 铈()是稀土元素中丰度最高的元素,广泛应用于医药、玻璃、纺织等工业。下列关于和的说法中,正确的是A、和互为同位素 B、和都含有58个中子 C、和含有不同的质子数 D、和含有不同的电子数20. 下列转化不能通过一步反应实现的是A、 B、 C、 D、21. 下列离子方程式书写错误的是A、向KI溶液中滴加溴水: B、氯气溶于水: C、硝酸银溶液与盐酸反应: D、钠与水反应:22. 下列说法中,正确的是A、的摩尔质量是56g B、常温常压下,1的体积是22.4L C、0.1溶液中含有0.2 D、1中含有的分子数约为23. 图a~c分别为在不同条件下的导电实验(X、Y均表示石墨电极)的微观示意图。
17. 下列关于物质性质的比较,正确的是A、金属性:Al>Na B、稳定性:HCl<HBr C、酸性: D、碱性:18. 下列各组离子中,能在溶液中大量共存的是A、、、、 B、、、、 C、、、、 D、、、、19. 铈()是稀土元素中丰度最高的元素,广泛应用于医药、玻璃、纺织等工业。下列关于和的说法中,正确的是A、和互为同位素 B、和都含有58个中子 C、和含有不同的质子数 D、和含有不同的电子数20. 下列转化不能通过一步反应实现的是A、 B、 C、 D、21. 下列离子方程式书写错误的是A、向KI溶液中滴加溴水: B、氯气溶于水: C、硝酸银溶液与盐酸反应: D、钠与水反应:22. 下列说法中,正确的是A、的摩尔质量是56g B、常温常压下,1的体积是22.4L C、0.1溶液中含有0.2 D、1中含有的分子数约为23. 图a~c分别为在不同条件下的导电实验(X、Y均表示石墨电极)的微观示意图。
下列说法中,错误的是
A、图a中的 代表的离子是
B、图a表示的是干燥的固体不导电
C、由图b可知在通电条件下才能发生电离
D、由图b和c均可判断,X是与电源正极相连的电极
24. 某白色粉末可能含有、、 , 进行如下实验:
代表的离子是
B、图a表示的是干燥的固体不导电
C、由图b可知在通电条件下才能发生电离
D、由图b和c均可判断,X是与电源正极相连的电极
24. 某白色粉末可能含有、、 , 进行如下实验:①将少量粉末加入水中,振荡,有白色沉淀生成
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生
③取少量②的溶液,滴入溶液,有白色沉淀生成
依据实验现象,下列关于白色粉末的判断正确的是
A、只含有 B、一定含有、和 C、一定含有和 , 可能含有 D、一定含有 , 还含有和中的一种25. 利用废铝箔(主要成分为Al,含少量Mg、Fe等)制明矾的一种工艺流程如下:铝箔甲溶液乙溶液明矾
下列说法中,错误的是
A、①中加NaOH溶液,发生反应的离子方程式是 B、操作a是过滤 C、乙溶液中含有的离子是、 D、由④可推测,室温下明矾的溶解度小于和的溶解度二、填空题
-
26. 补齐物质与其用途之间的连线。
物质 用途
A.二氧化氯 a.蚀刻铜板
B.氯化铁 b.焙制糕点
C.碳酸氢钠 c.自来水消毒
27. 某工厂废水中含有大量的和较多的 , 为了减少污染并变废为宝,通过以下反应从废水中回收和:① ②(1)、反应①中,化合价升高的元素是(填元素符号),氧化剂是(填化学式)。(2)、反应②中若每消耗1 , 则生成的体积约是L(标准状况),转移电子的物质的量为。28. 为对比和的性质,某同学进行如下实验,补全下表。实验装置及操作



实验现象
盛有 (填化学式)试管中温度计示数升高
盛有的试管中固体完全溶解;盛有的试管中固体有剩余
实验结论或解释
相同温度下,溶解度:(填“>”、“<”或“=”)
很稳定,受热不易分解;不稳定,受热容易分解
29. 阅读下面一段材料并回答问题。
ZnO是锌的一种氧化物,不溶于水、乙醇,可溶于大多数酸、强碱等,在浓氢氧化钠溶液中可生成。
ZnO有着广泛的用途。它可用作白色颜料,俗称锌白,其优点是遇酸性气体不变黑,因为生成的ZnS也是白色的。ZnO也可用于某些化工原料气的脱硫,利用ZnO水悬浊液吸收 , 再通入空气,最终可得到。ZnO具有收敛作用,可杀菌并且加速伤口愈合,在医药上常调制成软膏。ZnO还是新一代的光电半导体材料,因其具有良好的抗辐射性能,可以在太空等环境应用。
工业上有多种制备ZnO的方法,直接沉淀法是其中一种。该法是以可溶性锌盐和一水合氨()为原料,发生如下反应:;。用此法可以制得纳米级ZnO,其在磁、光、电、敏感性等方面具有普通ZnO无法比拟的特殊性能和新用途。
(1)、根据ZnO的性质可知它属于(填字母)。a.酸性氧化物 b.碱性氧化物 c.两性氧化物
(2)、ZnO遇发生反应的化学方程式是。(3)、判断下列说法是否正确(填“对”或“错”)①ZnO用于工业脱硫的反应方程式为。
②ZnO可用作光电半导体材料。
③用一水合氨制备ZnO的反应不是氧化还原反应。
④纳米级ZnO和普通ZnO粒子大小不同,性能有所不同。
30. 硫氰化钾(KSCN)不仅用作化学检测试剂,还可用于农药、医药、电镀等。KSCN可通过以下反应得到:。回答下列问题:(1)、上述反应的产物中,属于共价化合物的物质有种。(2)、写出的电子式:。(3)、存在的化学键类型是(填字母,下同)。a.只含有离子键 b.只含有共价键 c.既含有离子键又含有共价键
(4)、上述反应涉及的多种元素中①K在元素周期表中的位置是。
②属于第二周期且非金属性由弱到强的顺序为。从原子结构角度解释原因:在同一周期中, , 得电子能力逐渐增强,非金属性逐渐增强。
(5)、下列事实能说明非金属性N强于P的是。a.常温下化学性质稳定 b.的沸点低于红磷的沸点
c.受热分解的温度高于 d.的酸性强于
31. 实验室用固体配制1001.00溶液,回答下列问题。(1)、计算需要固体的质量为g。[](2)、配制溶液时,必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒、。(3)、下列情况中,会使所配溶液浓度偏低的是(填字母)。a.烧杯不干燥 b.转移液体时,有少量液体洒出
32. 用下图所示装置在实验室制取纯净、干燥的并探究其性质,回答下列问题: (1)、发生装置中制取的化学方程式是。(2)、除杂装置①中的试剂是。(3)、将虚线框中的收集装置补充完整。(4)、尾气处理装置中发生反应的离子方程式是。(5)、将制得的溶于水得到氯水。在探究新制氯水成分及性质的实验中,依据下列操作和现象不能得出相应结论的是(填字母)。
(1)、发生装置中制取的化学方程式是。(2)、除杂装置①中的试剂是。(3)、将虚线框中的收集装置补充完整。(4)、尾气处理装置中发生反应的离子方程式是。(5)、将制得的溶于水得到氯水。在探究新制氯水成分及性质的实验中,依据下列操作和现象不能得出相应结论的是(填字母)。操作
现象
结论
a
观察氯水颜色
氯水呈黄绿色
氯水中含
b
向饱和溶液中加入足量氯水
有无色气体产生
氯水中含HClO
c
向红色纸条上滴加氯水
红色纸条褪色
氯水具有漂白性
d
向淀粉碘化钾试纸上滴加少量氯水
试纸变蓝
氯水具有氧化性
33. 实验小组发现新配制的溶液放置一段时间,由浅绿色溶液变为黄色浊液A,进行如下探究。资料:i.胶体可以透过滤纸。 ii.与溶液反应,生成蓝色沉淀。
(1)、探究A中的成分,进行如下实验。①取少量A,过滤得到红褐色沉淀和黄色透明液体B。
②取少量B于试管中,加入溶液,(填现象)。
③取少量B于试管中,加入(填试剂),液体变为红色。
④用激光笔照射B,看到一条光亮的“通路”。
综合上述实验,说明A中铁元素的存在形态有、、和。
(2)、进一步探究B显黄色的原因。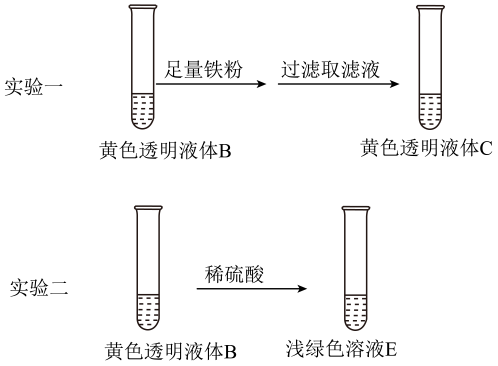
①实验一中,加入铁粉的作用是(用离子方程式表示)。
②由上述实验得出:B显黄色的主要原因不是因为含有 , 而是因为含有。理由是: 。
(3)、测定A的变质程度并分析对后续实验的影响。①取25.00mL A,加入足量稀硫酸,可与24.00mL溶液恰好完全反应。已知在酸性环境下被还原为 , A中的浓度为 , 说明其主要成分仍然是。
②下列实验可以使用A进行的是(填字母)。
a.向A中滴入NaOH溶液,制备纯净的沉淀
b.用A处理含有+6价Cr的酸性废水,将剧毒的+6价Cr还原至低毒的+3价
经过上述探究,实验小组对溶液的配制与使用有了更深入的理解。
34. 硫酸渣是硫酸生产过程中产生的固体废料,主要化学成分有、、等。含氯废气是海绵钛冶炼过程中产生的和的混合气。可利用两种废料来制备聚合氯化铁。实验室模拟该生产过程如下图所示:
已知:是难溶于水的酸性氧化物。
(1)、吸收过程中硫酸渣浆液中的全部转化为 , 写出反应的离子方程式、。(2)、过滤除杂后所得废渣的主要成分是。(3)、硫酸渣浆液中水与硫酸渣的质量比称为液固比。其他条件相同时,在相同时间内不同液固比对铁元素利用率的影响如图所示。由图可知液固比为3∶1和5∶1时铁元素利用率均较高,而实际工业生产中选择液固比为3∶1,从后续处理能耗的角度分析,原因是。 (4)、制备时,需在剧烈搅拌下,向所得高浓度的溶液中缓慢滴加溶液至预定的比例。
(4)、制备时,需在剧烈搅拌下,向所得高浓度的溶液中缓慢滴加溶液至预定的比例。①补全反应的化学方程式:
②上述制备过程中,不能快速滴加溶液的原因是。
(5)、测定聚合氯化铁液体产品中铁元素的质量分数。取a g样品加水稀释,在不断搅拌下加入溶液调至 , 此时铁元素全部转化为沉淀,过滤、洗涤并灼烧所得沉淀,最终得到b g红棕色固体。则产品中铁元素的质量分数为。