北京市海淀区2022-2023学年高一上学期期末考试化学试题
试卷更新日期:2023-02-06 类型:期末考试
一、单选题
-
1. 随着神舟十五号飞船的成功发射,6名中国航天员在空间站实现在轨交接。空间站中有一套完善的再生式环境控制与生命保障系统,可实现舱内氧气和水的循环利用,保障航天员长时间在轨驻留的需求。下列过程属于物理变化的是
 A、长征二号遥十五火箭点火发射 B、冷凝回收舱内的水蒸气 C、利用循环水电解制氧气 D、还原去除舱内的二氧化碳2. 当光束通过下列分散系时,能观察到丁达尔效应的是A、胶体 B、溶液 C、蔗糖溶液 D、溶液3. 下列物质中,属于电解质的是A、乙醇 B、 C、 D、溶液4. 下列关于物质分类的叙述中,错误的是A、H2SO4属于酸 B、KOH属于碱 C、NO属于氧化物 D、石灰水属于纯净物5. 下列关于过氧化钠的说法中,错误的是( )A、化学式为Na2O2 B、白色固体 C、能与H2O反应 D、能与CO2反应6. 常温下,下列物质可用铁制容器盛装的是( )A、盐酸 B、硫酸铜溶液 C、氯化铁溶液 D、浓硫酸7. 下列转化需要通过氧化还原反应才能实现的是A、 B、 C、 D、8. 下列行为不符合实验安全要求的是A、熄灭酒精灯时,用灯帽盖灭 B、稀释浓硫酸时,将水注入浓硫酸中 C、点燃氢气前,先进行验纯操作 D、熄灭少量燃着的金属钠,用干燥沙土覆盖9. 下列方程式与所给事实不相符的是A、用溶液刻蚀电路板上的铜箔: B、蔗糖中加入浓硫酸,产生大量气体:(浓) C、次氯酸见光分解: D、钠放置在空气中表面会变暗:10. 下列说法中,错误的是A、的质量是71 g B、中含有的分子数约为 C、常温常压下,的物质的量为 D、溶液中含有11. 实验室用下图装置制备干燥的并研究其性质。其中,a为湿润的淀粉试纸,b、c分别为湿润和干燥的红纸条,d为湿润的蓝色石蕊试纸。
A、长征二号遥十五火箭点火发射 B、冷凝回收舱内的水蒸气 C、利用循环水电解制氧气 D、还原去除舱内的二氧化碳2. 当光束通过下列分散系时,能观察到丁达尔效应的是A、胶体 B、溶液 C、蔗糖溶液 D、溶液3. 下列物质中,属于电解质的是A、乙醇 B、 C、 D、溶液4. 下列关于物质分类的叙述中,错误的是A、H2SO4属于酸 B、KOH属于碱 C、NO属于氧化物 D、石灰水属于纯净物5. 下列关于过氧化钠的说法中,错误的是( )A、化学式为Na2O2 B、白色固体 C、能与H2O反应 D、能与CO2反应6. 常温下,下列物质可用铁制容器盛装的是( )A、盐酸 B、硫酸铜溶液 C、氯化铁溶液 D、浓硫酸7. 下列转化需要通过氧化还原反应才能实现的是A、 B、 C、 D、8. 下列行为不符合实验安全要求的是A、熄灭酒精灯时,用灯帽盖灭 B、稀释浓硫酸时,将水注入浓硫酸中 C、点燃氢气前,先进行验纯操作 D、熄灭少量燃着的金属钠,用干燥沙土覆盖9. 下列方程式与所给事实不相符的是A、用溶液刻蚀电路板上的铜箔: B、蔗糖中加入浓硫酸,产生大量气体:(浓) C、次氯酸见光分解: D、钠放置在空气中表面会变暗:10. 下列说法中,错误的是A、的质量是71 g B、中含有的分子数约为 C、常温常压下,的物质的量为 D、溶液中含有11. 实验室用下图装置制备干燥的并研究其性质。其中,a为湿润的淀粉试纸,b、c分别为湿润和干燥的红纸条,d为湿润的蓝色石蕊试纸。
用上述装置制备 , 所选反应物和收集方法正确的是
选项
A
B
C
D
反应物
浓盐酸和
浓盐酸和
稀盐酸和
浓盐酸和高锰酸钾
收集方法
向上排空气法
向下排空气法
向上排空气法
排水法
A、A B、B C、C D、D12. 实验室用下图装置制备干燥的并研究其性质。其中,a为湿润的淀粉试纸,b、c分别为湿润和干燥的红纸条,d为湿润的蓝色石蕊试纸。
为达成实验目的,甲、乙、丙中所用试剂错误的是
A、甲中为饱和食盐水 B、甲中为浓硫酸 C、乙中为浓硫酸 D、丙中为溶液13. 实验室用下图装置制备干燥的并研究其性质。其中,a为湿润的淀粉试纸,b、c分别为湿润和干燥的红纸条,d为湿润的蓝色石蕊试纸。
下列关于实验现象及性质的说法中,错误的是
A、一段时间后,观察到a变蓝 B、b褪色,说明具有漂白性 C、b褪色而c不褪色,说明能与水反应 D、d先变红,一段时间后褪色14. 营养液是无土栽培的核心和关键,某营养液中含4种离子(忽略微量离子),对离子浓度的要求如下表所示。离子种类
浓度()
____
0.03
0.03
0.01
该营养液中的物质的量浓度为
A、 B、 C、 D、15. 营养液是无土栽培的核心和关键,某营养液中含4种离子(忽略微量离子),对离子浓度的要求如下表所示。离子种类
浓度()
____
0.03
0.03
0.01
用下列物质配成满足上述离子浓度要求的营养液,其他离子对植物的影响可忽略,符合要求的一组是
A、和 B、和 C、、和 D、、和16. 氮循环是海洋生态系统的基础和关键,其中无机氮循环过程如下图所示。
亚硝酸盐是氮循环中的重要物质。下列关于亚硝酸钠性质的推测中,不合理的是资料:为弱酸,在碱性条件下能稳定存在。
A、具有氧化性 B、具有还原性 C、能与反应 D、能与反应17. 氮循环是海洋生态系统的基础和关键,其中无机氮循环过程如下图所示。
下列关于海洋无机氮循环的说法中,错误的是
A、过程2中,可能需要参与反应 B、过程3中,发生的均为还原反应 C、过程4中,生成至少转移电子 D、过程5中,反应后氮元素的化合价均降低18. 粗食盐水中常含有少量、、 , 实验室提纯粗食盐水制取食盐的流程如下。
滤液1中,不可能大量存在的离子是
A、 B、 C、 D、19. 粗食盐水中常含有少量、、 , 实验室提纯粗食盐水制取食盐的流程如下。
下列关于粗食盐水提纯的说法中,错误的是
A、过程ii的目的是除去 B、过程i和ii的顺序可互换 C、过程iii中加入的试剂X为 D、沉淀3的成分是20. 粗食盐水中常含有少量、、 , 实验室提纯粗食盐水制取食盐的流程如下。
整个提纯过程中,未用到的实验仪器是
A、蒸发皿 B、玻璃棒 C、漏斗 D、烧瓶21. 用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化呈“亮灭亮”的是
A
B
C
D
试剂a
盐酸
硫酸
溶液
蔗糖溶液
试剂b
溶液
溶液
溶液
蒸馏水
A、A B、B C、C D、D22. 下列“实验结论”与“实验操作及现象”相符的一组是选项
实验操作及现象
实验结论
A
将通入酸性溶液,溶液紫色很快褪去
具有漂白性
B
向某溶液中加入溶液,生成的白色沉淀迅速变为灰绿色,最终变为红褐色
溶液一定含有
C
向某溶液中滴加溶液,产生白色沉淀
溶液中一定含有
D
将某气体通入澄清石灰水,澄清石灰水变浑浊
该气体一定是
A、A B、B C、C D、D二、填空题
-
23. 补齐物质与其用途的连线,并回答问题。
用途
物质
A.去除某些有机溶剂中的水分————————————
a.
B.84消毒液的有效成分
b.
C.厨房中的食用碱
c.
D.打印机墨粉中的磁性成分
d.
(1)、上图连线(2)、上述的用途,利用了它的(填“物理”或“化学”)性质。(3)、可以去除某些有机溶剂中的水分,用化学方程式解释其原因:。24. 我国科学家用人工合成淀粉时,第一步需要将转化为甲醇,反应的化学方程式为:。(1)、做还原剂的物质是 , 碳元素的化合价(填“升高”或“降低”)。(2)、反应中每生成 , 消耗的物质的量是mol,转移电子的物质的量是mol。三、综合题
-
25. 实验小组同学需要配制溶液。方法如下:
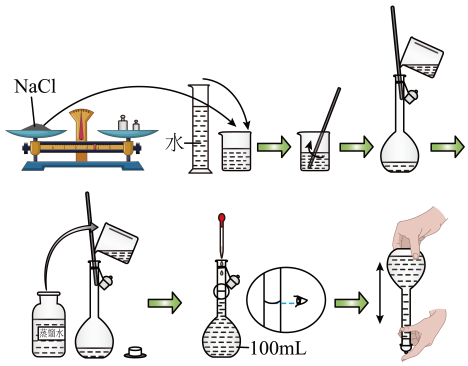 (1)、需要称取的质量为g。(2)、为完成实验,必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒和。(3)、在转移溶液时,玻璃棒的作用是。(4)、配制过程中,下列操作会导致所配溶液物质的量浓度偏小的是____(填字母)。A、配制溶液所用的容量瓶洗净后没有烘干 B、转移溶液后,未洗涤烧杯和玻璃棒就直接定容 C、摇匀后,发现溶液的凹液面低于刻度线,又滴加几滴蒸馏水26. 某小组用如下装置制备并探究的性质。
(1)、需要称取的质量为g。(2)、为完成实验,必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒和。(3)、在转移溶液时,玻璃棒的作用是。(4)、配制过程中,下列操作会导致所配溶液物质的量浓度偏小的是____(填字母)。A、配制溶液所用的容量瓶洗净后没有烘干 B、转移溶液后,未洗涤烧杯和玻璃棒就直接定容 C、摇匀后,发现溶液的凹液面低于刻度线,又滴加几滴蒸馏水26. 某小组用如下装置制备并探究的性质。 (1)、制备时发生反应的化学方程式为。若所用硫酸的浓度较低,反应时观察不到气泡产生,可能的原因是。(2)、能体现与水反应生成酸性物质的实验现象是。(3)、②中观察到淡黄色固体生成,说明具有(填“氧化”或“还原”)性。(4)、③中观察到蓝色褪去,发生反应的离子方程式为。(5)、蘸有溶液的棉花的作用是。27. 某补铁剂的主要成分是硫酸亚铁(),说明书中建议“本品与维生素C同服”。小组同学为探究其原理,用放置7天的溶液()进行下列实验。
(1)、制备时发生反应的化学方程式为。若所用硫酸的浓度较低,反应时观察不到气泡产生,可能的原因是。(2)、能体现与水反应生成酸性物质的实验现象是。(3)、②中观察到淡黄色固体生成,说明具有(填“氧化”或“还原”)性。(4)、③中观察到蓝色褪去,发生反应的离子方程式为。(5)、蘸有溶液的棉花的作用是。27. 某补铁剂的主要成分是硫酸亚铁(),说明书中建议“本品与维生素C同服”。小组同学为探究其原理,用放置7天的溶液()进行下列实验。资料:维生素又称抗坏血酸,易溶于水,其溶液呈酸性。
(1)、I.检验铁元素的价态
实验序号
试管中的试剂
实验操作及现象
i
2 mL放置后的溶液
滴加5滴KSCN溶液后,溶液变为浅红色
ii
2 mL放置后的溶液,0.1 g维生素C
维生素C溶解,溶液 , 滴加5滴KSCN溶液后,溶液 仍呈无色
i中观察到 , 说明溶液中存在。将氧化的物质是。
(2)、①小组同学推测,ii中溶液仍为无色是因为维生素与发生了反应。补全该反应的离子方程式。□□_□_
②甲同学认为,可以取ii中溶液加入酸性溶液验证反应产物。乙同学认为该方法不可行,理由是。
(3)、丙同学认为ii中检验方案不严谨,应考虑pH对反应的影响,依据是。(4)、II.探究pH对ii中反应的影响小组同学补充了如下实验,继续探究pH对ii中反应的影响。
实验序号
试剂
实验操作及现象
iii

滴加5滴KSCN溶液后,溶液变为浅红色,浅红色比i中加深
判断下列关于实验结论的说法是否正确 (填“对”或“错”)。
①pH对与的显色反应有影响。
②加维生素后 , 导致ii中未末检测出。
(5)、反思实验i~iii,下列说法合理的是 (填序号)。a.维生素C具有氧化性和酸性
b.同服维生素C可减缓补铁剂中被氧化
c.使用KSCN检验时,宜先将溶液酸化
28. 高铁酸钾( , 其中元素为价)是新型绿色水处理剂,其制备方法如下图所示(部分步骤已略去)。已知:在碱性溶液中的溶解度:
 (1)、过程I的目的是制备 , 反应的离子方程式为。(2)、过程II为碱性条件下制备高铁酸钠()。
(1)、过程I的目的是制备 , 反应的离子方程式为。(2)、过程II为碱性条件下制备高铁酸钠()。①补全过程II中发生反应的离子方程式:
□□□_=□□_□_。
②除外,过程II中还可能生成一种含铁元素的难溶性杂质,该物质的化学式为。
(3)、过程III中,发生反应的化学方程式为。(4)、过程I~III中,需要进行过滤操作的是(填序号)。(5)、可将氨氮废水中的转化为除去。从价态角度分析,能处理氨氮废水的原因是。