北京市昌平区2022-2023学年高一上学期期末考试化学试题
试卷更新日期:2023-02-06 类型:期末考试
一、单选题
-
1. 钧瓷是中国古代五大名瓷之一,以其独特的釉料及烧制方法而闻名于世。下列钧瓷的制作工艺中,主要发生了化学变化的是( )
A.掘泥
B.做坯
C.画坯
D.烧炉



 A、A B、B C、C D、D2. 当光束通过下列物质时,会出现丁达尔效应的是A、CuSO4溶液 B、Fe(OH)3胶体 C、蔗糖溶液 D、KCl溶液3. 下列气体为红棕色的是( )A、Cl2 B、NO2 C、HCl D、NH34. 常温下,下列物质中难溶于水的是A、AgNO3 B、MgCl2 C、BaSO4 D、Na2CO35. 下列物质分别加入水中,主要以离子形式存在的是( )A、CaCO3 B、Zn C、FeO D、NaOH6. 下列有关物质分类的叙述中,错误的是A、硝酸属于酸 B、纯碱属于碱 C、硫酸亚铁属于盐 D、液氯属于纯净物7. 下列物质中属于碱性氧化物的是A、HCl B、NO2 C、NO D、CaO8. 常温常压下,下列关于SO2性质的说法中,错误的是A、无色气体 B、有刺激性气味 C、难溶于水 D、密度比空气大9. 下列关于钠单质的描述错误的是A、是一种活泼金属单质 B、可与氯气反应 C、有较强的还原性 D、在空气中燃烧生成白色固体10. 下列反应中,不属于氧化还原反应的是A、2Fe3++Cu=2Fe2++Cu2+ B、2KClO32KCl+3O2↑ C、2NaOH+CO2=Na2CO3+H2O D、Fe+2HCl=FeCl2+H2↑11. 下列变化需要加入氧化剂才能实现的是( )A、KI→I2 B、CO2→CO C、N2O5→HNO3 D、NaClO3→Cl212. 下列关于物质用途的说法错误的是A、NH3可作为原料制备HNO3 B、SO2可作为食品添加剂 C、Na2O可作为潜水艇的供氧剂 D、Fe3O4可作为一种磁性材料13. 向某浓度的Ba(OH)2溶液中,滴入稀H2SO4 , 溶液电导率随时间变化的曲线如图所示。下列分析正确的是
A、A B、B C、C D、D2. 当光束通过下列物质时,会出现丁达尔效应的是A、CuSO4溶液 B、Fe(OH)3胶体 C、蔗糖溶液 D、KCl溶液3. 下列气体为红棕色的是( )A、Cl2 B、NO2 C、HCl D、NH34. 常温下,下列物质中难溶于水的是A、AgNO3 B、MgCl2 C、BaSO4 D、Na2CO35. 下列物质分别加入水中,主要以离子形式存在的是( )A、CaCO3 B、Zn C、FeO D、NaOH6. 下列有关物质分类的叙述中,错误的是A、硝酸属于酸 B、纯碱属于碱 C、硫酸亚铁属于盐 D、液氯属于纯净物7. 下列物质中属于碱性氧化物的是A、HCl B、NO2 C、NO D、CaO8. 常温常压下,下列关于SO2性质的说法中,错误的是A、无色气体 B、有刺激性气味 C、难溶于水 D、密度比空气大9. 下列关于钠单质的描述错误的是A、是一种活泼金属单质 B、可与氯气反应 C、有较强的还原性 D、在空气中燃烧生成白色固体10. 下列反应中,不属于氧化还原反应的是A、2Fe3++Cu=2Fe2++Cu2+ B、2KClO32KCl+3O2↑ C、2NaOH+CO2=Na2CO3+H2O D、Fe+2HCl=FeCl2+H2↑11. 下列变化需要加入氧化剂才能实现的是( )A、KI→I2 B、CO2→CO C、N2O5→HNO3 D、NaClO3→Cl212. 下列关于物质用途的说法错误的是A、NH3可作为原料制备HNO3 B、SO2可作为食品添加剂 C、Na2O可作为潜水艇的供氧剂 D、Fe3O4可作为一种磁性材料13. 向某浓度的Ba(OH)2溶液中,滴入稀H2SO4 , 溶液电导率随时间变化的曲线如图所示。下列分析正确的是 A、Ba(OH)2溶液中存在的主要微粒有:Ba2+、OH-、Ba(OH)2 B、a→b过程中主要发生的反应是Ba2++SO=BaSO4↓ C、b→c过程中电导率增加是因为BaSO4电离出Ba2+和SO D、a、b、c中,c(Ba2+)最大的一定是a14. 下列解释相应实验现象或事实的离子方程式中错误的是A、Na加入滴有酚酞的水中溶液变红:2Na+2H2O=2Na++2OH-+H2↑ B、氢氧化钠溶液可用于制备氢氧化铁:Fe3++3OH-=Fe(OH)3↓ C、向铁粉中加入稀硫酸可得到硫酸亚铁溶液:Fe+2H++SO=FeSO4+H2↑ D、铜粉与稀HNO3反应产生无色气体:3Cu+8H++2NO=3Cu2++2NO↑+4H2O15. 下列实验过程中的颜色变化,与氧化还原反应无关的是A、淡黄色Na2O2固体露置于空气中,逐渐变成白色 B、氯化亚铁溶液中滴加氯水,溶液颜色发生变化 C、向硫酸铜溶液中滴加氢氧化钠溶液,生成蓝色沉淀 D、铜与浓硫酸反应,生成蓝色溶液16. 实验室进行氨的制备、收集及性质实验。有以下制备、收集装置可供选择,下列说法正确的是
A、Ba(OH)2溶液中存在的主要微粒有:Ba2+、OH-、Ba(OH)2 B、a→b过程中主要发生的反应是Ba2++SO=BaSO4↓ C、b→c过程中电导率增加是因为BaSO4电离出Ba2+和SO D、a、b、c中,c(Ba2+)最大的一定是a14. 下列解释相应实验现象或事实的离子方程式中错误的是A、Na加入滴有酚酞的水中溶液变红:2Na+2H2O=2Na++2OH-+H2↑ B、氢氧化钠溶液可用于制备氢氧化铁:Fe3++3OH-=Fe(OH)3↓ C、向铁粉中加入稀硫酸可得到硫酸亚铁溶液:Fe+2H++SO=FeSO4+H2↑ D、铜粉与稀HNO3反应产生无色气体:3Cu+8H++2NO=3Cu2++2NO↑+4H2O15. 下列实验过程中的颜色变化,与氧化还原反应无关的是A、淡黄色Na2O2固体露置于空气中,逐渐变成白色 B、氯化亚铁溶液中滴加氯水,溶液颜色发生变化 C、向硫酸铜溶液中滴加氢氧化钠溶液,生成蓝色沉淀 D、铜与浓硫酸反应,生成蓝色溶液16. 实验室进行氨的制备、收集及性质实验。有以下制备、收集装置可供选择,下列说法正确的是 A、选用b装置制备氨气,试管中加入固体氢氧化钙,分液漏斗中加入氯化铵溶液 B、选用e装置收集氨气,因为氨气比空气轻且易溶于水 C、氨能发生喷泉实验,利用了氨易液化的性质 D、氨气可与盐酸反应,体现了氨气的还原性17. 下列说法中,错误的是A、任意温度和压强下,2molH2O的质量都是36g B、常温常压下,等体积的N2和CO所含分子数相同 C、配制500mL0.1mol/LNaOH溶液,需要NaOH的质量为2g D、0.1mol•L-1KCl溶液中含有0.1molK+18. 汽车尾气中的NOx、CO、碳氢化合物通过排气系统的净化装置(催化剂主要由Rh、Pd、Pt等物质和稀土材料组成)转化过程如图。下列分析错误的是
A、选用b装置制备氨气,试管中加入固体氢氧化钙,分液漏斗中加入氯化铵溶液 B、选用e装置收集氨气,因为氨气比空气轻且易溶于水 C、氨能发生喷泉实验,利用了氨易液化的性质 D、氨气可与盐酸反应,体现了氨气的还原性17. 下列说法中,错误的是A、任意温度和压强下,2molH2O的质量都是36g B、常温常压下,等体积的N2和CO所含分子数相同 C、配制500mL0.1mol/LNaOH溶液,需要NaOH的质量为2g D、0.1mol•L-1KCl溶液中含有0.1molK+18. 汽车尾气中的NOx、CO、碳氢化合物通过排气系统的净化装置(催化剂主要由Rh、Pd、Pt等物质和稀土材料组成)转化过程如图。下列分析错误的是 A、该净化装置可将有毒的氮氧化物转化为无毒的氮气 B、该过程中CO是还原剂 C、该过程中NOx发生了还原反应 D、该过程中,碳氢化合物没有发生反应19. 某小组同学利用如图1装置制备NaClO溶液,并设计实验(如图2所示)探究NaClO的性质。
A、该净化装置可将有毒的氮氧化物转化为无毒的氮气 B、该过程中CO是还原剂 C、该过程中NOx发生了还原反应 D、该过程中,碳氢化合物没有发生反应19. 某小组同学利用如图1装置制备NaClO溶液,并设计实验(如图2所示)探究NaClO的性质。
关于图1,下列说法错误的是
A、A中反应体现了浓盐酸的酸性和氧化性 B、B的作用是吸收挥发出的HCl气体 C、C中的反应是:Cl2+2OH-=ClO-+Cl-+H2O D、D的作用是尾气吸收20. 某小组同学利用如图1装置制备NaClO溶液,并设计实验(如图2所示)探究NaClO的性质。
关于图2,下列说法错误的是
A、I中溶液褪色的原因是:稀硫酸的加入,减弱了溶液的碱性 B、II中使溶液褪色的物质是HClO C、III中产生黄绿色气体的可能原因是:ClO-+Cl-+2H+=Cl2+H2O D、对比I和III可知,加入的酸的浓度不同,发生的反应不同二、多选题
-
21. 某小组为探究氯水的成分与性质,进行实验并观察到以下现象,由实验现象得出的结论不合理的是
选项
实验操作
实验现象
结论
A
向NaHCO3溶液中滴加氯水
产生能使澄清石灰水变浑浊的气体
氯水中含有H+
B
向稀HNO3酸化的AgNO3溶液中滴加氯水
产生白色沉淀
氯水中含有Cl-
C
向Na2S溶液中滴加氯水
产生黄色沉淀
氯水既具有氧化性又具有还原性
D
向加入淀粉的KI溶液中逐滴中滴加氯水至过量
先变蓝后褪色
氯水可能氧化碘单质
A、A B、B C、C D、D三、综合题
-
22. 某工厂综合处理含NH废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分)的流程如图所示。
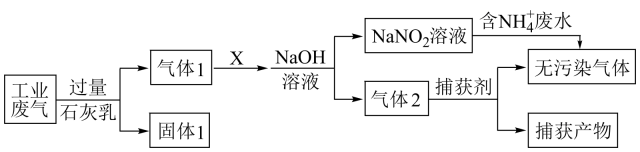 (1)、在括号中写出以下几种物质中加点元素的化合价。
(1)、在括号中写出以下几种物质中加点元素的化合价。NH , N2 , CO。
(2)、写出下列物质的物质类别:SO2 , Ca(OH)2 , 二者发生反应的化学方程式是。(3)、已知:NO+NO2+2NaOH=2NaNO2+H2O,该反应中氧化剂是 , 当吸收NO2mol时,可得到1L0.1mol/L的NaNO2。(4)、推测无污染气体可能是 , 写出推测依据。23. 为除去粗盐水中含有的杂质SO、Ca2+和Mg2+ , 得到精制食盐水,某同学利用NaOH溶液、盐酸、Na2CO3溶液和BaCl2溶液,设计了如图实验流程: (1)、试剂1是。(2)、生成沉淀A的反应的离子方程式是。(3)、溶液B中主要存在的离子有。(4)、在溶液C中加入试剂3发生反应的离子方程式是。24. 自然界的氮循环如图所示,回答下列问题。
(1)、试剂1是。(2)、生成沉淀A的反应的离子方程式是。(3)、溶液B中主要存在的离子有。(4)、在溶液C中加入试剂3发生反应的离子方程式是。24. 自然界的氮循环如图所示,回答下列问题。 (1)、①、②、③中,属于氮的固定的是。(2)、如图为N2转化为HNO3的流程。
(1)、①、②、③中,属于氮的固定的是。(2)、如图为N2转化为HNO3的流程。N2NONO2HNO3
①N2转化为NO的化学方程式是。
②NO2转化为HNO3的反应中,NO2体现性。
(3)、N2也可以转化为NH3 , 写出工业合成氨的化学方程式。(4)、任意写出一个以稀硝酸为原料,制备KNO3的反应的化学方程式。25. 某研究小组用下列装置(夹持装置已略去)研究不同价态硫元素之间的转化。 (1)、实验I中铁丝表面迅速变黑,反应很快停止,其原因是。(2)、实验II中产生大量气体。甲同学猜测该实验实现了→的转化,设计实验证明实现了该转化,实验操作及现象是。(3)、实验III试管A中反应的化学方程式为。
(1)、实验I中铁丝表面迅速变黑,反应很快停止,其原因是。(2)、实验II中产生大量气体。甲同学猜测该实验实现了→的转化,设计实验证明实现了该转化,实验操作及现象是。(3)、实验III试管A中反应的化学方程式为。①若B中为紫色石蕊溶液,现象为。
②若B为Na2S酸性溶液,观察到出现淡黄色的固体,写出反应的离子方程式。
③若B为新制氯水,观察到氯水褪色,推测该反应中硫元素的化合价变化为:由价转化为价;为证实产物中氯元素的存在形式,某同学设计实验:向反应后的试管中加入硝酸酸化的硝酸银溶液,观察到产生白色沉淀,由此得出结论:氯水转化为Cl-。该方案是否合理(填“合理”或者“不合理”),请说明理由(写出2条)、。
26. 甲同学尝试用碳酸氢钠作膨松剂蒸馒头,发现蒸出来的馒头有碱味。(1)、I.解释现象甲对此进行解释:因为碳酸氢钠溶液显碱性。他设计如图所示实验,观察到 , 认为自己的解释正确。
 (2)、乙同学不认同甲的解释,依据是碳酸氢钠受热分解产生的碳酸钠也显碱性,写出该反应的化学方程式。(3)、II.设计复合膨松剂
(2)、乙同学不认同甲的解释,依据是碳酸氢钠受热分解产生的碳酸钠也显碱性,写出该反应的化学方程式。(3)、II.设计复合膨松剂设计原理:碳酸氢钠及碳酸钠均可与酸反应。
乙在实验室中利用盐酸进行模拟实验。设计了如图所示实验装置,发现2个气球均膨胀,写出发生反应的离子方程式、。装置中(填“A”或者“B”)气球膨胀体积更大,请通过计算说明。
该同学利用柠檬酸和小苏打做膨松剂蒸馒头,取得了较为理想的口感。
 (4)、III.调研市售复合膨松剂
(4)、III.调研市售复合膨松剂某产品说明书如图所示。请根据你对膨松剂的了解,任意选取配料表中2种物质,说明他们的不同作用。
配料表:焦磷酸二氢二钠、
碳酸氢钠、碳酸钙、磷酸二
氢钙、酒石酸氢钾、食用玉
米淀粉。
(5)、IV.研究展望除了以上研究问题外,关于如何蒸出口感好、色泽好的馒头,还可以进行很多深入研究,请列举1个你感兴趣的研究问题。
27. 小组同学用FeSO4•7H2O晶体和蒸馏水配制100mL0.5mol•L-1FeSO4溶液(pH为3.3),再进行性质探究实验。(1)、Ⅰ.配制溶液。用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和。
(2)、计算需要FeSO4•7H2O晶体的质量是g。(3)、下列情况中,会使所配溶液浓度不准确的是(填字母)。a.称量晶体后,加入盛有100mL水的烧杯中
b.转移时,洗涤烧杯和玻璃棒
c.定容时,眼睛俯视刻度线
d.定容时,发现液面高于刻度线,将多余溶液倒出
(4)、Ⅱ.性质探究。立即取出一定量配制好的溶液放入2个试管中,分别进行如下实验:
实验ⅰ:滴加氢氧化钠溶液,观察到产生白色沉淀,最后变为红褐色。
实验ⅱ:滴加高锰酸钾溶液,溶液褪色。
实验i中产生白色沉淀的离子方程式是 , 生成红褐色沉淀的化学方程式是。
(5)、实验ii中高锰酸钾将Fe2+转化为。(6)、Ⅲ.对异常现象的探究。配制好的溶液放置1h后,溶液变黄。24h后,产生黄褐色沉淀,测得上层清液pH为1.4。
取少量黄色溶液,(填操作和现象),证明黄色溶液中含有Fe3+。
(7)、取黄色溶液,加入铁粉振荡,溶液由黄色变为浅绿色,反应的离子方程式为。(8)、实验证实,溶液变黄是因为空气中的O2将Fe2+氧化,反应的离子方程式为。(9)、通过下列实验证实,黄褐色沉淀中含有SO。
①证实黄褐色沉淀中含有SO的证据是。
②洗涤黄褐色沉淀的目的是。
(10)、进一步实验证实黄褐色沉淀为Fe(OH)SO4。将反应的离子方程式补充完整:Fe3++_+_=Fe(OH)SO4↓+_。
-