安徽省皖南十校2022-2023学年高一上学期期末测试化学试题
试卷更新日期:2023-02-06 类型:期末考试
一、单选题
-
1. 用于制造下列物品的材料属于新型合金的是




A.下水井盖—生铁
B.美工刀刀片—高碳钢
C.飞机外壳—硬铝
D.储氢合金—La-Ni合金
A、A B、B C、C D、D2. 科学家将铅和氪的原子核对撞,获得了一种质量数为293,中子数为175的超重元素。该元素原子核内中子数与质子数之差是A、47 B、57 C、61 D、2933. 下列各组物质,按酸、碱性氧化物、盐、电解质的顺序排列的是A、硫酸、氧化钙、氯化镁、氯气 B、硝酸、氧化钠、苏打、氯化银 C、醋酸、过氧化钠、小苏打、氧化铜 D、氯化氢、苛性钠、明矾、一氧化碳4. 下列有关物质的性质与用途具有对应关系的是A、受热易分解,可用于治疗胃酸过多症 B、溶液显酸性,可用于蚀刻铜制的电路板 C、具有强氧化性,可用作自来水消毒剂 D、密度比空气大,可用作镁着火时的灭火剂5. 下列关于钠及其氧化物的说法正确的是A、金属钠着火时,可用水扑灭 B、在呼吸面具中,常作供氧剂 C、可用水简单鉴别与 D、可用澄清石灰水鉴别溶液与溶液6. 下列关于氯气的说法正确的是A、氯气在化学反应中能作还原剂 B、干燥的氯气不能使紫色石蕊溶液褪色 C、氯气是难溶于水的黄绿色气体 D、纯净的氢气在氯气中点燃一定发生爆炸7. 等电子体是指含有相同电子数和原子数的分子、离子或基团。下列各组微粒间互为等电子体的是A、和 B、HCl和 C、和CO D、与8. 科学家推算,宇宙中可能存在的第119号未知元素,位于第IA族,有人称为“类钫”。根据周期表中同主族元素的相似性,下列有关“类钫”的预测中正确的是A、其原子半径小于铯的原子半径 B、其形成的单质有较高的熔点 C、“类钫”与钫互为同位素 D、其形成的单质能与水剧烈反应9. 下列关于铁及其氧化物的说法正确的是A、赤铁矿的主要成分是 B、为碱性氧化物,常温下可与水反应生成 C、FeO为黑色固体,在空气中受热会迅速被氧化为 D、中铁元素有+2价和+3价,是混合物10. 将1.28g铜片加入溶液中,完全反应后,下列说法正确的是A、溶液中与之比为2∶1 B、向反应后溶液中滴加KSCN溶液无明显现象 C、铜片有剩余,溶液呈浅绿色,基本不变 D、氧化产物与还原产物的物质的量之比为1∶211. 下列实验无法达到预期实验目的的是 A、用甲制备并收集少量 B、用乙制备少量 C、用丙观察氢氧化钾的焰色 D、用丁比较和的稳定性12. 下列离子方程式书写正确的是A、向稀中滴加少量溶液: B、向中滴加稀盐酸: C、向溶液中通入少量: D、将打磨后的铝片放入NaOH溶液:13. 已知有如下反应:
A、用甲制备并收集少量 B、用乙制备少量 C、用丙观察氢氧化钾的焰色 D、用丁比较和的稳定性12. 下列离子方程式书写正确的是A、向稀中滴加少量溶液: B、向中滴加稀盐酸: C、向溶液中通入少量: D、将打磨后的铝片放入NaOH溶液:13. 已知有如下反应:①
②
根据上述反应,下列说法正确的是
A、反应①中中Br的化合价为+2 B、反应①中氧化性: C、反应②中氧化产物与还原产物的物质的量之比为1∶5 D、反应②中每生成 , 转移5mol电子14. 设为阿伏加德罗常数的值。下列说法正确的是A、中质子数目为 B、14g由CO和组成的混合气体中含有的原子数目为 C、标准状况下,11.2L中含有原子的数目为 D、溶液与足量Cu反应,转移的电子数为15. 高铁酸钾()是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
下列叙述正确的是
A、反应I生成物中可能含有 B、反应II生成的中Fe元素为+3价 C、该生产条件下,物质的溶解性: D、该流程中涉及的化学反应均为氧化还原反应二、综合题
-
16. A~G为中学常见的物质,其中A~F中含有同一种金属元素,各物质间有如下转化关系。其中B、G为地壳中含量排前两位的金属单质,D、F为碱,C、E为仅含两种元素的盐(部分条件已省略)。
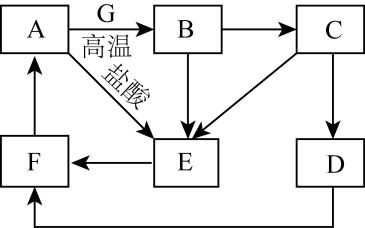
回答下列问题:
(1)、A的化学式为;E溶液的颜色为色。(2)、E转化为F的离子方程式为。(3)、在溶液中D转化为F的现象为。(4)、某同学在老师的指导下展开了延伸学习,配制480mLC溶液。①在配制C溶液时需加入少量铁屑,其目的是。
②在配制过程中,下列不正确操作会导致所配溶液浓度(填“偏高”“偏低”或“无影响”)
a、用托盘天平称量时,左盘放砝码,并且使用游码:;
b、烧杯和玻璃棒未洗涤:;
c、定容时俯视刻度线:。
17. 价类二维图是学习元素及其化合物知识的重要模型。它是以元素化合价为纵坐标,物质类别为横坐标的二维平面图像,如图为钠元素的价类二维图。
回答下列问题:
(1)、①的化学式为;“ ”代表的物质类别为。 (2)、K与Na同属于IA族元素,有相似的化学性质,切绿豆大小的钾粒投入到装有适量水的烧杯中,产生的现象为;其发生反应的化学方程式为。(3)、将Na久置于空气中,最终得到的产物为(填化学式);若溶液中含有少量 , 除去杂质的最优方法为(用离子方程式表示)。(4)、NaH可以和反应生成 , 该反应中每生成 , 转移的电子数目约为。(5)、NaCl溶液在通电条件下可生成NaOH以及两种气体,其中一种为黄绿色,该反应的离子方程式为。18. 某同学用高锰酸钾和浓盐酸制备氯气,并验证卤族单质间氧化性强弱。实验装置如图所示(夹持装置已省略)。
”代表的物质类别为。 (2)、K与Na同属于IA族元素,有相似的化学性质,切绿豆大小的钾粒投入到装有适量水的烧杯中,产生的现象为;其发生反应的化学方程式为。(3)、将Na久置于空气中,最终得到的产物为(填化学式);若溶液中含有少量 , 除去杂质的最优方法为(用离子方程式表示)。(4)、NaH可以和反应生成 , 该反应中每生成 , 转移的电子数目约为。(5)、NaCl溶液在通电条件下可生成NaOH以及两种气体,其中一种为黄绿色,该反应的离子方程式为。18. 某同学用高锰酸钾和浓盐酸制备氯气,并验证卤族单质间氧化性强弱。实验装置如图所示(夹持装置已省略)。
回答下列问题:
(1)、进行该实验前需进行的操作是。(2)、装置A中发生反应的化学方程式为。(3)、装置B的作用为。(4)、打开a,关闭b,装置C中的实验现象为。可证明氧化性;一段时间后,装置C中溶液颜色不变,打开b,关闭a,装置E中溶液由无色逐渐变为蓝色,该同学由此得出结论,氧化性: , 你是否认同该同学的结论,若不认同,给出理由:。(5)、装置D中足量NaOH溶液中发生反应的离子方程式为。19. 废旧金属的综合利用有利于节约资源、保护环境。现有废弃物(含、FeO、CuO),实验室要回收三种金属,工艺流程如图所示:
已知:
回答下列问题:
(1)、“碱溶”时发生反应的离子方程式为。(2)、“操作1”的名称为。(3)、“沉铝”时加入适量盐酸,使转化为 , 该反应的化学方程式为 , 该步骤为避免因盐酸控制不当(过量)而导致溶解,实际操作中可用过量(填化学式)气体代替。(4)、“灼烧”时可在(填仪器名称)中进行。(5)、“沉铁”时通入空气的目的是;证明“沉铁”的溶液中没有的操作为。