北京市昌平区2022-2023学年高三上学期期末质量检测化学试题
试卷更新日期:2023-02-06 类型:期末考试
一、单选题
-
1. 下列有关“双奥之城——北京”在奥运会系列设计中的说法错误的是




A.“水立方”采用的四氟乙烯与乙烯的共聚物属于有机材料
B.“鸟巢”的主体框架为钢结构,钢属于金属材料
C.“飞扬”火炬所用的燃料氢气为还原性气体
D.冰壶场馆采用分布式光纤温度检测仪监测温度,光纤主要成分是硅
A、A B、B C、C D、D2. 据报道,火星和金星大气层中可能存在一种非常特殊的气态化合物,这种化合物会导致温室效应,它的结构式为。下列说法中错误的是A、的电子式是: B、和互为同位素 C、分子中存在极性键 D、分子呈直线形3. 利用原子结构及元素周期律表相关知识得到的以下结论中错误的是A、第IA族元素的原子半径: B、基态N原子的轨道表示式: C、酸性:
D、电负性:
4. 以下关于的制备、干燥、收集、吸收(如图所示)的说法正确的是
C、酸性:
D、电负性:
4. 以下关于的制备、干燥、收集、吸收(如图所示)的说法正确的是 A、生成氯气的同时,可能转化为 B、a中加入饱和食盐水,b中加入浓硫酸 C、用溶液吸收时,体现氧化性,体现还原性 D、每消耗8.7克 , 生成氯气5. 下列反应中出现的颜色变化不是由于氧化还原反应引起的是A、向氢氧化镁悬浊液中滴加氯化铵溶液,白色沉淀溶解 B、向溶液中加入足量粉,溶液蓝色消失 C、乙醇使酸性高锰酸钾溶液褪色 D、在空气中加热,白色变为淡黄色6. 吲吲哚生物碱具有抗菌、抗炎、抗肿瘤等多种活性,其一种中间体结构简式如图所示,下列关于吲哚生物碱中间体的说法错误的是
A、生成氯气的同时,可能转化为 B、a中加入饱和食盐水,b中加入浓硫酸 C、用溶液吸收时,体现氧化性,体现还原性 D、每消耗8.7克 , 生成氯气5. 下列反应中出现的颜色变化不是由于氧化还原反应引起的是A、向氢氧化镁悬浊液中滴加氯化铵溶液,白色沉淀溶解 B、向溶液中加入足量粉,溶液蓝色消失 C、乙醇使酸性高锰酸钾溶液褪色 D、在空气中加热,白色变为淡黄色6. 吲吲哚生物碱具有抗菌、抗炎、抗肿瘤等多种活性,其一种中间体结构简式如图所示,下列关于吲哚生物碱中间体的说法错误的是 A、该物质属于芳香族化合物 B、该物质能发生加成、取代反应 C、分子中不含有手性碳原子 D、分子中含有酰胺基7. 下列过程中的化学反应对应的离子方程式正确的是A、硫酸铜溶液中加少量的铁粉: B、溶液中滴加过量稀氨水: C、硫酸铝溶液中滴加少量氢氧化钾溶液: D、用碳酸钠溶液处理水垢中的硫酸钙:8. 某小组利用下图装置探究的性质。下列关于实验现象的解释中,错误的是
A、该物质属于芳香族化合物 B、该物质能发生加成、取代反应 C、分子中不含有手性碳原子 D、分子中含有酰胺基7. 下列过程中的化学反应对应的离子方程式正确的是A、硫酸铜溶液中加少量的铁粉: B、溶液中滴加过量稀氨水: C、硫酸铝溶液中滴加少量氢氧化钾溶液: D、用碳酸钠溶液处理水垢中的硫酸钙:8. 某小组利用下图装置探究的性质。下列关于实验现象的解释中,错误的是 A、通入前,①中溶液显红色的原因: B、通入后,①中溶液颜色褪去的原因:具有漂白性 C、通入前,②中溶液显蓝色的原因:淀粉遇碘单质变蓝 D、通入后,②中溶液颜色褪去的原因:9. 下列对物质性质解释合理的是
A、通入前,①中溶液显红色的原因: B、通入后,①中溶液颜色褪去的原因:具有漂白性 C、通入前,②中溶液显蓝色的原因:淀粉遇碘单质变蓝 D、通入后,②中溶液颜色褪去的原因:9. 下列对物质性质解释合理的是选项
性质
解释
A
热稳定性:
中存在氢键
B
熔点:晶体硅<碳化硅
碳化硅中分子间作用力较大
C
酸性:
电负性:
D
熔点:
键较强
A、A B、B C、C D、D10. 是硅酸盐水泥的重要成分之一,其相关性质的说法错误的是( )A、可发生反应: B、具有吸水性,需要密封保存 C、能与 ,反应生成新盐 D、与足量盐酸作用,所得固体产物主要为11. 可利用太阳能光伏电池电解水制高纯氢,工作示意图如图所示。通过控制开关,可得到或。下列说法正确的是 A、连接时,阳极反应物为 B、连接时,可制备 C、连接时,阳极发生反应: D、连接时,当电路中通过电子时,电极3的质量增加12. 已知物质的相关数据如下表,下列说法正确的是
A、连接时,阳极反应物为 B、连接时,可制备 C、连接时,阳极发生反应: D、连接时,当电路中通过电子时,电极3的质量增加12. 已知物质的相关数据如下表,下列说法正确的是物质
相关数据
A、不与盐酸溶液反应 B、溶液中存在的所有微粒有: C、与碳酸钠溶液反应,可能产生气体 D、向石灰水悬浊液中加入溶液,溶液可能变澄清13. 共价有机框架()是一类具有平面、多孔网状结构的材料,其在催化、能量储存等领域有潜在的应用。一种材料的合成如图所示。(图中 表示链延长)。
表示链延长)。已知:R′-CH2CN
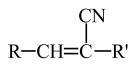 +H2O
+H2O
下列说法正确的是
A、分子中碳原子有两种杂化方式 B、的核磁共振氢谱有4组峰 C、合成的过程中发生了取代反应 D、乙二醛也可与合成材料14. 某小组同学进行了以下3个实验:实验1
实验2
实验3
操作

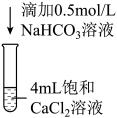
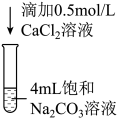
现象
无沉淀及气体产生
有沉淀及气体产生
现象a
下列说法正确的是
A、实验1中发生了反应 B、实验2中促进了的电离平衡 C、实验3中现象a可能是:有沉淀及气体产生 D、推测:可用溶液鉴别浓度均为的溶液和溶液二、综合题
-
15. (II)可形成多种配合物,呈现出多样化的性质和用途。(1)、向盛有硫酸铜水溶液的试管中加入少量氨水生成蓝色沉淀,继续加入过量氨水,得到深蓝色透明溶液,最后向该溶液中加入一定量的乙醇,析出晶体。
①产生蓝色沉淀的离子方程式是。
②在水中电离的方程式是。
(2)、如下图所示,(II)配合物A和B可发生配位构型的转变,该转变可带来颜色的变化,因此可用作热致变色材料,在温度传感器、变色涂料等领域应用广泛。
①的价层电子排布式为。
②A中氮原子与其它原子(或离子)之间存在的作用力类型有 , 氢原子与其它原子之间存在的作用力类型有。
③已知:当(II)配合物A和B配位构型由八面体转变为四方平面时,吸收光谱蓝移,配合物颜色紫色变为橙色。

想将配合物的颜色由紫色调整为橙色,需要进行的简单操作为。
(3)、已知:①物质
颜色
黄色
蓝色
②蓝色溶液与黄色溶液混合为绿色溶液。在溶液中加入浓溶液,颜色从蓝色变为绿色,请结合化学用语解释原因。
(4)、和是铜常见的两种氯化物,如图表示的是的晶胞。已知晶胞的边长为 , 阿伏加德罗常数为 , 则该晶体的密度为。(已知:)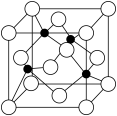 16. 利用氢氧化钡沉淀-碘量法对锰酸钾和高锰酸钾共存时的离子浓度进行分别测定,方法如下。
16. 利用氢氧化钡沉淀-碘量法对锰酸钾和高锰酸钾共存时的离子浓度进行分别测定,方法如下。已知:① , 易溶于水
②
③溶液中较高时,易被空气氧化
④该条件下,和的还原产物都是
I.取和共存液于烧杯中,加入过量溶液,产生灰绿色沉淀,过滤。
II.取I中的滤液于碘量瓶中,加入溶液和浓硫酸,此时溶液颜色发生变化,盖上盖子后至黑暗处放置5分钟。
III.用溶液滴定,待溶液颜色变为淡黄色时,加入淀粉指示剂,达到滴定终点时,消耗溶液。
IV.另取一份相同共存液于碘量瓶中,重复II、III操作,记录消耗溶液。
(1)、I中灰绿色沉淀是 , 同时生成的另一种产物的化学式是。(2)、II中反应的离子方程式是。(3)、III中滴定终点时的现象是。(4)、II中加入浓硫酸要适量,防止溶液中较高发生副反应:(写出反应的离子方程式)。(5)、该溶液中锰酸钾的物质的量浓度为。17. 他非诺喹是一种抗疟疾新药。其中间体K的合成路线如下(部分条件已省略)
已知:
①
②
(1)、A可以与溶液反应放出 , A中官能团为。(2)、的反应类型为。(3)、的化学方程式为。(4)、X是D的同分异构体,符合下列条件的X的结构简式是。(5)、由J生成K可以看作三步反应,如图所示。
P中有两个六元环结构。Q的结构简式为。
(6)、一种由G制备H的电化学方法:在和混合水溶液中加入G,通电。电极反应为。(7)、 具有水果香味,在化妆品行业有一定用途。以环己醇为原料合成路线如下,补全剩余片段。(其余所需材料任选):
具有水果香味,在化妆品行业有一定用途。以环己醇为原料合成路线如下,补全剩余片段。(其余所需材料任选):已知:

合成路线:
 18. 我国出口球状氯化镁融雪剂时,对产品色度(白度)要求很高,因此研究脱色及显色离子的去除有现实意义。以水氯镁石为原料生产符合白度要求的融雪剂的流程如下。
18. 我国出口球状氯化镁融雪剂时,对产品色度(白度)要求很高,因此研究脱色及显色离子的去除有现实意义。以水氯镁石为原料生产符合白度要求的融雪剂的流程如下。已知:①水氯镁石的主要成分是 , 还含有少量有色有机物、可溶性等杂质离子及少量不溶物。
物质
(1)、I.去除泥沙及脱除有机物颜色水氯镁石饱和溶液脱色后的饱和溶液
操作1的名称是。
(2)、活性炭的作用是。(3)、部分有机物可与反应脱氢,在该反应中,体现的性质是。(4)、其它条件都不变的情况下,得到温度对脱色率的影响如图所示。后,随温度升高,脱色率下降的原因是。(5)、II.去除显色离子向脱色处理后的氯化镁溶液中加入氨水反应30分钟,再将溶液升温至保持30分钟,恢复至室温,最后加入适量的溶液反应一段时间,过滤得到氯化镁精制溶液。
过滤得到的滤渣中含有、。
①将横线补充完整。
②将生成的离子方程式补充完整:、
(6)、将溶液升温至的目的是。(7)、III.制备产品氯化镁精制溶液球状氯化镁融雪剂
操作2是。
19. 铜片与浓硝酸反应后溶液呈现鲜草绿色,小组同学探究其成因。(1)、铜片溶解的化学方程式为。(2)、【初步实验】甲同学提出猜想:仅仅是因为气体溶解后,溶液颜色和气体颜色叠加形成鲜草绿色,进行实验1-1及1-2予以验证。
实验1-1:取反应后混合液于一支试管内,按一定的气体流速将和混合气体通入,有大量红棕色气体逸出,约后溶液转为蓝色。
实验1-2:取反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约后溶液转为蓝色。
乙同学根据以上2个实验现象证明甲同学猜想不成立,理由是。
(3)、【深入研究】分别向四支试管内依次加入下列试剂后,同时插入铜丝并记录实验现象,如下表。
编号
浓硝酸/
蒸馏水/滴
/滴
尿素溶液/滴
现象
2-1
1
0
0
0
快速反应,异常剧烈,溶液为鲜草绿色
2-2
1
3
0
0
快速反应,异常剧烈,溶液为鲜草绿色
2-3
1
0
3
0
反应较慢,溶液为蓝色,没有绿色出现
2-4
1
0
0
3
反应较慢,溶液为蓝色,没有绿色出现
已知:①尿素的化学式为 , 其中C的化合价为价
②该条件下,浓硝酸与尿素溶液不反应
③金属和浓硝酸反应过程中有生成,可大大加快金属与浓硝酸反应的速率。其原理为:
第一步:
第二步:
第三步:
补全上述原理的第二步反应:。
(4)、因为发生化学反应: , 因此实验2-4中反应速率较慢。上述实验可以说明反应过程中的对反应速率有一定影响。丙同学设计实验3,能证明反应混合液的鲜草绿色也与也有关。(5)、实验3:向一支试管内加入5滴稀 , 加入溶液振荡后再滴加溶液,现象是。(6)、实验2-3和实验2-4分别证明了具有性、性,这与其核心元素化合价密切相关。(7)、解释实验1-1和1-2的现象差异。