湖北省荆州市八县市2022-2023学年高二上学期期末联考化学试题
试卷更新日期:2023-02-06 类型:期末考试
一、单选题
-
1. “北溪管道”被炸导致大量天然气泄漏,天然气的主要成分是。下列叙述正确的是A、管道中钢材在弱碱性海水中主要发生析氢腐蚀 B、分子中基态碳原子价电子占据能层符号为M C、含非极性键和极性键 D、分子的空间结构为正四面体形2. 2022年诺贝尔化学奖授予开发“点击化学”科学家。分子R称为“点击化学试剂”,如图所示。下列叙述错误的是
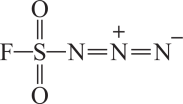 A、电负性: B、第一电离能: C、S原子核外有6种运动状态不同的电子 D、基态F原子核外电子占据3个能级3. 神舟十五号3名航天员顺利进驻中国空间站,两个航天员乘组首次实现“太空会师”。发射火箭的燃料常用联氨、液氢 , 氧化剂有液氧、液态等。
A、电负性: B、第一电离能: C、S原子核外有6种运动状态不同的电子 D、基态F原子核外电子占据3个能级3. 神舟十五号3名航天员顺利进驻中国空间站,两个航天员乘组首次实现“太空会师”。发射火箭的燃料常用联氨、液氢 , 氧化剂有液氧、液态等。
下列叙述错误的是
A、液氢和液氧燃烧放出大量热量,产物对环境友好 B、发射场因液态产生大量而呈红棕色 C、液氢和液氧在气化过程中发生了吸热反应 D、和反应中产物总能量小于反应物总能量4. 已知氟硅酸是二元强酸。下列叙述正确的是A、水溶液中不存在电离平衡 B、溶液 C、常温下,溶液的 D、溶液中5. 最近,考古学家在江苏建湖发现一处钱币窖藏遗存,出土钱币约1.0吨,除少量的唐代开元通宝钱币外,大部分为宋代钱币,钱币主要成分是铜合金。下列叙述错误的是A、钱币表面绿色物质的主要成分是 B、钱币中铜在地下主要发生吸氧腐蚀和析氢腐蚀 C、钱币在窖藏中发生电化学腐蚀时铜被氧化 D、保护钱币措施有保持干燥、涂保护层等6. 热值(calorific vlue)又称卡值或发热量,燃料完全燃烧放出的热量称为该燃料的热值。已知几种可燃物的燃烧热如下表所示:可燃物
燃烧热
热值最高的是
A、 B、 C、 D、7. 下列各组离子在所限定的条件下能大量共存的是选项
条件
离子
A
溶液
、、、
B
溶液
、、、
C
84消毒液
、、、
D
、、、
A、A B、B C、C D、D8. 已知: , 将大量的粉末加入到少量蒸馏水中,得到浊液W。下列有关叙述正确的是A、适当加热W,增大 B、向W中滴几滴水,W变为不饱和溶液 C、向W加入少量粉末,溶解度增大 D、向W中滴加少量 , 溶解度减小9. 某储能电池的工作原理是:。下列说法正确的是A、放电时,在正极上发生氧化反应 B、放电时,完全反应转移电子 C、充电时,阳极反应式为 D、充电时,阴极与直流电源的正极连接10. 在周期表前四周期元素中,基态原子最外层电子排布式为的元素有A、3种 B、4种 C、5种 D、6种11. 已知:和存在平衡: , 在时,平衡常数:。华南理工大学顾成课题组最近开发一种新材料(W),通过新材料吸附力不同高效分离和。获得相同的吸附量(如)时,需要的时间至少是的2.5倍。下列叙述错误的是A、时,上述反应的平衡常数 B、达到平衡后增大的量,则上述反应速率增大 C、相同条件下,上述材料对吸附速率小于 D、上述混合物通过W材料,平衡浓度降低12. 设为阿伏加德罗常数的值,下列叙述正确的是A、溶液中阴离子总数大于 B、标准状况下,(氯仿)含原子总数为 C、参与氧化还原反应时转移的电子数一定是 D、溶液中含数目为13. 中国工程院院士谢和平团队开发新技术在海水里直接电解制氢,无副反应,工作原理如图所示。
下列叙述错误的是
A、M极为阴极,发生还原反应 B、交换膜为阴离子交换膜 C、N极反应式为 D、电解后海水中盐离子浓度保持不变14. 北京工商大学苏发兵课题组最近合成CuO/ZnO纳米材料能提高有机硅单体合成反应(Rochow-Müller Process)的选择性和产率。化学反应如下:
下列有关叙述错误的是
A、甲中氯、氢、碳的电负性依次减小 B、上述物质中有4种元素位于周期表p区 C、催化剂中第二电离能与第一电离能之差: D、基态原子M层电子排布式为15. 已知羟基乙酸是一种弱酸。在常温下,向羟基乙酸溶液中滴加同浓度的溶液,测得溶液温度与加入溶液体积的关系如图所示。下列说法错误的是 A、在a、b、c、d点中,水的电离程度最大的是c B、c点中 C、d点中 D、a点中存在、、、、
A、在a、b、c、d点中,水的电离程度最大的是c B、c点中 C、d点中 D、a点中存在、、、、二、综合题
-
16. 介孔纳米晶用作钠离子电池负极材料。某科研团队以某矿石(主要成分是、 , 含少量、等杂质)开发一种合成介孔的路线如图所示。

已知:研究发现,中铁为价。
回答下列问题:
(1)、“萃取”的目的是除去、。的活泼性比的强,其主要原因是。下列钙的粒子再失去1个电子,消耗能量最大的是(填字母)。A. B. C. D.
(2)、利用如图装置完成“抽滤”操作,相对普通过滤,抽滤的主要优点是。 (3)、与硫酸铁溶液反应的离子方程式为。(4)、利用如图装置制备去离子水。阳离子交换柱里自来水中阳离子与交换,阴离子交换柱中参与交换,阳离子交换柱中发生反应的离子方程式为。
(3)、与硫酸铁溶液反应的离子方程式为。(4)、利用如图装置制备去离子水。阳离子交换柱里自来水中阳离子与交换,阴离子交换柱中参与交换,阳离子交换柱中发生反应的离子方程式为。 (5)、钠离子电池如图所示。已知:钒(V)常见的化合价有、(铜以、、的形式存在),。
(5)、钠离子电池如图所示。已知:钒(V)常见的化合价有、(铜以、、的形式存在),。
放电时,正极上转化成的电极反应式为。充电时,生成理论上迁移。
三、填空题
-
17. 为了实现“碳达峰和碳中和”目标,科学家利用催化剂加氢还原制备烃类和烃类含氧衍生物,实现太阳能综合利用。如图所示。

请回答下列问题:
(1)、上述装置中能量转化形式主要是太阳能→能→能。(2)、图中采用(填“质子”或“阴离子”)交换膜。写出生成的电极反应式:。(3)、工业上,采用利用制备甲醇的反应为 , 在密闭容器中发生上述反应,达到平衡后,改变下列1个条件,反应速率和平衡转化率都增大的是____(填字母)。A、加入高效催化剂 B、增大浓度 C、缩小容器容积 D、升高温度(4)、几种可燃物的燃烧热如表所示。可燃物
燃烧热
①表示液态乙醇燃烧热的热化学方程式为。
②热值指单位质量可燃物完全燃烧放出热量的大小,表中可燃物的热值最大的是。
(5)、基态N的价层电子排布图为。四、综合题
-
18. 食醋是烹饪美食的调味品,有效成分主要为醋酸(用表示)。的应用与其电离平衡密切相关。25℃时,的。(1)、写出醋酸(用表示)的电离方程式:。(2)、25℃时,的水解常数。(3)、某小组研究25℃下电离平衡的影响因素。
提出假设:稀释溶液或改变浓度,电离平衡会发生移动。设计方案并完成以下实验用浓度均为的和溶液,按下表配制总体积相同的系列溶液;测定 , 记录数据。
序号
I
40.00
/
/
0
2.86
II
4.00
/
36.00
0
3.36
…
VII
4.00
a
b
4.53
VIII
4.00
4.00
32.00
4.65
①根据表中信息,补充数据:a= , b=。
②由实验I和II可知,稀释溶液,电离平衡(填“正”或“逆”)向移动;结合表中数据,给出判断理由:。
(4)、小组分析上表数据发现:随着的增加,的值逐渐接近的。查阅资料获悉:一定条件下,按配制的溶液中,的值等于的。对比数据发现,实验VIII中与资料数据存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定溶液的浓度再验证。①移取溶液于锥形瓶中,加入2滴溶液R,用溶液滴定至终点,消耗体积为 , 则R是(填名称),该溶液的浓度为。
(5)、小组进一步提出:如果只有浓度均约为的和溶液,如何准确测定的?小组同学设计方案并进行实验。请完成下表中II的内容:I
移取溶液,用溶液滴定至终点,消耗溶液
II
(填实验操作步骤),测得溶液的为4.76
实验总结得到的结果与资料数据相符,方案可行。
19. 、是大气污染物,在空气中易转化成。化学方程式为(1)、(I)和反应历程有两步,如图1所示。
①
②
。
(2)、化学反应速率较大的基元反应是(填“①”或“②”)。(3)、在密闭容器中投入和发生上述反应,达到平衡后,仅改变下列一个条件,的平衡转化率和反应速率都增大的是____(填字母)。A、加入催化剂 B、增大压强 C、增大浓度 D、升高温度(4)、(II)在体积相同的甲、乙密闭容器中都充入和 , 分别在“恒温恒容”和“绝热恒容”条件下发生上述反应,测得混合气体总压强与时间变化关系如图2所示。
在绝热恒容条件下达到平衡的容器是(填“甲”或“乙”)。
(5)、下列情况表明达到c点的反应状态的是____。A、混合气体密度不再变化 B、气体总压强不再变化 C、气体平均摩尔质量不再变化 D、消耗速率等于生成速率(6)、比较反应速率:b c(填“>”“<”或“=”,下同)。比较:a b。a点。(7)、乙容器中,内平均分压变化率为。
-
-