北京市丰台区2022-2023学年高二上学期期末考试化学试题
试卷更新日期:2023-02-06 类型:期末考试
一、单选题
-
1. 下列过程中,化学反应速率减小对人类无益的是A、金属的腐蚀 B、食物的腐败 C、塑料的老化 D、氨的合成2. 下列物质的用途或事实与盐类的水解无关的是A、硫酸钡用作钡餐 B、明矾用于净水 C、硫酸铝溶液和碳酸氢钠溶液用于泡沫灭火器 D、由制取无水固体时,需在气流中蒸发3. 已知中的化学键断裂时需要吸收的能量,中的化学键断裂时需要吸收的能量,中的化学键形成时释放的能量,与反应生成的热化学方程式为A、 B、 C、 D、4. 2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。王亚平将小苏打和醋酸混合,得到过饱和醋酸钠溶液的“液体球”,结晶后得到了热的“冰球”。下列说法错误的是A、醋酸钠是弱电解质 B、常温下,醋酸钠溶液的 C、过饱和醋酸钠溶液结晶形成热的“冰球”的过程属于放热过程 D、向过饱和醋酸钠溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出5. 下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A
B


电离方程式:
总反应:
C
D
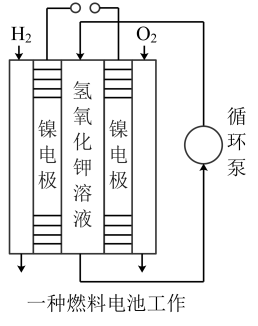

负极反应:
总反应:
A、A B、B C、C D、D6. 可以作为分解的催化剂,催化机理是:ⅰ.;
ⅱ.____。
分解反应过程中能量变化如下图所示,下列判断错误的是
 A、曲线②为含有的反应过程 B、反应ii为 C、反应ⅰ和ⅱ均为放热过程 D、反应ⅰ的反应速率可能比反应ⅱ慢7. 下列物质的除杂或检验方法与化学平衡移动原理无关的是A、除去中的:用饱和食盐水洗气 B、除去中的:用酸性溶液洗气 C、除去中的蒸气:用饱和溶液洗气 D、检验:取少量待测液于试管中,加入浓溶液,加热,将湿润的红色石蕊试纸放在试管口8. 实验小组研究金属电化学腐蚀,实验如下:
A、曲线②为含有的反应过程 B、反应ii为 C、反应ⅰ和ⅱ均为放热过程 D、反应ⅰ的反应速率可能比反应ⅱ慢7. 下列物质的除杂或检验方法与化学平衡移动原理无关的是A、除去中的:用饱和食盐水洗气 B、除去中的:用酸性溶液洗气 C、除去中的蒸气:用饱和溶液洗气 D、检验:取少量待测液于试管中,加入浓溶液,加热,将湿润的红色石蕊试纸放在试管口8. 实验小组研究金属电化学腐蚀,实验如下:序号
实验
实验Ⅰ

铁钉表面及周边未见明显变化
铁钉周边零星、随机出现极少量红色和蓝色区域,有少量红棕色铁锈生成
实验Ⅱ

铁钉周边出现红色区域,未见蓝色出现
锌片周边未见明显变化
铁钉周边红色加深,区域变大,未见蓝色出现
锌片周边未见明显变化
下列说法错误的是
A、实验Ⅰ中铁钉发生了吸氧腐蚀 B、实验Ⅱ中锌片未发生反应 C、实验Ⅱ中正极的电极反应式: D、若将片换成片,推测片周边会出现红色,铁钉周边会出现蓝色9. 微生物脱盐电池是一种高效、经济的能源装置。利用微生物处理有机废水,可获得电能,同时实现海水淡化。现以溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含的溶液为例)。下列说法错误的是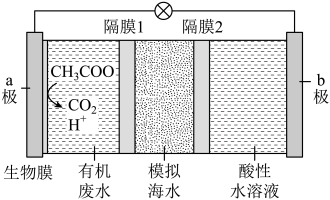 A、a极电极反应为 B、b极为正极 C、隔膜1为阴离子交换膜,隔膜2为阳离子交换膜 D、当电路中转移电子时,模拟海水理论上除盐10. 以熔融盐为电解液,利用含、等的铝合金废料,通过电解,实现的再生。下列说法错误的是A、以铝合金废料为阳极 B、阴极电极反应式为 C、在电解槽底部产生含的阳极泥 D、阳极和阴极的质量变化相等11. 一定温度下,反应在密闭容器中达到平衡时,测得容器内、、。相同温度下,按下列4组初始浓度进行实验,反应逆向进行的是
A、a极电极反应为 B、b极为正极 C、隔膜1为阴离子交换膜,隔膜2为阳离子交换膜 D、当电路中转移电子时,模拟海水理论上除盐10. 以熔融盐为电解液,利用含、等的铝合金废料,通过电解,实现的再生。下列说法错误的是A、以铝合金废料为阳极 B、阴极电极反应式为 C、在电解槽底部产生含的阳极泥 D、阳极和阴极的质量变化相等11. 一定温度下,反应在密闭容器中达到平衡时,测得容器内、、。相同温度下,按下列4组初始浓度进行实验,反应逆向进行的是A
B
C
D
0.22
0.44
0.11
1.00
0.22
0.44
0.44
1.00
1.56
3.00
1.56
8.00
A、A B、B C、C D、D12. 某同学在两个相同的特制容器中分别加入溶液和溶液,再分别用盐酸滴定,利用计和压强传感器检测,得到如图线。
已知:常温下,酚酞的变色范围是 , 甲基橙的变色范围是。
下列说法错误的是
A、溶液和溶液中微粒种类相同 B、图中曲线甲和丁表示向溶液中滴加盐酸 C、在b点发生反应的离子方程式为 D、滴定分析时,a点可用酚酞、c点可用甲基橙作指示剂指示滴定终点13. 在常温下,有关下列4种溶液的叙述错误的是编号
①
②
③
④
溶液
醋酸
盐酸
氨水
氢氧化钠溶液
3
3
11
11
A、4种溶液中由水电离出的均为 B、等体积的溶液①和②分别与足量锌充分反应,溶液①产生氢气更多 C、将溶液②、③等体积混合,所得溶液中: D、将溶液②与溶液④混合后,若所得溶液的 , 则14. 研究氧化制备对资源的综合利用有重要意义,主要化学反应有:① , ②。在一定条件下,将和按物质的量1∶1投入反应容器,反应一段时间后,体系内含碳物质的浓度变化如下表所示。
下列说法错误的是
A、的转化率大于的 B、根据表中物质的浓度变化,推测有副反应 C、该反应条件下,副反应生成的速率大于反应①生成的速率 D、若体系生成的含碳物质只有和 , 则初始物质浓度与反应一段时间后物质浓度c之间一定存在:二、综合题
-
15. 天然气是一种清洁能源,但其中大多含有、等酸性气体和水汽,会腐蚀管道设备。已知:时氢硫酸和碳酸的电离常数如下表:(1)、碳钢材质管道发生电化学腐蚀,作负极的物质是。(2)、用化学用语表示溶液显酸性的原因。(3)、溶液可以去除 , 写出反应的离子方程式。(4)、用热碱液(溶液)吸收天然气中的 , 可将其转化为可溶性的 , 反应的化学方程式为。(5)、我国科学家设计了一种协同转化装置,实现对天然气中和的高效去除,装置如下图所示。其中电极分别为石墨烯(石墨烯包裹的)和石墨烯。

①石墨烯是极(填“阳”或“阴”)。
②石墨烯电极区发生反应为:
ⅰ.
ⅱ.。
③协同转化总反应的化学方程式为 , 在其中所起的作用是。
④工作时,石墨烯电极区的基本保持不变,结合化学用语解释原因。
16. 利用工业废气中的合成基础化工原料甲醇 , 是资源化的重要方法,涉及的主要化学反应有:反应ⅰ:
反应ⅱ:
(1)、反应ⅱ的化学平衡常数表达式为。(2)、已知:。利用和计算时,还需要利用反应的。通过计算得出。(3)、控制反应条件(均使用了催化剂),研究投料比(反应物的物质的量之比)、压强、温度对反应体系的影响。产率和选择性S的定义: ,

①图1中,投料比是指(填“”或“”);当投料比为5时,的转化率约为16%, , 则。
②图2中,在催化剂2的作用下,发生的主要反应是(填“ⅰ”或“ⅱ”)。
③图3中,当温度高于时,甲醇的产率随温度升高而减小,原因可能有(写出2条)。
(4)、一定条件下,向体积为的恒容密闭容器中通入和 , 发生上述反应,t秒后达到平衡。此时容器中为 , 为。①平衡后的浓度为(用含a、b、V的代数式表示,下同)。
②用的浓度变化表示秒内反应ⅱ的反应速率,。
③该条件下反应ⅰ的化学平衡常数为。
17. 某小组研究与盐溶液的反应。资料:ⅰ.镁和水反应会在镁条表面形成致密的膜,阻碍反应进一步发生。
ⅱ.某些体积较小的离子能够“钻入”膜,达到使其溶解的效果,称作“离子钻入效应”。
进行实验:常温下,向试剂X中加入长的光亮镁条。
实验序号
试剂X
实验现象
Ⅰ
蒸馏水
镁条表面有微小气泡附着
Ⅱ
溶液
迅速有大量无色气泡冒出,同时产生大量白色沉淀
Ⅲ
溶液
镁条表面迅速覆盖一层疏松黑色固体,并有少量气泡冒出
Ⅳ
溶液和溶液充分混合、过滤后所得的滤液
迅速有大量无色气泡冒出,滤液中逐渐出现白色浑浊
(1)、分别收集实验Ⅱ和实验Ⅳ中产生的气体于小试管中,用拇指堵住试管口,靠近酒精灯火焰,松开拇指,均听到爆鸣声,说明生成的气体中含有。(2)、常温下,溶液的。结合化学用语解释溶液显碱性的原因。(3)、经实验测定,实验Ⅱ中产生的白色沉淀中含有。已知可以和形成 , 请用化学平衡移动原理解释实验Ⅱ中生成气体速率快及生成的原因。(4)、实验Ⅲ中生成了 , 写出该反应的离子方程式。(5)、对于实验Ⅳ,小组同学猜测滤液中的某些微粒可能对反应速率有影响。继续设计并实施实验,进行深入研究。实验序号
试剂X
实验现象
Ⅴ
细微气泡冒出
Ⅵ
溶液蒸馏水
镁条表面有微小气泡附着
①甲同学认为实验Ⅳ的滤液中含有 , 请设计实验方案证实其想法。
②对比实验Ⅳ和Ⅴ,可知对反应速率有影响。实验Ⅴ中的试剂X是。
(6)、综合上述实验可知,与可以加快和反应的速率。反应速率加快的原因是。(7)、研究表明,与盐溶液反应的多样性与有关。三、综合题
-
18. 常温下,以酚酞为指示剂,用的溶液滴定未知浓度溶液。溶液和微粒分布系数随滴加溶液体积的变化关系如下图所示。


已知:ⅰ.二元酸在水中的电离方程式是: , 。
ⅱ.的分布系数
(1)、滴定时,的溶液装入滴定管中(填“a”或“b”)。(2)、实验测得,溶液的浓度为。(3)、曲线①代表(填“”、“”或“”)。(4)、常温下的电离平衡常数。(5)、当时,下列正确的是(填字母)。a.溶液为红色
b.
c.
d.
(6)、下列情况会造成测定结果偏高的是(填字母)。a.盛装溶液的滴定管,未用溶液润洗
b.盛装溶液的锥形瓶,用蒸馏水洗过后未用溶液润洗
c.盛装溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失
d.滴定终点读数时,俯视滴定管的刻度
19. 废旧铅蓄电池的铅膏中主要含有和 , 还有少量等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
已知:ⅰ.一些难溶电解质的溶度积常数如下表:
难溶电解质
ⅱ.浓度为的一些金属离子生成氢氧化物沉淀时的如下表:
金属氢氧化物
开始沉淀的
1.5
6.3
3.3
7.1
完全沉淀的
2.8
8.3
4.6
9.1
回答下列问题:
(1)、在“脱硫”中,发生转化反应的离子方程式为。(2)、在“脱硫”中,加入不易使铅膏中的发生转化,原因是。若要有生成,溶液中的至少大于。(3)、在“酸浸”中,除加入 , 还要加入。①除了能将(Ⅱ)转化为(Ⅲ),还能促进金属在醋酸中转化为。写出使转化为的化学方程式。
②也能使转化为。其中的作用是。
③“酸浸”时,为了加快反应速率,可适当加热。但温度不宜过高,原因可能是(写出2条)。
(4)、“酸浸”后调节溶液的约为4.9,则滤渣的主要成分是。(5)、“沉铅”时,产生沉淀后的低于7.1,原因是:沉淀生成后(填“>”、“=”或“<”)。