江西省宜春市八校2022-2023学年高二上学期12月联考化学试题
试卷更新日期:2023-02-03 类型:月考试卷
一、单选题
-
1. 化学在生活中的应用随处可见,下列措施不是为了改变化学反应速率的是( )A、将食物存放在冰箱中 B、冶炼铁时将铁矿石粉碎 C、糕点包装袋内放置除氧剂 D、炒菜时使用铁锅而不用铝锅2. 下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
选项
A
B
C
D
强电解质
Cu
NaCl
CaCO3
HNO3
弱电解质
CH3COOH
NH3
H2SO3
Fe(OH)3
非电解质
C12H22O11(蔗糖)
SO3
C2H5OH
H2O
A、A B、B C、C D、D3. 下列与化学反应能量变化相关的叙述正确的是( )A、焓变是指1mol物质参加反应时的能量变化 B、应用盖斯定律,可计算某些难以直接测量的反应焓变密 C、在一个化学反应中,当反应物总焓小于生成物的总焓时,为负值 D、同温同压下,在光照和点燃条件下的不同4. 为阿伏加德罗常数的值。在恒容密闭容器中加入和 , 一定条件下反应:达到平衡状态,下列说法正确的是( )A、达到平衡时放出的热量为 B、达到平衡状态时转移电子数目为 C、容器内原子总数为 D、在反应中若有个断键时达到平衡状态,则的平衡转化率约为5. 下列说法正确的是( )A、凡是放热反应都是自发反应上 B、自发反应都是熵增大的反应 C、吸热反应可能是自发反应 D、凡是需要加热才能发生的反应都是非自发进行的6. 常温下,关于下列溶液的叙述错误的是( )A、的醋酸溶液和的溶液等体积混合后溶液呈酸性 B、的硫酸溶液稀释到原来的500倍,稀释后溶液中与之比约为1:10 C、向的NaOH溶液缓缓通入气体至溶液增重8.8g,则 D、相等的、、溶液,则7. 某化学研究小组探究外界条件对化学反应mA(g)+nB(g)=pC(g)的速率和平衡的影响,图象如下,下列判断正确的是( ) A、由图a可知, , 该反应的逆反应为放热反应 B、由图b可知,该反应m+n<p C、图c是绝热条件下速率和时间的图象,由此说明该反应吸热 D、图d中,曲线a可能使用了催化剂8. 汽车的启动电源常用蓄电池。其结构如图所示,放电时其电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断,下列叙述中正确的是( )
A、由图a可知, , 该反应的逆反应为放热反应 B、由图b可知,该反应m+n<p C、图c是绝热条件下速率和时间的图象,由此说明该反应吸热 D、图d中,曲线a可能使用了催化剂8. 汽车的启动电源常用蓄电池。其结构如图所示,放电时其电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断,下列叙述中正确的是( ) A、PbO2作为负极,被氧化 B、放电时,化学能转化为电能 C、负极反应是Pb-2e- =Pb2+ D、电池放电时,电子由Pb电极流出经电解液流向PbO2电极9. 相同温度下,0.01 mol/L的NaOH溶液和0.01 mol/L的盐酸相比较,下列说法错误的是( )A、两溶液的pH之和等于14 B、稀释100倍后,盐酸溶液pH=4 C、两溶液等体积混合后,溶液一定呈中性 D、两溶液中水的电离程度相同10. 我国科学家开发高效催化剂实现催化还原制备热化学方程式为。
A、PbO2作为负极,被氧化 B、放电时,化学能转化为电能 C、负极反应是Pb-2e- =Pb2+ D、电池放电时,电子由Pb电极流出经电解液流向PbO2电极9. 相同温度下,0.01 mol/L的NaOH溶液和0.01 mol/L的盐酸相比较,下列说法错误的是( )A、两溶液的pH之和等于14 B、稀释100倍后,盐酸溶液pH=4 C、两溶液等体积混合后,溶液一定呈中性 D、两溶液中水的电离程度相同10. 我国科学家开发高效催化剂实现催化还原制备热化学方程式为。
已知几种共价键键能如下:
共价键
CO2(C=O)
键能/
E
436
413
467
下列叙述错误的是( )
A、a曲线代表加入了催化剂,能降低能垒 B、加入催化剂能提高的平衡转化率 C、表格中E值等于805.5 D、回收与封存有利于实现“双碳达标”11. 一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)2SO3(g)(正反应放热),测得反应的相关数据如下:容器1
容器2
容器3
反应温度T/K
700
700
800
反应物投入量
2molSO2、1molO2
4molSO3
2molSO2、1molO2
平衡v正(SO2)/mol/(L·s)
v1
v2
v3
平衡c(SO3)mol/L
c1
c2
c3
平衡体系总压强p/Pa
p1
p2
p3
物质的平衡转化率/α
α1(SO2)
α2(SO3)
α3(SO2)
平衡常数K
K1
K2
K3
下列说法正确的是( )
A、v1<v2 , c2<2c1 B、K1>K3 , p2>2p3 C、v1>v3 , α1(SO2)>α3(SO2) D、c2>2c3 , α2(SO3)+α3(SO2)<112. 某同学设计如图所示实验,探究反应中的能量变化。下列判断正确的是( ) A、由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应 B、若用NaOH固体测定中和热,则测定中和热(△H)偏高 C、实验(c)设计存在缺陷 D、将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加13. 常温下,向溶液中滴加同浓度的NaOH溶液,水电离的与NaOH溶液体积的关系如图所示。下列说法错误的是( )
A、由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应 B、若用NaOH固体测定中和热,则测定中和热(△H)偏高 C、实验(c)设计存在缺陷 D、将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加13. 常温下,向溶液中滴加同浓度的NaOH溶液,水电离的与NaOH溶液体积的关系如图所示。下列说法错误的是( )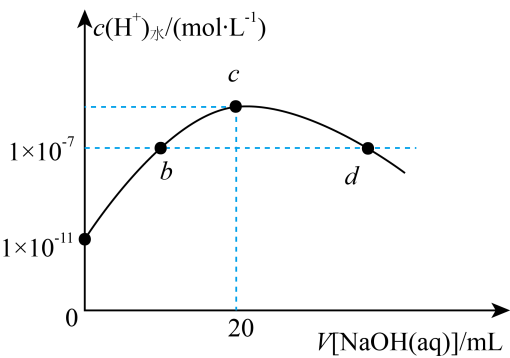 A、b点溶液显酸性 B、c点溶液中 C、d点溶液中 D、常温下,的水解常数约为
A、b点溶液显酸性 B、c点溶液中 C、d点溶液中 D、常温下,的水解常数约为二、多选题
-
14. 中国人从月球“挖”来“嫦娥石”,“嫦娥石”如图所示。它的主要成分是磷酸盐。(磷灰石)是磷酸盐之一。磷灰石在水中存在平衡: , 常温下,磷灰石的溶度积。取磷灰石溶于水中(保持大量固体)得到混合物W(不考虑水解)。
下列有关W的叙述错误的是( )
A、加入少量盐酸,减小 B、加入少量蒸馏水,减小 C、W中 D、对W加热,磷灰石的溶解度和都会增大三、综合题
-
15. 研究化学反应中能量变化,能更好地利用化学反应为生产和生活服务。
 (1)、反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
(1)、反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。①该反应为(填“吸热”或“放热”)反应。
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是。
③若要使该反应的反应速率加快,下列措施可行的是(填字母)。
A.铁片改为铁粉B.稀硫酸改为98%的浓硫酸C.升高温度
(2)、若将上述反应设计成原电池,装置如图3所示。
①铜为(填“正”或“负”)极;负极的电极反应式为。
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是L。
16. 高锰酸钾是生活中常见的消毒剂,也是中学重要的氧化剂,也是高锰酸钾溶液滴定实验中的指示剂。(1)、实验(一)探究影响反应速率的因素。为了探究浓度对反应速率的影响并利用颜色褪去所需时间表征速率,设计如下实验方案:
实验
溶液/
溶液/
溶液/
蒸馏水/
甲
5.0
15.0
5.0
0
乙
5.0
10.0
5.0
5.0
丙
10.0
10.0
5.0
0
利用实验(填代号)可以得出“其他条件相同,浓度越大,化学反应速率越快”的规律。测定“溶液褪色时间”的仪器是(填名称)。
(2)、探究催化剂对反应速率的影响。在 , 溶液中加入溶液和溶液,测得产生体积与时间关系如图所示(假设全部逸出)。
①上述反应的离子方程式为。
②针对段反应速率变快的原因提出如下猜想:
猜想1:温度升高;
猜想2:。
③设计实验验证猜想2,实验如下表所示。
实验
溶液/
溶液/
溶液/
外加物质
丁
5.0
10.0
5.0
0
戊
5.0
V
5.0
供选试剂:粉末、粉末、粉末。。X是(填化学式)。
(3)、常用的滴定剂。双氧水是日常生活中常用的消毒剂,广泛应用于皮肤消毒,它也是工业生产中的绿色氧化剂。常用氧化还原滴定法测定双氧水溶液浓度,取双氧水溶液样品稀释成溶液,准确量取稀释后溶液于锥形瓶,滴加适量稀硫酸,用 , 标准溶液滴定,三次平行实验测得消耗滴定液为。
①选择如图所示滴定管(填“A”或“B”)。
②判断滴定终点现象是。
③该双氧水溶液的物质的量浓度为。
④滴定操作太慢,测定结果可能偏低,其主要原因可能有(写出1条即可)。
17. 1776年,法国化学家LaVoisier首次确定硫元素。自然界天然的硫单质主要存在于火山区,发生反应如下(a、b均大于0):ⅰ.;ⅱ.。回答下列问题:
(1)、根据上述信息,) kJ/mol。推测ab或(填“>”“<”或“=”)。(2)、一定温度下,在恒容密闭容器中充入适量的、和气体,仅发生上述反应。下列叙述正确的是____(填字母)。A、混合气体密度不再随时间变化时达到平衡状态 B、增大硫单质的质量,逆反应速率会增大 C、达到平衡后,适当升温,的平衡转化率减小 D、平衡后充入少量惰性气体(不反应),平衡向左移动(3)、一定温度下,向2L密闭容器中充入和 , 仅发生反应①,达到平衡后,测得。温度保持不变,压缩容器至1L且保持体积不变,达到新平衡时mol/L。(4)、在恒容密闭容器中充入一定量和气体,测得的平衡转化率与温度、投料比关系如图所示。
①代表的平衡转化率随温度变化的曲线为。
②解释曲线Ⅱ变化趋势:。
(5)、一定温度下,向密闭容器中充入、和 , 达到平衡时测得平衡体系中有和 , 平衡时总压强为21kPa。该温度下,反应②的平衡常数。(不要求带单位,可用分数表示,提示:用分压计算的平衡常数为 , 分压等于总压×物质的量分数)。18.(1)、I.25℃时,三种酸的电离平衡常数如下表所示。名称
醋酸
氢氟酸
草酸
化学式
HF
电离平衡常数
三种酸的酸性由强到弱的顺序为(填化学式)。
(2)、将pH和体积均相同的溶液和HF溶液分别稀释,其pH随加水体积的变化如图所示。
①稀释前(填“>”“=”或“<”)。
②a、b两点:(填“>”“=”或“<”)。
(3)、在NaF溶液中滴加少量的草酸溶液,发生反应的离子反应方程式为。(4)、II.分别取40mL的盐酸与40mL的溶液进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:某学生实验记录数据如下:
实验序号
起始温度
终止温度
盐酸
NaOH
混合溶液
1
20.0
20.1
23.2
2
20.2
20.4
23.4
3
20.5
20.6
23.6
近似认为的NaOH溶液和的盐酸的密度都是 , 中和后生成溶液的比热容 , 则中和热(取小数点后一位)。
(5)、用相同浓度和体积的醋酸代替盐酸溶液进行上述实验,测得的中和热数值()会(填“偏大”“偏小”或“无影响”)。
-