福建省宁德市2022-2023学年高一上学期居家检测化学试题
试卷更新日期:2023-02-03 类型:月考试卷
一、单选题
-
1. 现代生活需要人们有一定的科学素养,下列有关化学的科学常识说法正确的是( )A、碳酸钠俗名小苏打,可用作糕点膨松剂 B、食物腐败、Fe(OH)3胶体的制备都与氧化还原反应有关 C、为防止馅饼等富脂食品氧化变质,常在包装袋中放入生石灰 D、榨苹果汁时加入维生素C,可减缓其在空气中发生颜色变化2. 设NA是阿伏加德罗常数的值。下列说法正确的是( )A、1mol/L的CaCl2溶液中含有2NA个Cl- B、标准状况下,6.72LCCl4中有1.2NA个原子 C、常温下2.8gCO和N2的混合气体含有电子数为1.4NA D、7.8gNa2O2固体中含有的离子总数为0.4NA3. 某容器中发生一个化学反应,反应过程中存在、、、、和六种粒子,在反应过程中测得、的质量分数(w)随时间变化的曲线如图所示。下列有关判断中错误的是( )
 A、在反应中被还原,发生还原反应 B、还原性: C、每生成1mol Fe3+转移电子数为NA D、在该反应中参加反应的还原剂与氧化剂的个数之比为4. 下列实验能够达到相应目的的是( )
A、在反应中被还原,发生还原反应 B、还原性: C、每生成1mol Fe3+转移电子数为NA D、在该反应中参加反应的还原剂与氧化剂的个数之比为4. 下列实验能够达到相应目的的是( ) A、图A是将饱和溶液滴入热溶液中制备氢氧化铁胶体 B、图B是一段时间后,若往烧杯中液体滴加硝酸酸化硝酸银有白色沉淀,则半透膜破损 C、图C是可用于证明氯化钠是电解质 D、图D是可用于比较碳酸钠和碳酸氢钠的热稳定性5. 现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应,已知Na2SO3可被K2Cr2O7氧化为Na2SO4 , 则元素Cr在还原产物中的化合价为( )A、+2 B、+3 C、+4 D、+56. 设为阿伏加德罗常数的值,下列说法正确的是( )A、0.1mol的NH含电子数为1.1NA B、常温常压下,由和组成的混合气体所含的原子数为1.5 C、含个氦原子的氦气中所含的分子数是0.5 D、标准状况下,与足量反应转移的电子数为0.257. 有一瓶14%KOH溶液,加热蒸发掉100g水后,变为28%的KOH溶液100mL(蒸发过程中无溶质析出)。这100mL溶液的物质的量的浓度为A、6mol·L﹣1 B、5mol·L﹣1 C、6.25mol·L﹣1 D、6.75mol·L﹣18. 某无色溶液中可能含有Ba2+、Fe3+、Na+、K+、、、、Cl-、Br-、中的若干种,离子浓度都为0.1mol/L,往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
A、图A是将饱和溶液滴入热溶液中制备氢氧化铁胶体 B、图B是一段时间后,若往烧杯中液体滴加硝酸酸化硝酸银有白色沉淀,则半透膜破损 C、图C是可用于证明氯化钠是电解质 D、图D是可用于比较碳酸钠和碳酸氢钠的热稳定性5. 现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应,已知Na2SO3可被K2Cr2O7氧化为Na2SO4 , 则元素Cr在还原产物中的化合价为( )A、+2 B、+3 C、+4 D、+56. 设为阿伏加德罗常数的值,下列说法正确的是( )A、0.1mol的NH含电子数为1.1NA B、常温常压下,由和组成的混合气体所含的原子数为1.5 C、含个氦原子的氦气中所含的分子数是0.5 D、标准状况下,与足量反应转移的电子数为0.257. 有一瓶14%KOH溶液,加热蒸发掉100g水后,变为28%的KOH溶液100mL(蒸发过程中无溶质析出)。这100mL溶液的物质的量的浓度为A、6mol·L﹣1 B、5mol·L﹣1 C、6.25mol·L﹣1 D、6.75mol·L﹣18. 某无色溶液中可能含有Ba2+、Fe3+、Na+、K+、、、、Cl-、Br-、中的若干种,离子浓度都为0.1mol/L,往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( ) A、Ba2+、Fe3+、、肯定不存在,Na+、K+肯定存在 B、原溶液肯定不含和 C、若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断有影响 D、是否含需另做实验判断9. 标准状况下,1 L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏加德罗常数可近似表示为( )A、22.4(m+n) B、22.4×6.02×1023(m+n) C、 D、m+n10. 某温度下,wg某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的反应,固体质量增加wg。下列物质①;②CO;③CO和的混合物;④甲醛(HCHO);⑤;⑥葡萄糖()中,正确的是( )A、③④⑤ B、①②③ C、④⑤ D、全部
A、Ba2+、Fe3+、、肯定不存在,Na+、K+肯定存在 B、原溶液肯定不含和 C、若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断有影响 D、是否含需另做实验判断9. 标准状况下,1 L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏加德罗常数可近似表示为( )A、22.4(m+n) B、22.4×6.02×1023(m+n) C、 D、m+n10. 某温度下,wg某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的反应,固体质量增加wg。下列物质①;②CO;③CO和的混合物;④甲醛(HCHO);⑤;⑥葡萄糖()中,正确的是( )A、③④⑤ B、①②③ C、④⑤ D、全部二、填空题
-
11. 按要求书写化学方程式或离子方程式。(1)、工业上用将氯气通入石灰乳中制漂白粉,相应的化学方程式为。(2)、在空气中被氧化,相应的化学方程式为。(3)、实验室利用二氧化锰和浓盐酸反应制备 , 相应的离子方程式为。(4)、工业上用溶液腐蚀铜线路板,相应的离子方程式为。(5)、能使氯水褪色,相应的离子方程式为。(6)、是一种新型、绿色的多功能净水剂,实验室制备的方法如下:将氯气通入溶液和的混合物中,并不断搅拌,可制得和另一种盐,写出该反应的化学方程式。12. 细菌可以促使铁、氮两种元素进行氧化还原反应,并耦合两种元素的循环。耦合循环中的部分转化如图所示。
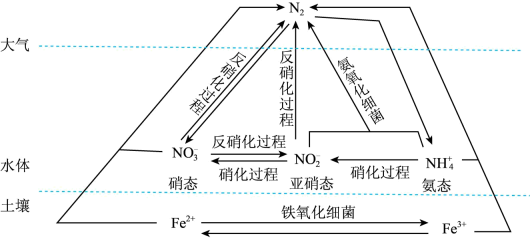 (1)、图中所示氮循环中,属于氮的固定的有____(填字母序号)。A、转化为的过程 B、转化为的过程 C、转化为的过程 D、转化为的过程(2)、氮肥是水体中氨态氮的主要来源之一,检验氨态氮肥中的实验方法是。(3)、反硝化过程中,含氮物质发生(填“氧化”或“还原”)反应。(4)、在氨氧化细菌的作用下,与可以转化为氮气。该反应中,当产生0.1mol氮气时,转移的电子的物质的量为mol。(5)、土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素转化为气体从水体中除去)。
(1)、图中所示氮循环中,属于氮的固定的有____(填字母序号)。A、转化为的过程 B、转化为的过程 C、转化为的过程 D、转化为的过程(2)、氮肥是水体中氨态氮的主要来源之一,检验氨态氮肥中的实验方法是。(3)、反硝化过程中,含氮物质发生(填“氧化”或“还原”)反应。(4)、在氨氧化细菌的作用下,与可以转化为氮气。该反应中,当产生0.1mol氮气时,转移的电子的物质的量为mol。(5)、土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素转化为气体从水体中除去)。①酸性条件下,脱除水体中硝态氮(NH4+)的原理为 , 该反应中氧化产物与还原产物的物质的量之比为。
②酸性条件下,脱除水体中硝态氮()生成的离子方程式为。
三、综合题
-
13. 为了防控疫情,学校要定时进行消毒。(1)、Ⅰ.工业上使用氯气与氢氧化钠反应制取“84消毒液”。
其有效成分是(填化学式)。
(2)、“84消毒液”使用时应按比例稀释,放置20~30min,放置过程中生成碳酸氢钠,该反应的化学方程式为:。(3)、Ⅱ.“消毒液”中氯元素的存在形态与溶液pH的关系如表:溶液pH
>9
5~6
4~5
2~3
<2
主要成分
NaClO
HCl与NaClO(少量)
HCl与Cl2(少量)
HClO与Cl2
Cl2
请你写出pH降低时产生氯气的化学方程式:。
(4)、Ⅲ.同学猜测“84消毒液”(以下简称“84“)可漂白米醋,进行了如下实验:编号
实验操作
实验现象
实验一

滴入米醋后立即褪色,闻到刺激性气味
实验二

溶液为浅棕色,无刺激性气味
实验二的目的是:①;②。
(5)、结合化学反应的方程式,解释实验一的现象:。(6)、Ⅳ.ClO2一种常用的自来水消毒剂。某研究小组用如图装置制备少量ClO2(夹持装置已略去)。
资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。 制备ClO2的化学反应方程式为2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O
装置中,冰水浴的作用是。
(7)、ClO2中Cl的化合价是。现有10 L 0.2 mol·L-1的NaClO3足量浓HCl反应,可获得ClO2的质量为。14. 如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。 (1)、制备氯气选用的药品为漂粉精固体和浓盐酸,相关反应的化学方程式为:。(2)、装置B中饱和食盐水的作用是;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:。(3)、装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入物质的组合是(填字母)。
(1)、制备氯气选用的药品为漂粉精固体和浓盐酸,相关反应的化学方程式为:。(2)、装置B中饱和食盐水的作用是;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:。(3)、装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入物质的组合是(填字母)。编号
a
b
c
d
I
干燥的有色布条
干燥的有色布条
湿润的有色布条
湿润的有色布条
II
碱石灰
水
浓硫酸
无水氯化钙
III
湿润的有色布条
湿润的有色布条
干燥的有色布条
干燥的有色布条
(4)、有人提出,装置D中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:。(5)、用一定量铁粉与氯气充分反应后,加适量水,完全溶解后无固体剩余,此时所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等,则已反应的Fe3+和未反应的Fe3+的质量之比是。15. 是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过与酸性溶液反应制备,某化学兴趣小组同学设计了如下装置制备并探究其性质。
已知:浓硫酸与固体反应可用来制备 , 二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成 , 回答下列问题:
(1)、A中盛装固体的仪器名称为。(2)、通过装置B中反应制备 , 此反应的离子方程式为。(3)、欲制备一瓶 , 选择上图中的装置,其接口的连接顺序为a-g-h。(4)、装置D盛放冰水的目的 , 装置E的作用是。(5)、证明的氧化性比强的实验方案是。(6)、“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克的氧化能力(还原产物均为氯离子)。的有效氯含量为克(计算结果保留一位小数)。16. 某兴趣小组对84消毒液的组成、性质与使用进行探究。所用试剂:84 消毒液(NaClO 浓度为)、医用酒精(乙醇体积分数为)(1)、Ⅰ:探究84 消毒液的成分实测该84消毒液 , 能使pH试纸 ,因此其成分中,除了NaCl、NaClO,还含有少量(填化学式)。
(2)、84消毒液露置于空气中,消毒效果先增强后降低。消毒效果增强的原因是。(3)、 Ⅱ:探究 84 消毒液的性质与使用84消毒液具有氧化性,预测的依据是。巴西奥运会期间,由于工作人员将84消毒液与双氧水混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长该反应的离子方程式为。
(4)、Ⅲ:84消毒液能否与医用酒精混用实验装置如图所示
序号
液体A
液体B
现象
ⅰ
()的84消毒液
蒸馏水
溶液中无明显现象;溶液变为12.0;淀粉试纸在时变蓝,时蓝色完全褪去
ⅱ
()的84消毒液
医用酒精
产生气泡,颜色无明显变化;溶液升高到13.1,淀粉试纸在时变蓝,时蓝色完全褪去
导管 a 的作用是。
(5)、实验ⅰ的目的是。(6)、判断实验ⅱ中生成了的依据是。(7)、实验过程,混合溶液的pH逐渐增大至13.1,预测酒精与NaClO反应还可能生成NaOH ,但需补充以下实验ⅲ,才能说明反应中是有NaOH生成。填写表中空白完成实验设计。
序号
液体A
液体B
现象
ⅲ
NaOH溶液
医用酒精
溶液升高到12.6
结论:医用酒精可与84消毒液发生反应,二者不可混用。
17. 海水是个巨大的化学资源宝库。根据下图海水综合利用的工艺流程图,完成下列问题: (1)、步骤(i)中,为除去粗盐中的和 , 沉淀上述离子时选用的沉淀剂依次为溶液、(填化学式)溶液、(填化学式)溶液,经过滤、加足量盐酸,蒸发后获得精盐。操作过程中判断是否沉淀完全的方法是。(2)、步骤(ⅱ)中分离与母液的操作名称是 , 工业上通常采用向母液中加入的方法来获得。(3)、写出步骤(ⅲ)主要反应的离子方程式;步骤(ⅳ)鼓入热空气可将溴单质分离出来,是利用溴单质的性。
(1)、步骤(i)中,为除去粗盐中的和 , 沉淀上述离子时选用的沉淀剂依次为溶液、(填化学式)溶液、(填化学式)溶液,经过滤、加足量盐酸,蒸发后获得精盐。操作过程中判断是否沉淀完全的方法是。(2)、步骤(ⅱ)中分离与母液的操作名称是 , 工业上通常采用向母液中加入的方法来获得。(3)、写出步骤(ⅲ)主要反应的离子方程式;步骤(ⅳ)鼓入热空气可将溴单质分离出来,是利用溴单质的性。