北京市大兴区2022-2023学年高三上学期期末考试化学试题
试卷更新日期:2023-02-01 类型:期末考试
一、单选题
-
1. 科学家研究发现分子在半导体光催化的作用下可被捕获转化为(过程如图所示)。下列说法错误的是( )
 A、分子中原子杂化方式为 B、和的空间结构相同 C、反应的化学方程式: D、该过程可以实现太阳能向化学能的转化2. 下列化学用语或图示表达错误的是( )A、的电子式:
A、分子中原子杂化方式为 B、和的空间结构相同 C、反应的化学方程式: D、该过程可以实现太阳能向化学能的转化2. 下列化学用语或图示表达错误的是( )A、的电子式: B、中子数为1的氢原子
C、乙醇的分子式:
D、氯离子的结构示意图:
B、中子数为1的氢原子
C、乙醇的分子式:
D、氯离子的结构示意图: 3. 下列有关物质性质(或用途)的描述中,不涉及氧化还原反应的是( )A、片遇稀生成无色气体 B、新制氯水久置变为无色 C、常温下,铝制容器盛装浓硫酸 D、明矾作净水剂4. 下列方程式与所给事实不相符的是( )A、吸收作供氧剂: B、溶液中通入 , 生成黄色沉淀: C、悬浊液中滴加足量溶液,出现红褐色沉淀: D、溶液中滴加少量溶液,出现白色沉淀:5. 已知:(未配平)。下列说法错误的是( )A、氯酸钠是强电解质 B、中含有极性键和非极性键 C、产物中与的物质的量之比为2:1 D、每转移电子,生成标准状况下6. X、Y、Z、W四种短周期元素在周期表中的位置如图所示,X元素基态原子的最外层电子排布式为。下列说法错误的是( )
3. 下列有关物质性质(或用途)的描述中,不涉及氧化还原反应的是( )A、片遇稀生成无色气体 B、新制氯水久置变为无色 C、常温下,铝制容器盛装浓硫酸 D、明矾作净水剂4. 下列方程式与所给事实不相符的是( )A、吸收作供氧剂: B、溶液中通入 , 生成黄色沉淀: C、悬浊液中滴加足量溶液,出现红褐色沉淀: D、溶液中滴加少量溶液,出现白色沉淀:5. 已知:(未配平)。下列说法错误的是( )A、氯酸钠是强电解质 B、中含有极性键和非极性键 C、产物中与的物质的量之比为2:1 D、每转移电子,生成标准状况下6. X、Y、Z、W四种短周期元素在周期表中的位置如图所示,X元素基态原子的最外层电子排布式为。下列说法错误的是( )X
Y
Z
W
A、离子半径: B、还原性: C、酸性: D、氢化物稳定性:7. 联氨(N2H4)可用于处理水中的溶解氧,其反应机理如下图所示:
下列说法错误的是( )
A、分子的共价键只有键 B、具有还原性,在一定条件下可被氧化 C、②中反应产物是而不是 , 说明相对较稳定 D、③中发生反应:8. 我国科技工作者发现某“小分子胶水”(结构如图所示)能助力自噬细胞“吞没”致病蛋白。下列说法正确的是( ) A、分子式为 B、分子中所有碳原子一定共平面 C、1mol该物质最多能与7mol , 发生加成反应 D、1mol该物质最多可与2mol , 反应9. 下列实验中,不能达到实验目的的是
A、分子式为 B、分子中所有碳原子一定共平面 C、1mol该物质最多能与7mol , 发生加成反应 D、1mol该物质最多可与2mol , 反应9. 下列实验中,不能达到实验目的的是实验室制取氨气
检验产物乙炔
检验浓硫酸与铜反应产生的二氧化硫
证明溶解度:AgCl>AgI




A
B
C
D
A、A B、B C、C D、D10. 已知:现将三个相同容积的密闭容器中按不同方式投入反应物发生反应。相关数据见下表:容器1
容器2
容器3
反应温度(℃)
400
400
500
起始量
1mol、1mol(g)
2mol HI
1mol、1mol(g)
平衡浓度
平衡转化率
平衡常数
下列各项关系错误的是( )
A、 B、 C、 D、11. 一种3D打印机的柔性电池以碳纳米管作电极材料,以吸收ZnSO4溶液的有机高聚物为固态电解质,电池总反应为:。下列说法错误的是( )
 A、放电时,含有锌膜的碳纳米管纤维作电池负极 B、充电时,阴极反应: C、有机高聚物中含有极性键、非极性键和氢键 D、合成有机高聚物的单体:
A、放电时,含有锌膜的碳纳米管纤维作电池负极 B、充电时,阴极反应: C、有机高聚物中含有极性键、非极性键和氢键 D、合成有机高聚物的单体: 12. 常温下,以酚酞作指示剂,用的溶液滴定的二元酸溶液(变化关系如图所示)。下列说法错误的是( )
12. 常温下,以酚酞作指示剂,用的溶液滴定的二元酸溶液(变化关系如图所示)。下列说法错误的是( ) A、的电离方程式为:; B、当时, C、当时, D、当时,13. 利用NH3可以消除氮氧化物对环境的污染。除去NO的主要反应为:。某研究小组将4molNH3和6molNO充入2L密闭容器中,在有氧和无氧条件下,分别测得NO的转化率随温度变化的情况如图所示。下列说法错误的是( )
A、的电离方程式为:; B、当时, C、当时, D、当时,13. 利用NH3可以消除氮氧化物对环境的污染。除去NO的主要反应为:。某研究小组将4molNH3和6molNO充入2L密闭容器中,在有氧和无氧条件下,分别测得NO的转化率随温度变化的情况如图所示。下列说法错误的是( ) A、在内,温度由升高到 , 该段时间内化学反应速率 B、相同条件下,的存在有利于的去除 C、在有氧条件下,温度升高到之后,NO转化率降低的原因可能是平衡逆向移动 D、在无氧条件下,温度由升高到时,平衡逆向移动14. 某实验小组同学做电解CuCl2溶液实验,发现电解后(电极未从溶液中取出)阴极上析出的铜会消失。为探究铜“消失”的原因,该小组同学用不同电解质溶液(足量)、在相同时间内进行如下实验。
A、在内,温度由升高到 , 该段时间内化学反应速率 B、相同条件下,的存在有利于的去除 C、在有氧条件下,温度升高到之后,NO转化率降低的原因可能是平衡逆向移动 D、在无氧条件下,温度由升高到时,平衡逆向移动14. 某实验小组同学做电解CuCl2溶液实验,发现电解后(电极未从溶液中取出)阴极上析出的铜会消失。为探究铜“消失”的原因,该小组同学用不同电解质溶液(足量)、在相同时间内进行如下实验。装置
序号
电解质溶液
实验现象(电解后)

I
溶液
溶液仍呈蓝色,附着的铜层无明显变化
II
稀溶液
溶液由蓝色开始变为浅黄绿色,2min后溶液变浑浊
III
浓溶液
溶液由绿色逐渐变为深黄绿色(略黑),附着的铜层变薄
已知:①②(无色)③;黄色
下列分析错误的是( )
A、电解后溶液的减小,原因是 B、浓溶液呈绿色原因是增大,平衡正向移动 C、II中溶液变浑浊,推测难溶物为 D、III中溶液变为深黄绿色,推测原因是 , 溶液中增大二、综合题
-
15. 锌及其化合物在材料和药物领域具有重要应用。回答下列问题:(1)、写出基态的价层电子排布式。(2)、黄铜是人类最早使用的合金之一,主要由和组成。已知第一电离能大于 , 从原子结构的角度分析原因:。(3)、硫酸锌溶于过量的氨水,可形成配合物 , 写出反应的离子方程式。的空间结构是。(4)、硒化锌(ZnSe)晶体是一种常用的红外材料,其晶胞形状为立方体,结构如图。

已知:阿伏加德罗常数为 , , 硒化锌的摩尔质量为 , 该晶胞密度为 , 计算该晶胞的边长为。(列出计算式)
16. 二氧化碳的综合利用是实现碳达峰、碳中和的关键。(1)、I.利用和合成甲醇,涉及的主要反应如下:已知:a.
b.
c.
计算。
(2)、一定条件下,向密闭容器中充入物质的量之比为1:3的和发生上述反应,使用不同催化剂经相同反应时间,的转化率和甲醇的选择性随温度的变化如图所示:
甲醇的选择性
①210-270℃间,在甲醇的选择性上,催化效果较好的是。
②210-270℃间,催化剂2条件下的转化率随温度的升高而增大,可能原因为。
(3)、II.工业上用和通过如下反应合成尿素:。t℃时,向容积恒定为的密闭容器中充入和发生反应。下列能说明反应达到化学平衡状态的是(填字母)。
a.相同时间内,键断裂,同时有键形成
b.容器内气体总压强不再变化
c.
d.容器内气体的密度不再改变
(4)、 的物质的量随时间的变化如下表所示:时间/min
0
30
70
80
100
1.6
l.0
0.8
0.8
0.8
的平衡转化率为;t℃时,该反应的平衡常数K=。
(5)、III.中科院研究所利用和甲酸(HCOOH)的相互转化设计并实现了一种可逆的水系金属二氧化碳电池,结构如图所示:
放电时,正极上的电极反应为;若电池工作时产生a库仑的电量,则理论上消耗锌的质量为g。(已知:转移1mol电子所产生的电量为96500库仑)
17. 黄酮哌酯是一种解痉药,可通过如下路线合成:
已知:

回答问题:
(1)、 为链状结构,该分子中含有的官能团是。(2)、A→B的反应类型为。(3)、D的结构简式为。(4)、C+E→F的化学方程式是。(5)、下列关于F和G的说法正确的是( )。a.F和G互为同分异构体
b.G在空气中能稳定存在
c.F和G可以利用溶液进行鉴别
d.1molF与足量NaOH溶液反应,最多可消耗2molNaOH
(6)、已知: , G制备M的过程如下:
, G制备M的过程如下: 
P、Q分别为、。
(7)、写出M到黄酮哌酯的反应方程式。18. 红矶钠是重要的化工原料,工业上以铬铁矿( , 含少量、)为主要原料制备红矾钠的工艺流程如下: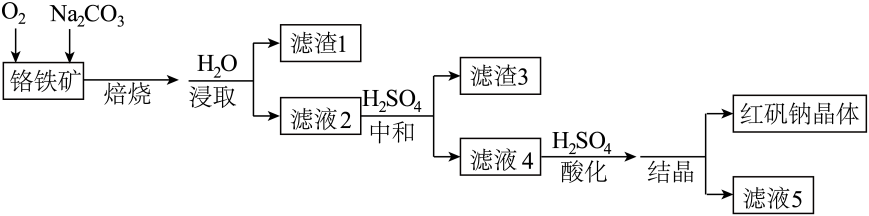
已知:i. ii.
回答下列问题:
(1)、焙烧铬铁矿生成 , 并将和转化为可溶性钠盐。①焙烧时为加快反应速率,可采取的措施是。
②生成的化学方程式如下,将其补充完整:。
□+□□_+□+□
(2)、滤液2中含有的溶质有:、。(3)、中和时的理论范围为4.5~9.3,调控不过高也不能过低的理由。(4)、酸化后所得溶液中主要含有和。
①结晶时,将混合溶液加热浓缩、(填操作)、冷却结晶、过滤得到红矾钠晶体。
②滤液5最适宜返回上述流程中,参与循环再利用。
(5)、工业上还可用膜电解技术(装置如图所示),以为主要原料制备 , 结合化学用语简述制备的原理:。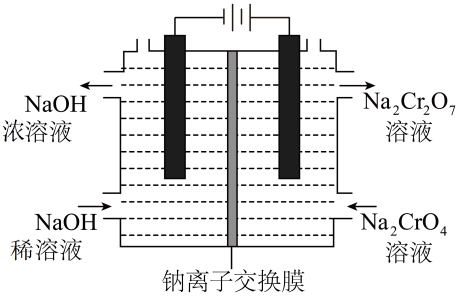 (6)、 可用于测定水体的COD(COD是指每升水样中还原性物质被氧化所需要的质量)。现有某水样 , 酸化后加入的溶液 , 使水样中的还原性物质完全被氧化;再用的溶液滴定剩余的 , 消耗溶液 , 则该水样的为。【被还原为;换算关系:】19. 某校化学兴趣小组探究SO2与FeCl3溶液的反应。
(6)、 可用于测定水体的COD(COD是指每升水样中还原性物质被氧化所需要的质量)。现有某水样 , 酸化后加入的溶液 , 使水样中的还原性物质完全被氧化;再用的溶液滴定剩余的 , 消耗溶液 , 则该水样的为。【被还原为;换算关系:】19. 某校化学兴趣小组探究SO2与FeCl3溶液的反应。资料:铁氰化钾可以与Fe2+形成蓝色沉淀,常用于Fe2+检验。
 (1)、实验室常用70%硫酸与亚硫酸钠固体制备SO2 , 写出反应的化学方程式。(2)、该小组同学预测SO2与FeCl3溶液反应的现象为溶液由黄色变成浅绿色,写出相关反应的离子方程式。(3)、向试管B中溶液通入SO2至饱和,溶液变成红色,静置5min后,溶液的颜色从红色慢慢变回黄色。静置9h后,溶液慢慢由黄色变为浅绿色。
(1)、实验室常用70%硫酸与亚硫酸钠固体制备SO2 , 写出反应的化学方程式。(2)、该小组同学预测SO2与FeCl3溶液反应的现象为溶液由黄色变成浅绿色,写出相关反应的离子方程式。(3)、向试管B中溶液通入SO2至饱和,溶液变成红色,静置5min后,溶液的颜色从红色慢慢变回黄色。静置9h后,溶液慢慢由黄色变为浅绿色。①甲同学认为溶液变红的原因是通入SO2后,Fe3+水解程度增大,形成Fe(OH)3胶体。乙同学根据SO2的性质否定了这一推论,原因是。
②丙同学取上述5min后的黄色溶液,滴加盐酸酸化的BaCl2溶液,产生白色沉淀。该同学认为SO2与Fe3+发生氧化还原反应。丁同学认为该结论不严谨,重新设计并进行实验,证明两者发生了氧化还原反应,写出实验方案及现象。
(4)、查阅资料:Fe3+能与S(IV)微粒形成红色配合物。该小组同学分析SO2水溶液成分,猜想可能是其中含S(IV)微粒SO2、H2SO3、与Fe3+形成配合物而使溶液呈现红色。进行如下实验:
序号
实验
加入试剂
现象
I

2mL1mol/LNaHSO3溶液;再滴加几滴盐酸
溶液变成红色,比(3)中溶液红色深;滴加盐酸后,溶液颜色由红色变成黄色
II
2mL1mol/LNa2SO3溶液
溶液变成红色,比I中溶液红色深
①a=。
②根据实验I现象,溶液中SO2、H2SO3浓度增大,红色消失,说明红色物质可能与SO2、H2SO3无关; , 红色物质可能与有关。
(5)、通过上述实验可得结论:①SO2与FeCl3溶液的反应,可以发生配位反应、氧化还原反应。
②。