辽宁省大连市2022-2023学年高二上学期期末考试化学试题
试卷更新日期:2023-02-01 类型:期末考试
一、单选题
-
1. 化学与生产、生活、科技等密切相关。下列说法错误的是A、除去溶液中少量的 , 可选用CuO固体 B、可用作白色颜料和阻燃剂等,在实验室中可用的水解反应制取 C、处理锅炉水垢中的硫酸钙,可以先用饱和碳酸钠溶液浸泡,再用酸除去 D、氯碱工业中使用阳离子交换膜,主要目的是使电解池中形成闭合回路2. 下列说法错误的是A、原子半径:Mg>Al>N B、第一电离能:S>P>Si C、酸性: D、电负性:F>Cl>S3. 蛋白质和核酸是生命的物质基础,其中都含有氮元素。下列化学用语表示正确的是( )A、氮分子的结构式:N≡N B、基态氮原子最外能级的电子云轮廓图:
 C、NH3的球棍模型:
C、NH3的球棍模型: D、基态氮原子核外电子的轨道表示式:
D、基态氮原子核外电子的轨道表示式: 4. 下列说法或表示方法中正确的是A、已知 kJ·mol , kJ·mol , 则a>b B、实验测得在25℃和101 kPa时,1 mol 完全燃烧放出890.3 kJ的热量,则的燃烧热kJ·mol C、氢气的燃烧热 kJ/mol , 则水分解的热化学方程式为: kJ·mol D、在稀溶液中, kJ/mol , 若向1 L 1 mol/L的稀盐酸中加入1 mol NaOH固体,放出的热量为57.3 kJ5. 研究表明N2O与CO在Fe+的作用下会发生如下反应:① , ②。其能量变化示意图如下所示。下列说法错误的是
4. 下列说法或表示方法中正确的是A、已知 kJ·mol , kJ·mol , 则a>b B、实验测得在25℃和101 kPa时,1 mol 完全燃烧放出890.3 kJ的热量,则的燃烧热kJ·mol C、氢气的燃烧热 kJ/mol , 则水分解的热化学方程式为: kJ·mol D、在稀溶液中, kJ/mol , 若向1 L 1 mol/L的稀盐酸中加入1 mol NaOH固体,放出的热量为57.3 kJ5. 研究表明N2O与CO在Fe+的作用下会发生如下反应:① , ②。其能量变化示意图如下所示。下列说法错误的是 A、使反应的活化能变小 B、该催化剂不能有效提高反应物的平衡转化率 C、与CO在不同催化剂表面上转化成与的反应历程完全相同 D、反应①过程中,中的极性键发生了断裂6. 下列说法错误的是A、键角: B、沸点: C、的空间结构为平面三角形 D、是极性分子7. 在相同温度时,100 mL0.01 mol/L醋酸与10 mL0.1 mol/L醋酸相比较,下列数值中,前者大于后者的是A、溶液中H+的物质的量 B、CH3COOH的电离常数 C、中和时所需NaOH的物质的量 D、溶液中CH3COOH的物质的量8. 下列说法错误的是A、生铁中含碳,抗腐蚀能力比纯铁弱 B、用锡焊接的铁质器件,焊接处易生锈 C、电解精炼铜时,阴极反应式为 D、在铁制品上镀铜时,铁制品连接电源的正极9. 已知有关氮、磷的单键和三键的键能数据(单位:kJ·mol)如下表:
A、使反应的活化能变小 B、该催化剂不能有效提高反应物的平衡转化率 C、与CO在不同催化剂表面上转化成与的反应历程完全相同 D、反应①过程中,中的极性键发生了断裂6. 下列说法错误的是A、键角: B、沸点: C、的空间结构为平面三角形 D、是极性分子7. 在相同温度时,100 mL0.01 mol/L醋酸与10 mL0.1 mol/L醋酸相比较,下列数值中,前者大于后者的是A、溶液中H+的物质的量 B、CH3COOH的电离常数 C、中和时所需NaOH的物质的量 D、溶液中CH3COOH的物质的量8. 下列说法错误的是A、生铁中含碳,抗腐蚀能力比纯铁弱 B、用锡焊接的铁质器件,焊接处易生锈 C、电解精炼铜时,阴极反应式为 D、在铁制品上镀铜时,铁制品连接电源的正极9. 已知有关氮、磷的单键和三键的键能数据(单位:kJ·mol)如下表:193
946
197
489
下列说法错误的是
A、1 mol 中含P-P键的数目为 B、中的P原子采取杂化 C、P原子半径较大不易形成π键 D、比( )能量更低所以氮元素通常以形式存在
10. 下列各组离子在指定溶液中一定能大量共存的是A、滴入甲基橙显红色的溶液:、、CO32-、 B、室温下,水电离的 mol/L的溶液:、HCO3-、、 C、室温下,的溶液:、、、 D、室温下,的溶液:、、、11. 下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)( )
)能量更低所以氮元素通常以形式存在
10. 下列各组离子在指定溶液中一定能大量共存的是A、滴入甲基橙显红色的溶液:、、CO32-、 B、室温下,水电离的 mol/L的溶液:、HCO3-、、 C、室温下,的溶液:、、、 D、室温下,的溶液:、、、11. 下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)( )A
B
C
D

NaCl溶于水

电解CuCl2溶液

CH3COOH在水中电离

H2与Cl2反应能量变化
NaCl=Na++Cl−
CuCl2=Cu2++2Cl−
CH3COOHCH3COO−+H+
H2(g)+Cl2(g)=2HCl(g)
ΔH=−183kJ·mol−1
A、A B、B C、C D、D12. 已知 , 用如图针筒装入一定量的和并进行如下实验。下列说法正确的是 A、初态到末态颜色变浅,平衡正向移动 B、平均摩尔质量:末态大于初态 C、初态到末态变大 D、初态到末态减小13. 下列装置或操作不能达到目的的是
A、初态到末态颜色变浅,平衡正向移动 B、平均摩尔质量:末态大于初态 C、初态到末态变大 D、初态到末态减小13. 下列装置或操作不能达到目的的是 A、实验1 制取无水固体 B、实验2 验证氯化银溶解度大于硫化银 C、实验3 测定锌与稀硫酸反应的速率 D、实验4 验证温度对化学平衡的影响14. 我国最近在太阳能光电催化——化学耦合分解硫化氢的研究中获得新进展,相关装置如图所示。下列说法错误的是
A、实验1 制取无水固体 B、实验2 验证氯化银溶解度大于硫化银 C、实验3 测定锌与稀硫酸反应的速率 D、实验4 验证温度对化学平衡的影响14. 我国最近在太阳能光电催化——化学耦合分解硫化氢的研究中获得新进展,相关装置如图所示。下列说法错误的是 A、该工艺中光能最终主要转化为化学能 B、该装置工作时,由a极区流向b极区 C、a极上发生的电极反应为 D、a极区无需补充含和的溶液15. 已知时,向溶液中逐滴加入的盐酸,滴入过程中,溶液中、分布系数【如的分布系数:】与的变化关系如图所示。
A、该工艺中光能最终主要转化为化学能 B、该装置工作时,由a极区流向b极区 C、a极上发生的电极反应为 D、a极区无需补充含和的溶液15. 已知时,向溶液中逐滴加入的盐酸,滴入过程中,溶液中、分布系数【如的分布系数:】与的变化关系如图所示。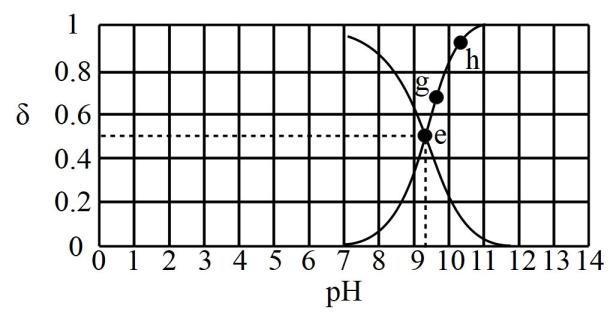
下列叙述错误的是( )
A、水的电离程度: B、的数量级是 C、时, D、时,二、综合题
-
16. 氯吡苯脲(结构简式如图所示)是一种膨大剂,具有加速细胞分裂,促进细胞增大、分化,促进果实增大的作用,属于植物生长调节剂中的一类。
 (1)、氯元素基态原子核外有种不同运动状态的电子,核外电子占据的最高能层符号为。(2)、膨大剂能在动物体内代谢,其产物较为复杂,其中有、、等。
(1)、氯元素基态原子核外有种不同运动状态的电子,核外电子占据的最高能层符号为。(2)、膨大剂能在动物体内代谢,其产物较为复杂,其中有、、等。①请用共价键知识解释分子比分子稳定的原因。
②分子的空间结构是。
(3)、查文献可知,可用2-氯-4-氨基吡啶与苯酯反应,生成氯吡苯脲,其反应方程式如图所示:
①反应过程中,每生成1 mol氯吡苯脲,断裂σ键和π键个数之比为。
②异氰酸苯酯分子中碳原子的杂化方式为;氮元素的第一电离能大于氧元素的原因是。
(4)、人体必需的抗坏血酸分子结构如图所示,推测抗坏血酸在水中的溶解性:(填“难溶”或“易溶”)于水;抗坏血酸分子中有个手性碳原子。 17. 某化学兴趣小组利用0.2000 mol∙L的溶液测定某NaCl、KCl混合溶液中的物质的量浓度。已知25℃时,以下五种物质的如下表所示:
17. 某化学兴趣小组利用0.2000 mol∙L的溶液测定某NaCl、KCl混合溶液中的物质的量浓度。已知25℃时,以下五种物质的如下表所示:物质
AgCl
AgSCN
AgBr
AgI
颜色
白色
白色
砖红色
淡黄色
黄色
(1)、配制250 mL 0.2000 mol∙L的溶液所需的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外还需要(填仪器名称),需用托盘天平称取固体硝酸银的质量为g。(2)、取一定体积的待测液于锥形瓶中,滴加几滴____(填字母)溶液作指示剂。A、KSCN B、 C、KBr D、KI(3)、用(填仪器名称)盛装标准溶液进行滴定,滴定终点的实验现象为。(4)、实验数据记录如下表所示:滴定次数
待测溶液体积/mL
标准溶液体积
滴定前的刻度/mL
滴定后的刻度/mL
第一次
50.00
0.00
25.05
第二次
50.00
4.10
29.10
第三次
50.00
0.40
25.35
则该待测液中,的物质的量浓度为mol/L(保留四位有效数字)。
(5)、下列操作中可导致测定的浓度偏低的是____(填字母)。A.盛装标准溶液的滴定管,未经润洗就直接注入溶液进行实验A、盛装标准液的滴定管在滴定前有气泡,滴定后气泡消失 B、读取溶液体积时,开始时仰视读数,滴定结束时俯视读数 C、锥形瓶内有少量蒸馏水18. 以镁铝复合氧化物()为载体的负载型镍铜双金属催化剂(Ni-Cu/)是一种新型的高效加氢或脱氢催化剂,其制备流程如下: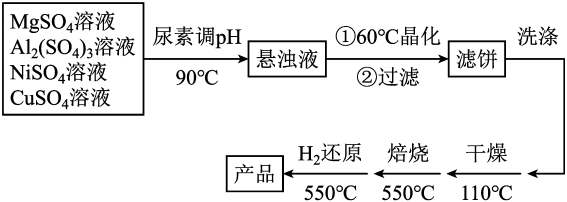
已知:常温下, , 。回答下列问题:
(1)、在元素周期表中,Ni在(填“s”“p”“d”“f”或“ds”)区,基态铜原子的价电子排布式为。(2)、在加热条件下,尿素在水中发生水解反应,放出和(填化学式)两种气体。(3)、“晶化”过程中,需保持恒温60℃,可采用的加热方式为。(4)、常温下,若“悬浊液”中 , 则溶液的。(5)、在消防工业中常用于与小苏打、发泡剂组成泡沫灭火剂,请写出其灭火原理(用离子方程式表示)。19. 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和。研发针对二氧化碳的碳捕捉和碳利用技术是其中的关键。(1)、工业尾气中的可以用NaOH溶液捕获。常温下,如果实验测得捕获后的溶液中 , 则此时溶液的(已知常温下,的;)。(2)、利用制备甲醇,其反应方程式为。已知 kJ·mol
kJ·mol
则该反应的。
(3)、为探究用生产甲醇的反应原理 , 现进行如下实验:在2 L恒温密闭容器中,充入0.04 mol 和0.08 mol , 测得其压强(p)随时间(t)变化(如图)曲线I所示。①用来表示5 min内的化学反应速率。
②其他条件相同时,若只改变某一条件,曲线由I变化为II,则改变的条件是。
③该温度下,此反应的平衡常数(保留三位有效数字)。(用平衡分压代替平衡浓度计算,分压=总压)
 (4)、工业上利用太阳能电池将转化为乙烯,以稀硫酸为电解质溶液,工作原理如图所示。则N极上的电极反应式为;该电解池中所发生的总反应的化学方程式为。
(4)、工业上利用太阳能电池将转化为乙烯,以稀硫酸为电解质溶液,工作原理如图所示。则N极上的电极反应式为;该电解池中所发生的总反应的化学方程式为。