北京市延庆区2022-2023学年高一上学期期末考试化学试题
试卷更新日期:2023-02-01 类型:期末考试
一、单选题
-
1. 下列所用材料不属于合金的是
A.青花瓷罐
B.青铜器
C.飞机外壳(硬铝)
D.不锈钢手术器械



 A、A B、B C、C D、D2. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、盐酸 B、蔗糖溶液 C、Fe(OH)3胶体 D、NaCl溶液3. 下列物质不属于电解质的是A、 B、 C、 D、4. 下列元素不属于短周期的是A、H B、 C、S D、K5. 下列物质含有非极性共价键的是A、 B、 C、 D、6. 下列元素的原子半径最小的是( )A、Na B、Mg C、Al D、Cl7. 下列物质进行焰色试验,其火焰为黄色的是A、 B、 C、 D、8. 下列物质互称同位素的是A、和 B、和 C、和 D、和9. 下列离子方程式书写错误的是A、钠与水反应: B、铁与氯化铁溶液的反应: C、氧化铁放入稀盐酸中: D、碳酸钙与盐酸反应:10. 下列关于物质分类的叙述中,错误的是A、属于单质 B、属于氧化物 C、属于酸 D、属于碱11. 下列关于金属铝的描述中,错误的是A、有银白色金属光泽 B、具有较强的还原性 C、硬度高于硬铝 D、常温下能与空气中的氧气反应12. 下列说法错误的是A、1mol的质量是35.5g B、0.5mol中含有1molO C、的摩尔质量是56g/mol D、1L1mol/L溶液中含有1mol13. 硒()被称为长寿元素、抗癌之王,在机体中充当抗氧化剂。下列关于的说法错误的是A、质子数为34 B、质量数为43 C、中子数为43 D、核外电子数为3414. 下列各组离子能在溶液中大量共存的是A、、、、 B、、、、 C、、、、 D、、、、15. 下列有关性质的比较不能用元素周期律解释的是A、金属性: B、酸性: C、碱性: D、热稳定性:16. 下列“实验结论”与“实验操作及事实”不相符的一组是
A、A B、B C、C D、D2. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、盐酸 B、蔗糖溶液 C、Fe(OH)3胶体 D、NaCl溶液3. 下列物质不属于电解质的是A、 B、 C、 D、4. 下列元素不属于短周期的是A、H B、 C、S D、K5. 下列物质含有非极性共价键的是A、 B、 C、 D、6. 下列元素的原子半径最小的是( )A、Na B、Mg C、Al D、Cl7. 下列物质进行焰色试验,其火焰为黄色的是A、 B、 C、 D、8. 下列物质互称同位素的是A、和 B、和 C、和 D、和9. 下列离子方程式书写错误的是A、钠与水反应: B、铁与氯化铁溶液的反应: C、氧化铁放入稀盐酸中: D、碳酸钙与盐酸反应:10. 下列关于物质分类的叙述中,错误的是A、属于单质 B、属于氧化物 C、属于酸 D、属于碱11. 下列关于金属铝的描述中,错误的是A、有银白色金属光泽 B、具有较强的还原性 C、硬度高于硬铝 D、常温下能与空气中的氧气反应12. 下列说法错误的是A、1mol的质量是35.5g B、0.5mol中含有1molO C、的摩尔质量是56g/mol D、1L1mol/L溶液中含有1mol13. 硒()被称为长寿元素、抗癌之王,在机体中充当抗氧化剂。下列关于的说法错误的是A、质子数为34 B、质量数为43 C、中子数为43 D、核外电子数为3414. 下列各组离子能在溶液中大量共存的是A、、、、 B、、、、 C、、、、 D、、、、15. 下列有关性质的比较不能用元素周期律解释的是A、金属性: B、酸性: C、碱性: D、热稳定性:16. 下列“实验结论”与“实验操作及事实”不相符的一组是实验操作及事实
实验结论
A
绿豆大小的和K分别放入水中,K与水反应更强烈
金属性:
B
向盛有沉淀的两支试管中,分别滴加足量盐酸和溶液,振荡后,均得到无色溶液
是两性氢氧化物
C
将盐酸滴入碳酸钠中得到
非金属性:
D
向KI溶液中滴加氯水,溶液变为棕黄色
氧化性:
A、A B、B C、C D、D17. 铁与水蒸气反应的实验装置如图所示,下列有关该实验的说法错误的是 A、湿棉花的作用是提供水蒸气 B、每消耗3mol , 生成4mol C、点燃酒精灯产生肥皂泡,证明发生了反应 D、铁与水蒸气反应生成的固体产物是18. 下列说法错误的是A、22g在标准状况下的体积约为11.2L B、1mol中含有的电子数约为 C、配置250mL1.0mol/L溶液需要18mol/L溶液的体积约为13.9mL D、1mol与足量反应时,转移的电子数约为19. 下列电子式书写错误的是A、 B、 C、
A、湿棉花的作用是提供水蒸气 B、每消耗3mol , 生成4mol C、点燃酒精灯产生肥皂泡,证明发生了反应 D、铁与水蒸气反应生成的固体产物是18. 下列说法错误的是A、22g在标准状况下的体积约为11.2L B、1mol中含有的电子数约为 C、配置250mL1.0mol/L溶液需要18mol/L溶液的体积约为13.9mL D、1mol与足量反应时,转移的电子数约为19. 下列电子式书写错误的是A、 B、 C、 D、
D、 20. 取等质量的镁粉和铝粉分别放入过量的盐酸和氢氧化钠溶液中,充分反应后产生相同状况下氢气的体积A、镁粉多 B、铝粉多 C、一样多 D、无法判断21. 实现下列变化需要加入氧化剂的是A、 B、 C、 D、22. 下列对图示的解释错误的是
20. 取等质量的镁粉和铝粉分别放入过量的盐酸和氢氧化钠溶液中,充分反应后产生相同状况下氢气的体积A、镁粉多 B、铝粉多 C、一样多 D、无法判断21. 实现下列变化需要加入氧化剂的是A、 B、 C、 D、22. 下列对图示的解释错误的是A
B
C
D
固体在水中形成水合离子

向稀硫酸中加入溶液,溶液导电能力变化

的形成示意图

光照过程中氯水的变化

a时刻稀硫酸与溶液恰好完全反应

降低的原因是氯气逸出
A、A B、B C、C D、D23. 向溶液中依次加入甲、乙、丙三种溶液,进行如下实验:
则甲、乙、丙中的溶液可能是
A、、、 B、、、 C、、、 D、、、24. 下列关于“100mL 0.1 mol∙L−1溶液”的说法正确的是A、该溶液与0.1 mol∙L−1溶液中的相等 B、若取该溶液10mL,其中 C、该溶液中含有的微粒主要有:、、、 D、若取该溶液10mL,恰好能与10mL 0.1 mol∙L−1溶液完全反应25. 下列实验方案中,不能测定和混合物中的质量分数是A、取ag混合物充分加热,减重bg B、取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体 C、取ag混合物与足量氢氧化钠充分反应,加热、蒸干、灼烧,得bg固体 D、取ag混合物与足量溶液充分反应,过滤、洗涤、烘干,得bg固体二、填空题
-
26. 补齐物质与其用途之间的连线如B−a
物质
用途
A.碳酸氢钠
a.作呼吸面具供养剂
B.过氧化钠
b.作食品膨松剂
C.漂粉精
c.作红色颜料
D.氧化铁
d.作游泳池消毒剂
27. 选择完成下列实验的装置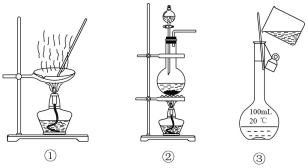 (1)、加热和浓盐酸的混合物制 , 用(填序号,下同)。(2)、从食盐水中获得食盐,用。(3)、配制100mL1.00 mol∙L−1溶液,用。28. 实验室制的化学方程式为。(1)、作氧化剂的物质是 , 锰元素的化合价(填“升高”或“降低”)。(2)、反应中每生成1mol , 消耗的物质的量是mol,转移电子的物质的量是mol。29. 84消毒液是北京某医院在1984年研制成功的一种高效含氯消毒液。该消毒液可由与溶液反应制得,其主要成分为、 , 是无色或淡黄色液体。人们主要利用84消毒液中的氧化性进行消毒。比要稳定的多,虽然也会分解,但它的水溶液在低温下存放三年才分解一半左右。(1)、84消毒液的有效成分是。(2)、84消毒液是由和两种物质组成的混合物。(3)、用与溶液制备84消毒液的反应属于氧化还原反应。(4)、很稳定,高温加热不分解。30. 海洋是巨大的化学资源宝库。从海水中可以制取氯、溴、镁等多种化工产品。(1)、在元素周期表中的位置是第周期、第族。(2)、的最高价氧化物对应的水化物为 , 其中溴元素的化合价是 , 的酸性比的酸性(填“强”或“弱”)。(3)、金属性强于用原子结构解释原因:和位于同一周期,原子核外电子层数相同, , 原子半径大于 , 失电子能力强于。(4)、在元素周期表中,溴()位于第4周期,与同主族。下列实验或事实能说明得电子能力强于的是(填字母)。
(1)、加热和浓盐酸的混合物制 , 用(填序号,下同)。(2)、从食盐水中获得食盐,用。(3)、配制100mL1.00 mol∙L−1溶液,用。28. 实验室制的化学方程式为。(1)、作氧化剂的物质是 , 锰元素的化合价(填“升高”或“降低”)。(2)、反应中每生成1mol , 消耗的物质的量是mol,转移电子的物质的量是mol。29. 84消毒液是北京某医院在1984年研制成功的一种高效含氯消毒液。该消毒液可由与溶液反应制得,其主要成分为、 , 是无色或淡黄色液体。人们主要利用84消毒液中的氧化性进行消毒。比要稳定的多,虽然也会分解,但它的水溶液在低温下存放三年才分解一半左右。(1)、84消毒液的有效成分是。(2)、84消毒液是由和两种物质组成的混合物。(3)、用与溶液制备84消毒液的反应属于氧化还原反应。(4)、很稳定,高温加热不分解。30. 海洋是巨大的化学资源宝库。从海水中可以制取氯、溴、镁等多种化工产品。(1)、在元素周期表中的位置是第周期、第族。(2)、的最高价氧化物对应的水化物为 , 其中溴元素的化合价是 , 的酸性比的酸性(填“强”或“弱”)。(3)、金属性强于用原子结构解释原因:和位于同一周期,原子核外电子层数相同, , 原子半径大于 , 失电子能力强于。(4)、在元素周期表中,溴()位于第4周期,与同主族。下列实验或事实能说明得电子能力强于的是(填字母)。a.将通入溶液中可制得
b.常温常压下,为气态,为液态
c.约500℃开始分解,HCl约1000℃开始缓慢分解
31. 用固体配制100mL1.00mol/L溶液。(1)、计算需要固体的质量为g。(2)、配制溶液时,正确的实验操作顺序是。a.将称好的固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使固体全部溶解并冷却至室温。
b.根据计算结果,称量固体。
c.将配制好的溶液倒入试剂瓶中,并贴好标签。
d.将烧杯中的溶液沿玻璃棒注入100L容量瓶,并用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
e.将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1~2cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠倒,摇匀。
32. 某小组同学为了获取在制备过程中,沉淀颜色的改变与氧气有关的证据,用下图所示装置进行了实验(夹持装置已略去,气密性已检验)。
实验步骤:
Ⅰ.向三颈瓶中加入饱和溶液,按如图1所示装置连接;
Ⅱ.打开磁力搅拌器,立即加入10%溶液;
Ⅲ.采集瓶内空气中含量和溶液中含量()的数据。
实验现象:生成白色絮状沉淀,白色沉淀迅速变为灰绿色,一段时间后部分变为红褐色。
实验数据:

问题与解释:
(1)、三颈瓶中溶液的颜色为 , 盛放溶液的仪器名称为。(2)、生成白色沉淀的离子方程式是。(3)、沉淀颜色发生变化最后变成红褐色的化学方程式是。(4)、通过上述实验,可得到“在制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是。33. 电子工业中,常用溶液腐蚀铜(原理为:)制造印刷线路板。为了从腐蚀废液中回收铜并重新得到溶液,可以采用下列步骤: (1)、上述过程中属于过滤操作的是(填序号)。(2)、加入物质A生成单质的离子方程式是。(3)、滤渣为混合物,物质B是(用化学式表示),作用是。(4)、写出③中通入反应的离子方程式为。(5)、检验溶液中所含金属离子的实验操作和现象为:。(6)、若加入A的物质的量为amol,整个操作过程中生成的物质的量为bmol,若不考虑空气中氧气参与反应,请计算③至少消耗的物质的量为mol。(用含a、b的代数式表示)
(1)、上述过程中属于过滤操作的是(填序号)。(2)、加入物质A生成单质的离子方程式是。(3)、滤渣为混合物,物质B是(用化学式表示),作用是。(4)、写出③中通入反应的离子方程式为。(5)、检验溶液中所含金属离子的实验操作和现象为:。(6)、若加入A的物质的量为amol,整个操作过程中生成的物质的量为bmol,若不考虑空气中氧气参与反应,请计算③至少消耗的物质的量为mol。(用含a、b的代数式表示)