湖北省武汉市硚口区2021-2022学年九年级下学期3月月考化学试题
试卷更新日期:2023-02-01 类型:月考试卷
一、单选题
-
1. 物质的下列性质,属于化学性质的是( )A、颜色、状态 B、密度、硬度 C、氧化性、可燃性 D、熔点、沸点2. 下列实验操作中,正确的是( )A、滴加液体
 B、稀释浓硫酸
B、稀释浓硫酸 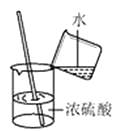 C、检查气密性
C、检查气密性  D、熄灭酒精灯
D、熄灭酒精灯 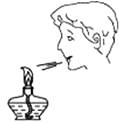 3. 2022年北京冬奥会将于2月4日开幕,下列做法从微观角度解释不合理的是( )A、运动场上用水造冰——温度降低,分子停止运动 B、开幕式上舞台云雾——干冰升华,分子间隔发生改变 C、奥运村中日常消毒——消毒液挥发,分子在不断运动 D、天然气公交车出行——天然气燃烧,分子种类发生改变4. 化学与生活息息相关。下列说法错误的是( )A、用肥皂水区分硬水和软水 B、用汽油或加了洗涤剂的水除去衣服上的油污原理一样 C、生石灰在某些食品的包装袋内做干燥剂 D、服用含氢氧化铝[Al(OH)3]的药物可以治疗胃酸过多症5. 清代医学著作《本草纲目拾遗》中“强水”(含硝酸)的条目下写道“性最烈,能蚀五金”。五金是指金、银、铜、铁、锡,其中银和浓硝酸反应的微观过程如图所示。
3. 2022年北京冬奥会将于2月4日开幕,下列做法从微观角度解释不合理的是( )A、运动场上用水造冰——温度降低,分子停止运动 B、开幕式上舞台云雾——干冰升华,分子间隔发生改变 C、奥运村中日常消毒——消毒液挥发,分子在不断运动 D、天然气公交车出行——天然气燃烧,分子种类发生改变4. 化学与生活息息相关。下列说法错误的是( )A、用肥皂水区分硬水和软水 B、用汽油或加了洗涤剂的水除去衣服上的油污原理一样 C、生石灰在某些食品的包装袋内做干燥剂 D、服用含氢氧化铝[Al(OH)3]的药物可以治疗胃酸过多症5. 清代医学著作《本草纲目拾遗》中“强水”(含硝酸)的条目下写道“性最烈,能蚀五金”。五金是指金、银、铜、铁、锡,其中银和浓硝酸反应的微观过程如图所示。
下列有关该反应说法错误的是( )
A、参加反应的甲、乙物质的质量比为12:7 B、反应生成的丁、戊分子的个数比为1:1 C、反应前后原子的种类、数目不变 D、甲物质由原子构成6. 回收含铜废料(主要成分为Cu)中的铜,部分实验流程如下:注:灼烧后得到黑色固体和残留物,残留物不溶于水和稀硫酸。下列关于该流程的说法,错误的是 A、“灼烧”的主要目的是将Cu转变为CuO B、滤液X中的溶质为FeSO4 C、“酸溶”和“还原”过程中发生的反应均为置换反应 D、在实验室进行过滤操作,用到的玻璃仪器是烧杯、漏斗和玻璃棒7. 下列实验方案设计不合理的是( )A、鉴别固体NaOH与NH4NO3取样,分别溶于水中,观察溶液温度变化 B、除去Cu粉中的Fe粉,加入足量的稀硫酸,过滤、洗涤、干燥 C、检验CaO中含有CaCO3主要实验操作是取样,加入足量稀盐酸,观察现象 D、除去C中的MnO2加入过氧化氢溶液,待无气泡产生后,过滤、洗涤、干燥8. 识别图像是学习化学的必备能力。下列图像能正确反映实验设计的是( )
A、“灼烧”的主要目的是将Cu转变为CuO B、滤液X中的溶质为FeSO4 C、“酸溶”和“还原”过程中发生的反应均为置换反应 D、在实验室进行过滤操作,用到的玻璃仪器是烧杯、漏斗和玻璃棒7. 下列实验方案设计不合理的是( )A、鉴别固体NaOH与NH4NO3取样,分别溶于水中,观察溶液温度变化 B、除去Cu粉中的Fe粉,加入足量的稀硫酸,过滤、洗涤、干燥 C、检验CaO中含有CaCO3主要实验操作是取样,加入足量稀盐酸,观察现象 D、除去C中的MnO2加入过氧化氢溶液,待无气泡产生后,过滤、洗涤、干燥8. 识别图像是学习化学的必备能力。下列图像能正确反映实验设计的是( )序号
①
②
③
④
图像




实验设计
电解水一段时间(忽略气体的溶解)
向盛有一定质量表面被氧化的镁条的烧杯中,慢慢加入一定浓度的盐酸
向稀盐酸中滴加NaOH溶液
向等质量的氧化锌和氢氧化锌中加入质量分数相同的稀盐酸
A、①② B、①③ C、②③ D、③④二、填空题
-
9. 我国力争在2060年前实现“碳中和”(二氧化碳的排放与吸收平衡,实现“零排放”),保护环境。实现“碳中和”通常可采取如下措施:(1)、碳减排:使用氢能源汽车可以有效减少二氧化碳的排放。单质硼(B)可与物质X反应制取氢气,化学方程式为:2B十6X2B(OH)3+3H2↑,则X的化学式为。B(OH)3 , 中B的化合价为。(2)、碳“捕提”与封存:碳“捕提”可用氢氧化钠溶液吸收空气中的二氧化碳,该反应的化学方程式为。10. 甲、乙、丙三种固体物质的溶解度曲线如图所示。回答下列问题
 (1)、a3℃时,甲、乙、丙三种物质溶解度的大小关系是。(2)、a3℃时,将20g物质丙加入50g水中充分溶解,所得溶液的质量为。(3)、已知甲固体中含少量乙,欲得到较纯的甲固体可通过下列步骤达到目的。则正确的步骤顺序是(填序号)。
(1)、a3℃时,甲、乙、丙三种物质溶解度的大小关系是。(2)、a3℃时,将20g物质丙加入50g水中充分溶解,所得溶液的质量为。(3)、已知甲固体中含少量乙,欲得到较纯的甲固体可通过下列步骤达到目的。则正确的步骤顺序是(填序号)。a.过滤 b.溶解 c.加热浓缩 d.洗净干燥 e.降温结晶
(4)、下列说法正确的是____。A、在不改变溶质质量分数的前提下,将甲的不饱和溶液转化为饱和溶液的方法是降低温度 B、a2℃时,甲、丙两物质的饱和溶液中所含溶质的质量相等 C、将a3℃时的甲、乙、丙的饱和溶液降低温度至a1℃,所得溶液的溶质质量分数大小关系为丙>甲>乙 D、a1℃时,用甲、乙、丙三种固体配制等质量的饱和溶液,所需水的质量的大小关系是乙>甲>丙 E、若a3℃时甲的溶解度为50g,将a3℃时甲的饱和溶液300g降温到a1℃,析出甲固体的质量是60g三、综合题
-
11. 某学习小组对铁锈蚀进行探究。(提出问题)铁锈蚀与哪些因素有关?
【查阅资料】
①氯化钙固体可作干燥剂。
②一定条件下,碳可加快铁的锈蚀,但碳本身不参加反应。
③常温常压,氢气密度是dg/mL。
【设计与实验】
(1)、实验一:定性探究铁锈蚀的因素取四枚相同的洁净无锈铁钉分别放入试管,进行下图实验,一周后现象如表。

试管
A
B
C
D
现象
铁钉表面有一层铁锈
铁钉表面无明显变化
铁钉表面无明显变化
铁钉表面有较厚铁锈
对比A、B、C试管中实验现象,说明铁锈蚀主要是与空气中的发生化学反应。写出除铁锈的化学方程式。
(2)、实验二:定量探究铁锈蚀的因素小组设计了如图装置,检查气密性,将5g铁粉和2g碳粉加入三颈烧瓶,t1时刻加入2mL饱和NaCl溶液后,再将一只装有5mL稀盐酸的注射器插到烧瓶上,采集数据。


据图,分析t3时刻压强突然变大的原因是。
(3)、实验三:测定铁锈含量将实验二烧瓶中剩余物质过滤、洗涤、干燥,得mg固体,连接如图装置,检查气密性,加入固体与足量稀盐酸进行实验。

完全反应后,常温常压下测得生成气体体积为VmL,则该固体中铁锈质量分数表达式为。
(4)、该实验条件下测得铁锈质量分数(填“偏大”“偏小”“无影响”)(5)、【反思与评价】与实验一对比,实验二铁锈蚀明显更快的原因是。
12. 甲、乙、丙、丁是初中化学常见的四种不同类别的物质,它们存在如图所示的变化关系,其中“→”表示转化关系,“—”表示相互之间能反应(部分反应物、生成物以及反应条件省略)。已知:甲是日常生产生活中应用广泛的金属,丙的溶液呈蓝色且含有三中元素。 (1)、甲可能是 (填名称);甲和丙反应的基本类型是。(2)、写出乙和丁反应的化学方程式。(3)、向丙溶液中加入一定量的铁粉和锌粉,充分反应后过滤,得到滤渣①和滤液②,往滤渣①中加入乙的稀溶液,没有观察到气泡冒出,则滤液②中一定存在的阳离子有。
(1)、甲可能是 (填名称);甲和丙反应的基本类型是。(2)、写出乙和丁反应的化学方程式。(3)、向丙溶液中加入一定量的铁粉和锌粉,充分反应后过滤,得到滤渣①和滤液②,往滤渣①中加入乙的稀溶液,没有观察到气泡冒出,则滤液②中一定存在的阳离子有。四、计算题
-
13. 某混合物中含有碳和氧化铜粉末。为测量该物质中碳的含量,某化学兴趣小组取12.0g该混合物样品,在隔绝空气的条件下高温加热,反应过程中剩余固体的质量随反应时间的变化关系如图所示,反应结束时氧化铜已完全反应。请计算:
 (1)、生成的二氧化碳质量为。(2)、反应前该样品中碳的质量分数,写出必要的计算过程。(结果精确到0.1%)。
(1)、生成的二氧化碳质量为。(2)、反应前该样品中碳的质量分数,写出必要的计算过程。(结果精确到0.1%)。