湖北省武汉市黄陂区七校联盟2021-2022学年九年级下学期3月质量监测化学试题
试卷更新日期:2023-02-01 类型:月考试卷
一、单选题
-
1. 下列过程中属于化学变化的是( )A、石蜡熔化 B、生石灰加水溶解 C、酒精挥发 D、胆矾研碎2. 下列有关说法正确的是( )A、均一稳定的液体一定是溶液 B、冰块与水混合得到混合物 C、用溶液配制溶液时,仰视量取浓溶液,导致配制的溶液浓度偏高 D、配好的溶液转移至试剂瓶时有少量溅出对溶质质量分数有影响3. 生活中处处有化学,下列说法错误的是( )A、合金属于金属材料 B、煤、石油、天然气不是取之不尽用之不竭的能源 C、洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污 D、可用肥皂水鉴别硬水和软水4. 如图所示,甲和乙在一定条件下反应生成丙和丁.

关于该反应,下列说法正确的是
A、图中只有丁属于氧化物 B、参加反应的甲和乙的质量比为 22:3 C、反应前后分子总数不变 D、反应生成的丙和丁的分子个数比为 2:15. 某些化学概念之间存在如下图所示的关系:
下列有关概念关系的说法正确的是( )
A、饱和溶液与不饱和溶液属于并列关系 B、化合物与混合物属于包含关系 C、化学变化与物理变化属于交叉关系 D、燃烧与氧化反应属于并列关系6. 如图所示的4个实验,根据现象得出的结论错误的是()A、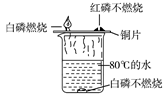 白磷燃烧,红磷不燃烧,说明白磷的着火点比红磷的着火点低
B、
白磷燃烧,红磷不燃烧,说明白磷的着火点比红磷的着火点低
B、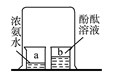 烧杯b中的酚酞溶液变红色,说明分子不断运动
C、
烧杯b中的酚酞溶液变红色,说明分子不断运动
C、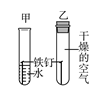 甲试管的铁钉生锈,乙试管的铁钉不生锈,说明只需与水接触铁钉就会生锈
D、
甲试管的铁钉生锈,乙试管的铁钉不生锈,说明只需与水接触铁钉就会生锈
D、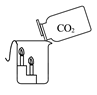 下层蜡烛先熄灭,说明通常状况下二氧化碳不能燃烧,不支持燃烧,且密度大于空气
7. 下列方法不能达到除杂的目的的是( )
下层蜡烛先熄灭,说明通常状况下二氧化碳不能燃烧,不支持燃烧,且密度大于空气
7. 下列方法不能达到除杂的目的的是( )选项
物质(括号内为杂质)
方法
A
N2(O2)
将混合气体通过灼热铜网
B
Fe粉(炭粉)
加入足量稀H2SO4充分反应,过滤、洗涤、干燥
C
CaO(CaCO3)
高温煅烧
D
FeCl2溶液(CuCl2)
加入足量Fe粉,过滤
A、A B、B C、C D、D8. 将一定量的金属M加入到含有硝酸锌、硝酸铜、硝酸银的混合溶液中,充分反应后过滤,得到滤渣和滤液,根据实验分析,下列说法正确的是( )①若滤液为蓝色,则滤渣中一定不含锌和M
②若滤液只含一种溶质,滤渣含四种金属,则几种金属活动性顺序:M>锌>铜>银
③若滤渣含有M,则滤液中的溶质种类最多含3种,最少含一种
④向滤渣中加入稀盐酸产生无色气体,则滤渣中一定含锌,可能含M
A、②④ B、①④ C、②③ D、①③二、填空题
-
9.(1)、水和过氧化氢都是由构成(填“分子”“原子”或“离子”);构成它们的微粒中都有氧(填“分子”“原子”或“元素”);(2)、元素周期表中同一主族的元素具有相似的化学性质,例如硒(Se)和S有相似的化学性质,则图中m= , 硒离子的符号为。
 10. 如图是A、B、C三种固体物质的溶解度曲线。
10. 如图是A、B、C三种固体物质的溶解度曲线。 (1)、t1℃时,B物质溶解度是 ;(2)、t1℃时,将20gA固体投入50g水中,充分溶解后可得到的是 溶液(填“不饱和”、“饱和”或“不能确定”)。(3)、欲配制溶质的质量分数为37.5%的B溶液,应满足的温度范围是 。(4)、下列说法正确的是 ____A、三种物质溶解度大小依次为:A>B>C B、t2℃时,A,B,C的饱和溶液,降温到t1℃时,溶液中溶质的质量分数的大小顺序为:B>A>C C、将温度由t2℃降到t1℃时,析出A的质量比B多 D、若饱和的C溶液中含有少量杂质A,可采用升温结晶的方法提纯C
(1)、t1℃时,B物质溶解度是 ;(2)、t1℃时,将20gA固体投入50g水中,充分溶解后可得到的是 溶液(填“不饱和”、“饱和”或“不能确定”)。(3)、欲配制溶质的质量分数为37.5%的B溶液,应满足的温度范围是 。(4)、下列说法正确的是 ____A、三种物质溶解度大小依次为:A>B>C B、t2℃时,A,B,C的饱和溶液,降温到t1℃时,溶液中溶质的质量分数的大小顺序为:B>A>C C、将温度由t2℃降到t1℃时,析出A的质量比B多 D、若饱和的C溶液中含有少量杂质A,可采用升温结晶的方法提纯C三、综合题
-
11. 铜狮人类最早利用的金属之一。(1)、“湿法炼铜”的原理是硫酸铜溶液与铁反应,该反应的化学方程式为 。
利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如下(反应条件已略去):已知:
2Cu+2H2SO4+O22CuSO4+2H2O
 (2)、①过程Ⅱ中分离操作的名称是 .
(2)、①过程Ⅱ中分离操作的名称是 .②过程Ⅲ中有气体产生,反应的化学方程式为 .
③A~E中含铜、锌两种元素的物质有 (填字母序号).
12. 某化学兴趣小组同学用下列仪器和装置制取乙烯(C2H4),并用过量的氧气将C2H4氧化成CO2和H2O,从而测定乙烯中碳、氢两种元素的质量比,如图所示,请回答下列问题。(据资料:有机物可能伴随少量不完全燃烧生成一种有毒气体;无水氯化钙是一种常见的吸水的干燥剂;NaOH固体可吸收二氧化碳气体。)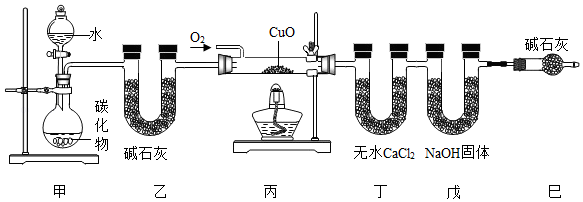 (1)、实验室制备乙炔的化学方程式是;该小组同学受实验制备C2H2的启发,拟用Mg2C2与水反应来制备乙烯,写出该反应的化学方程式。(2)、装置巳的作用是;(3)、实验前称得丁、戊两装置的质量分别为m1g和n1g,实验完毕,称得丁、戊两装置的质量分别变为m2g和n2g,则测定乙烯中碳、氢两种元素的质量比为(列出算式)。(4)、若不接乙装置,则测定结果(填“偏高”、“偏低”或“不变”)。
(1)、实验室制备乙炔的化学方程式是;该小组同学受实验制备C2H2的启发,拟用Mg2C2与水反应来制备乙烯,写出该反应的化学方程式。(2)、装置巳的作用是;(3)、实验前称得丁、戊两装置的质量分别为m1g和n1g,实验完毕,称得丁、戊两装置的质量分别变为m2g和n2g,则测定乙烯中碳、氢两种元素的质量比为(列出算式)。(4)、若不接乙装置,则测定结果(填“偏高”、“偏低”或“不变”)。四、计算题
-
13. 现将8g粗锌(粗锌中的杂质既不溶于水,也不与稀盐酸反应)加入100g溶质质量分数为7.3%的稀盐酸中,恰好完全反应(反应后除杂质外,其余皆溶解,也无需考虑物质的挥发)。试计算:(有效数字保留小数点后一位)(1)、粗锌中锌的质量分数;(2)、恰好完全反应后所得溶液中溶质质量分数。