湖北省黄冈、孝感、咸宁三市2021-2022学年九年级四月教学质量监测化学试题
试卷更新日期:2023-02-01 类型:月考试卷
一、单选题
-
1. 华夏造物历史悠久,《天工开物》记载的下列造物过程中不涉及化学反应的是( )A、冶炼生铁 B、晒制海盐 C、粮食酿酒 D、烧制陶器2. 下列实验操作正确的是( )A、点燃酒精灯
 B、滴加液体
B、滴加液体 C、闻气体的气味
C、闻气体的气味 D、读取液体的体积
D、读取液体的体积 3. 空气和水都是生命活动必需的物质,下列关于空气和水的说法错误的是( )A、空气中氧气的体积分数约为21% B、用肥皂水可鉴别硬水与软水 C、为了节约用水,提倡直接用工业废水灌溉农田 D、电解水实验中,正极产生氧气4. 分类和归纳是学习化学行之有效的方法,下列说法正确的是( )A、铁、锌、钙都属于人体必需的微量元素 B、金刚石、汞都是由原子构成 C、钢、冰水混合物、碘酒都属于混合物 D、棉花、合成橡胶都属于合成材料5. 2022年北京冬奥会,碲化镉发电玻璃成为绿色和科技办奥运交汇的创新点。图1是碲元素在元素周期表中的部分信息,图2是碲原子的原子结构示意图,下列说法正确的是( )
3. 空气和水都是生命活动必需的物质,下列关于空气和水的说法错误的是( )A、空气中氧气的体积分数约为21% B、用肥皂水可鉴别硬水与软水 C、为了节约用水,提倡直接用工业废水灌溉农田 D、电解水实验中,正极产生氧气4. 分类和归纳是学习化学行之有效的方法,下列说法正确的是( )A、铁、锌、钙都属于人体必需的微量元素 B、金刚石、汞都是由原子构成 C、钢、冰水混合物、碘酒都属于混合物 D、棉花、合成橡胶都属于合成材料5. 2022年北京冬奥会,碲化镉发电玻璃成为绿色和科技办奥运交汇的创新点。图1是碲元素在元素周期表中的部分信息,图2是碲原子的原子结构示意图,下列说法正确的是( ) A、x+y=58 B、碲是金属元素 C、碲的相对原子质量为127.6g D、碲原子在化学反应中容易失去电子6. 下列有关实验的说法正确的是( )A、用过氧化氢制取氧气实验中,可以用硫酸铜溶液或红砖粉末替代二氧化锰作催化剂 B、在粗盐中难溶性杂质的去除实验中,当蒸发皿中没有液体时,停止加热 C、实验室用CO和Fe2O3模拟工业炼铁,操作顺序是先加热再通入 CO气体 D、在中和反应实验中,试剂添加顺序为∶氢氧化钠溶液、酚酞、稀盐酸。若改为∶稀盐酸、酚酞、氢氧化钠溶液,则不能证明发生了中和反应7. 为减少温室气体排放,人们积极寻找不含碳元素的燃料。经研究发现氨气燃烧的产物没有污染,且释放大量能量,有一定应用前景。其反应的微观示意图如图,下列说法正确的是( )
A、x+y=58 B、碲是金属元素 C、碲的相对原子质量为127.6g D、碲原子在化学反应中容易失去电子6. 下列有关实验的说法正确的是( )A、用过氧化氢制取氧气实验中,可以用硫酸铜溶液或红砖粉末替代二氧化锰作催化剂 B、在粗盐中难溶性杂质的去除实验中,当蒸发皿中没有液体时,停止加热 C、实验室用CO和Fe2O3模拟工业炼铁,操作顺序是先加热再通入 CO气体 D、在中和反应实验中,试剂添加顺序为∶氢氧化钠溶液、酚酞、稀盐酸。若改为∶稀盐酸、酚酞、氢氧化钠溶液,则不能证明发生了中和反应7. 为减少温室气体排放,人们积极寻找不含碳元素的燃料。经研究发现氨气燃烧的产物没有污染,且释放大量能量,有一定应用前景。其反应的微观示意图如图,下列说法正确的是( ) A、甲、乙、丙、丁都是化合物 B、甲物质中两种元素的质量比为1:3。 C、参加反应的甲、乙分子个数比为2∶3 D、反应生成的丙与丁的质量比为14:278. 如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。下列说法正确的是( )
A、甲、乙、丙、丁都是化合物 B、甲物质中两种元素的质量比为1:3。 C、参加反应的甲、乙分子个数比为2∶3 D、反应生成的丙与丁的质量比为14:278. 如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。下列说法正确的是( ) A、t1℃时,三种物质的溶解度大小关系为甲>乙>丙 B、t2℃时,将30g 甲加入70g 水中,得到100g饱和溶液 C、t3℃时,用等质量的甲、乙、丙配成饱和溶液,需要水的质量大小关系是乙>甲>丙 D、将t2℃的三种物质的饱和溶液分别降温到t1℃,所得溶液的溶质质量分数大小关系为乙>丙>甲9. 下列实验方案能达到相应实验目的的是选项( )
A、t1℃时,三种物质的溶解度大小关系为甲>乙>丙 B、t2℃时,将30g 甲加入70g 水中,得到100g饱和溶液 C、t3℃时,用等质量的甲、乙、丙配成饱和溶液,需要水的质量大小关系是乙>甲>丙 D、将t2℃的三种物质的饱和溶液分别降温到t1℃,所得溶液的溶质质量分数大小关系为乙>丙>甲9. 下列实验方案能达到相应实验目的的是选项( )选项
实验目的
实验方案
A
检验CH4、H2、O2三种气体
将燃着的木条分别入集气瓶中
B
鉴别K2SO4和尿素[CO(NH2)2]两种化肥
取样,分别与熟石灰混合研磨,闻气味
C
验证Al、Cu、Ag的金属活动性顺序
将打磨过的铝丝、银丝分别浸入硫酸铜溶液中
D
除去CO2中混有的少量CO
点燃
A、A B、B C、C D、D10. 在5.6g 铁粉中,先逐滴加入一定量的硝酸铜溶液,充分反应后再逐滴加入硝酸银溶液,固体质量与所加溶液总质量的关系如图所示。下列有关说法正确的是( )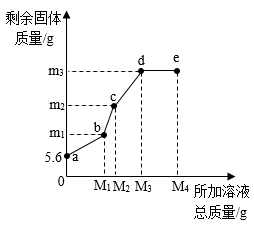 A、b点时,生成铜的质量等于m1g B、be段反应的化学方程式为Cu+2AgNO3=2Ag+Cu(NO3)2 C、e点时,溶液中含有的溶质有2种 D、m3的数值为21.6
A、b点时,生成铜的质量等于m1g B、be段反应的化学方程式为Cu+2AgNO3=2Ag+Cu(NO3)2 C、e点时,溶液中含有的溶质有2种 D、m3的数值为21.6二、填空题
-
11. 化学在生产,生活中有着广泛应用。现有①熟石灰 ②氢氧化钠③明矾④活性炭,选择适当的物质填空(填序号)。(1)、A.可用作冰箱除味剂的是 B.可用来改良酸性土壤的是(2)、炒菜时菜锅中出现了较大火苗,可以采取的有效灭火措施是(3)、妈妈为你准备的午餐有∶米饭、红烧鱼块、青菜、五花肉,其中主要含蛋白质的食物是。(4)、冬奥会火炬"飞扬"采用氢气作为燃料,体现了绿色办奥运的理念,氢气燃料实现"零排放"的原因是(用化学方程式解释)。12.(1)、到2022年,元素周期表已经诞生153周年,世界上第一张元素周期表是由(填字母序号)绘制完成的。
a.道尔顿 b.侯德榜 c.拉瓦锡 d.门捷列夫
(2)、请依据H、O、Cl、Na、Fe、Cu元素回答下列问题。写出一种常温下为液态的氧化物的化学式
(3)、用一种物质就能把Na2CO3、KOH、AgNO3三种无色溶液区分开,该物质的化学式为(4)、写出在加热条件下发生置换反应的一个化学方程式∶(5)、甲、乙、丙、丁是由上述元素组成的不同类别的物质,"—一"表示相邻的两种物质在溶液中能发生反应。若甲为铁,则下列判断错误的是(填字母序号)
a.乙可能是 CuCl2
b.丙一定是碱
c.丁一定是HCl
d.丙与乙、丙与丁之间发生的反应一定是复分解反应
三、综合题
-
13. 在抗击"新冠肺炎病毒"期间,消毒剂在公共场所进行卫生防疫时发挥着重要作用。二氧化氯(ClO2)是一种高效、广谱、安全的杀菌消毒剂。以粗盐水(含可溶性杂质MgSO4;CaCl2)为原料,制取ClO2的工艺流程如图∶
 (1)、实验室进行操作I、Ⅱ时需要用到的玻璃仪器有烧杯、玻璃棒和(2)、写出NaClO3中氯元素的化合价(3)、步骤②加入过量Na2CO3溶液的作用是(4)、步骤④中发生反应的化学方程式为(5)、如图流程中可循环利用的物质除氯化钠外,还有14. 氯酸钾可用于实验室制取氧气和火药等,实验室中制备KClO3的化学方程式为∶3Cl2+6KOH=5KCl+KClO3+3H2O。若用Cl2与500g的KOH溶液恰好完全反应,反应后溶液质量为542.6g。计算所用KOH溶液中溶质的质量分数。(通过化学方程式进行计算)15. 实验室常用如图所示装置完成气体的制备及性质实验。
(1)、实验室进行操作I、Ⅱ时需要用到的玻璃仪器有烧杯、玻璃棒和(2)、写出NaClO3中氯元素的化合价(3)、步骤②加入过量Na2CO3溶液的作用是(4)、步骤④中发生反应的化学方程式为(5)、如图流程中可循环利用的物质除氯化钠外,还有14. 氯酸钾可用于实验室制取氧气和火药等,实验室中制备KClO3的化学方程式为∶3Cl2+6KOH=5KCl+KClO3+3H2O。若用Cl2与500g的KOH溶液恰好完全反应,反应后溶液质量为542.6g。计算所用KOH溶液中溶质的质量分数。(通过化学方程式进行计算)15. 实验室常用如图所示装置完成气体的制备及性质实验。 (1)、加热高锰酸钾制取氧气,发生反应的化学方程式为(2)、实验室用加热氯化铵和氢氧化钙固体混合物的方法来制取氨气。氨气密度比空气密度小,极易溶于水。应选择的制取装置是(填字母)。(3)、用F装置验证CO2的性质,a、c为喷水的紫色石蕊试纸,b为干燥的紫色石蕊试纸。能证明 CO2的密度比空气大且能与水发生反应的现象是16. 某同学春游时带了一包自加热食品,进餐时不用火,不用电,拆开发热包倒入凉水,就能享用美味。同学们对该自加热食品产生了强烈兴趣,于是进行了如下实验探究。
(1)、加热高锰酸钾制取氧气,发生反应的化学方程式为(2)、实验室用加热氯化铵和氢氧化钙固体混合物的方法来制取氨气。氨气密度比空气密度小,极易溶于水。应选择的制取装置是(填字母)。(3)、用F装置验证CO2的性质,a、c为喷水的紫色石蕊试纸,b为干燥的紫色石蕊试纸。能证明 CO2的密度比空气大且能与水发生反应的现象是16. 某同学春游时带了一包自加热食品,进餐时不用火,不用电,拆开发热包倒入凉水,就能享用美味。同学们对该自加热食品产生了强烈兴趣,于是进行了如下实验探究。【查阅资料】发热包中物质的主要成分是生石灰、活性炭、铝粉、铁粉、碳酸钠;铝粉能与氢氧化钠溶液反应,产生H2.
(1)、探究一∶发热包的发热原理。将发热包中固体倒入烧杯中,加入适量水,发生剧烈反应,水很快沸腾。写出该过程中生石灰与水反应的化学方程式∶反应结束后,烧杯底部有大量固体,继续加水搅拌,过滤、洗涤、干燥,得到固体混合物。
(2)、探究二∶固体混合物的成分。【设计实验】①取少量固体混合物于试管中,加水振荡,静置,滴入几滴酚酞溶液,溶液变为红色,证明固体混合物中含有
②另取少量固体混合物于锥形瓶中(如图),加入过量稀盐酸充分反应。同学们观察到锥形瓶底部有剩余固体,溶液变浅绿色,烧杯中澄清石灰水变浑浊。证明固体混合物中含有;若将分液漏斗中稀盐酸替换成氢氧化钠溶液,在滴加过程中无明显现象,证明固体混合物中
 (3)、探究三∶发热包中碳酸钠的质量分数。
(3)、探究三∶发热包中碳酸钠的质量分数。【设计实验】同学们设计并进行了如图所示的实验。(装置气密性良好)

【实验结论】实验前准确称取mg样品,实验完成后测得A装置增重ag,C装置增重b g,则样品中碳酸钠的质量分数为(用含上述有关字母的代数式表示)。
(4)、【实验反思】①实验过程中需持续缓缓通入空气,其作用有∶搅拌B、C中的反应物,使其充分反应和
②若没有A装置,直接通入空气,则测得碳酸钠的质量分数(填"偏大"、"偏小"或"不变")。