黑龙江省大庆市肇州县2021-2022学年九年级下学期第一次联考化学试题
试卷更新日期:2023-02-01 类型:月考试卷
一、单选题
-
1. 成语是中华传统文化的瑰宝。下列成语中包含化学变化的是( )A、刻舟求剑 B、花香四溢 C、钻木取火 D、抽刀断水2. 下列实验操作正确的是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列利用了乳化原理的是( )A、用汽油除去衣服上的油污 B、用稀硫酸除铁锈 C、用洗洁精除去餐具上的油污 D、用盐酸除去水垢4. 下列应用的原理(用化学方程式表示)及其基本反应类型均正确的是( )A、用氢氧化钠溶液吸收二氧化碳气体:2NaOH+CO2=Na2CO3+H2O复分解反应 B、用硝酸银溶液证明铁的活动性大于银:Fe+3AgNO3=3Ag+Fe(NO3)3置换反应 C、沼气燃烧:2CO+O22CO2化合反应 D、用含有氢氧化铝的药物治疗胃酸过多症:Al(OH)3+3HCl=AlCl3+3H2O复分解反应5. 推理是化学学习中常用的思维方法。以下推理正确的是( )A、单质中只含有一种元素,因此只含有一种元素的物质一定是单质 B、碱的溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液一定呈碱性 C、中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 D、在化合物里,正负化合价的代数和为零,所以在同一化合物中金属元素显正价,则非金属元素一定显负价6. 分类是化学学习过程中常用的方法,下列分类中错误的是( )A、氧化物:生石灰、铁锈和“干冰” B、复合肥:磷酸二氢铵、磷酸氢二铵、硝酸钾 C、单质:金刚石、液氧和铜粉 D、合成材料:合成纤维、塑料和合成橡胶7. 甲、乙两种物质的溶解度曲线如图1所示。下列说法中正确的是( )
3. 下列利用了乳化原理的是( )A、用汽油除去衣服上的油污 B、用稀硫酸除铁锈 C、用洗洁精除去餐具上的油污 D、用盐酸除去水垢4. 下列应用的原理(用化学方程式表示)及其基本反应类型均正确的是( )A、用氢氧化钠溶液吸收二氧化碳气体:2NaOH+CO2=Na2CO3+H2O复分解反应 B、用硝酸银溶液证明铁的活动性大于银:Fe+3AgNO3=3Ag+Fe(NO3)3置换反应 C、沼气燃烧:2CO+O22CO2化合反应 D、用含有氢氧化铝的药物治疗胃酸过多症:Al(OH)3+3HCl=AlCl3+3H2O复分解反应5. 推理是化学学习中常用的思维方法。以下推理正确的是( )A、单质中只含有一种元素,因此只含有一种元素的物质一定是单质 B、碱的溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液一定呈碱性 C、中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 D、在化合物里,正负化合价的代数和为零,所以在同一化合物中金属元素显正价,则非金属元素一定显负价6. 分类是化学学习过程中常用的方法,下列分类中错误的是( )A、氧化物:生石灰、铁锈和“干冰” B、复合肥:磷酸二氢铵、磷酸氢二铵、硝酸钾 C、单质:金刚石、液氧和铜粉 D、合成材料:合成纤维、塑料和合成橡胶7. 甲、乙两种物质的溶解度曲线如图1所示。下列说法中正确的是( )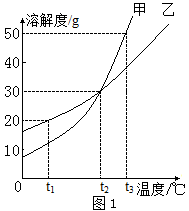 A、t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液 B、t2℃时,甲、乙饱和溶液的溶质质量分数都为30% C、t2℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和 D、t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙8. 下列图像与对应叙述正确的是( )A、
A、t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液 B、t2℃时,甲、乙饱和溶液的溶质质量分数都为30% C、t2℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和 D、t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙8. 下列图像与对应叙述正确的是( )A、 向一定量的稀硫酸中加入锌粒
B、
向一定量的稀硫酸中加入锌粒
B、 向pH=1的溶液中加水
C、
向pH=1的溶液中加水
C、 加热KClO3和MnO2的混合物制O2
D、
加热KClO3和MnO2的混合物制O2
D、 向等质量的铝粉和镁粉中分别滴入质量分数相同的足量的稀盐酸
9. 下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )
向等质量的铝粉和镁粉中分别滴入质量分数相同的足量的稀盐酸
9. 下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )选项
待提纯的物质
选用的试剂或操作方法
A
KNO3溶液(KOH)
加入适量氯化铁溶液,过滤
B
Cu(CuO)
加入足量的稀盐酸,过滤、洗涤、干燥
C
CO2(CO)
点燃
D
KCl(MnO2)
加入足量的水溶解,过滤、洗涤、干燥
A、A B、B C、C D、D10. 在硝酸银、硝酸铜的混合溶液中加入一定量锌粉,反应停止后过滤,滤液仍为蓝色。有关判断正确的是( )A、滤渣中一定有银,没有铜和锌 B、滤液中一定有硝酸锌、硝酸铜,可能有硝酸银 C、滤液中一定有硝酸锌、硝酸铜、硝酸银 D、滤渣中一定有银和锌,可能有铜二、填空题
-
11. 某方便面的营养成分表如下(其中碳水化合物主要指淀粉等):
营养成分表
项目每100克
能量 1966千焦
蛋白质 7.5克
脂肪 21.8克
碳水化合物 60.7克
钠 2530毫克
(1)、表中“钠”是指____(填序号)。A、离子 B、分子 C、元素 D、单质(2)、方便面中含的营养素有种。(3)、方便面中使用的食盐可以是加碘盐,人体中缺碘可能患有的疾病是。(4)、若小明用天然气煮方便面,请问天然气主要成分燃烧的化学方程式是。(5)、若用漏勺捞煮好的方便面,与化学基本操作中的原理相似。12. 元素周期表是学习和研究化学的重要工具。回答下列问题:(1)、元素周期表中不同元素间最本质的区别是____(填字母)。A、质子数不同 B、中子数不同 C、相对原子质量不同(2)、1869年,____(填字母)发现了元素周期律并编制出元素周期表。A、张青莲 B、门捷列夫 C、拉瓦锡(3)、元素周期表中氟元素的有关信息如下图所示,下列说法正确的是____(填字母)。 A、氟属于金属元素 B、氟的原子序数是9 C、氟的相对原子质量是19.00g(4)、氟离子结构示意图为 , 氟原子在化学反应中易得到电子,由钠元素和氟元素组成的化合物的化学式为。
A、氟属于金属元素 B、氟的原子序数是9 C、氟的相对原子质量是19.00g(4)、氟离子结构示意图为 , 氟原子在化学反应中易得到电子,由钠元素和氟元素组成的化合物的化学式为。三、综合题
-
13. 实验室制取气体时需要的一些装置以及其他实验装置如图所示,请回答下列问题。

 (1)、写出标有序号的仪器名称:①;(2)、装置A可以制取氧气,选择的药品名称是 , 检验二氧化碳是否收集满的操作方法是。(3)、用M装置测量空气中氧气含量偏小的原因(任意填一点,下同),若改为N装置,其优点为。(4)、用A装置和C装置制取氧气后,应先从水槽中拿出导气管,后熄灭酒精灯的理由是。14. 如图表示物质间转化关系(反应条件和部分产物已略)。常温下A、C是由相同元素组成的无色液体,且A具有消毒杀菌作用:D、I、J均为无色气体,其中I能使澄清的石灰水变浑浊;K为红棕色粉末。请回答下列问题:
(1)、写出标有序号的仪器名称:①;(2)、装置A可以制取氧气,选择的药品名称是 , 检验二氧化碳是否收集满的操作方法是。(3)、用M装置测量空气中氧气含量偏小的原因(任意填一点,下同),若改为N装置,其优点为。(4)、用A装置和C装置制取氧气后,应先从水槽中拿出导气管,后熄灭酒精灯的理由是。14. 如图表示物质间转化关系(反应条件和部分产物已略)。常温下A、C是由相同元素组成的无色液体,且A具有消毒杀菌作用:D、I、J均为无色气体,其中I能使澄清的石灰水变浑浊;K为红棕色粉末。请回答下列问题: (1)、反应①中B物质的作用是。(2)、图中标出的反应①到⑦中是化合反应的是(填序号)。(3)、在图中标出的12种物质中,单质有种。(4)、反应③中的现象是。(5)、⑤是反应(填“放热”或者“吸热”)(6)、写出反应⑥的化学方程式。15. 铝在地壳中主要以铝土矿的形式存在,铝土矿的主要成分为Al2O3(含有少量Fe2O3、SiO2等杂质)。工业上冶炼铝的工艺流程见图:
(1)、反应①中B物质的作用是。(2)、图中标出的反应①到⑦中是化合反应的是(填序号)。(3)、在图中标出的12种物质中,单质有种。(4)、反应③中的现象是。(5)、⑤是反应(填“放热”或者“吸热”)(6)、写出反应⑥的化学方程式。15. 铝在地壳中主要以铝土矿的形式存在,铝土矿的主要成分为Al2O3(含有少量Fe2O3、SiO2等杂质)。工业上冶炼铝的工艺流程见图: (1)、铝土矿中的SiO2不溶于水,也不与盐酸反应,操作①的目的是。(2)、操作③得到的 受热分解生成Al2O3 , 该反应的化学方程式为 , 铝土矿经过操作①~④的目的是。(3)、在冰晶石作助熔剂条件下,高温电解Al2O3得到金属铝,该反应的化学方程式为。16. 经调查,市场上有一种食品专用发热包。发热包中物质的主要成分是生石灰、碳酸钠、铝粉。某化学小组为探究发热包中各物质的成分,进行了如下实验。
(1)、铝土矿中的SiO2不溶于水,也不与盐酸反应,操作①的目的是。(2)、操作③得到的 受热分解生成Al2O3 , 该反应的化学方程式为 , 铝土矿经过操作①~④的目的是。(3)、在冰晶石作助熔剂条件下,高温电解Al2O3得到金属铝,该反应的化学方程式为。16. 经调查,市场上有一种食品专用发热包。发热包中物质的主要成分是生石灰、碳酸钠、铝粉。某化学小组为探究发热包中各物质的成分,进行了如下实验。查阅资料:①H2在加热条件下能还原金属氧化物;②无水硫酸铜遇水会变成蓝色。
(1)、探究一:发热包发热的原理取少量发热包中物质于试管中,加入适量的水;小明用手触摸试管外壁,发烫,说明发热包中的物质含有。
(2)、探究二:为了进一步探究发热包中各物质的成分。小亮向上述试管中加入稀盐酸,并对产生的气体展开进一步探究。【猜想与假设】
a.H2;b.;c.CO2和H2的混合气体。
(3)、【实验设计】小明同学设计如下图所示实验装置,对气体成分进行探究。
【实验验证]A装置中的实验现象是 , 反应的化学方程式为。D装置中黑色粉末逐渐变为红色,E装置中的实验现象是 , 证明猜想c正确。
(4)、【总结与反思] B装置的作用是 , 写出D装置中发生反应的化学方程式。17. 某校研究性学习小组用右图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶容积的70%。 (1)、燃烧、冷却后打开止水夹,水能进入集气瓶中的原理是。(2)、如果镁条只和空气中的氧气反应。则进入集气瓶中水的体积最多不超过其容积的%。现进入集气瓶中水的体积约为容积的 70%,根据空气的组成可推出减少的气体中有。
(1)、燃烧、冷却后打开止水夹,水能进入集气瓶中的原理是。(2)、如果镁条只和空气中的氧气反应。则进入集气瓶中水的体积最多不超过其容积的%。现进入集气瓶中水的体积约为容积的 70%,根据空气的组成可推出减少的气体中有。已知:镁在空气中燃烧生成氧化镁和氮化镁(Mg3N2),氮化镁与水反应生成氢氧化镁和氨气。
(3)、写出氮化镁与水反应的化学方程式;(4)、ag镁在空气中完全燃烧生成固体的总质量m为;(用含a的式子表示m的取值范围)(5)、某同学对该混合物中氮化镁的质量分数进行测定,设计如下实验装置。
【查阅资料】
Ⅰ.碱石灰是固体氧化钙和氢氧化钠的混合物,常用作干燥剂,不与NH3反应;
Ⅱ.;Ⅲ.NH3是一种极易溶于水的气体。
【实验步骤】①检查装置的气密性;
②精确称量镁在空气中燃烧后的固体5.00g放入锥形瓶中,称量装置C,连接装置;
③关闭活塞K,打开A中的分液漏斗活塞,逐滴加入水,至样品恰好完全反应;
④打开活塞K,鼓入空气;⑤再次称量装置C,装置C增重0.34g。请回答:
a.装置B的作用是;b.装置D的作用是;
c.实验步骤④中鼓入空气的目的是;
d.固体混合物中Mg3N2的质量分数为;
e.实验证明此方法测定的结果偏低,可能的原因是。(写一条)
四、计算题
-
18. 现有含硫酸和硫酸铜的混合溶液50g,将一定质量分数的氢氧化钠溶液分四次加入到该混合液中,生成沉淀的质量与加入氢氧化钠的溶液的质量关系如表。
次数
1
2
3
4
加入氢氧化钠溶液的质量合计/g
50
65
80
100
生成的沉淀质量/g
0.98
1.96
2.94
2.94
请回答:
(1)、加入50g氢氧化钠溶液后,混合溶液中所含的阳离子为 (填离子符号)。(2)、混合溶液中硫酸铜的质量分数是多少?(3)、画出在该混合溶液中加入氢氧化钠溶液质量与生成沉淀质量变化关系的曲线(标出折点坐标)。