安徽省淮南市东部地区2021-2022学年九年级下学期第五次阶段学生自我测试化学试题
试卷更新日期:2023-02-01 类型:月考试卷
一、单选题
-
1. 探究金属的性质实验过程发生了化学变化的是( )A、打磨铝片和铜片 B、观察铝片和铜片的颜色 C、将铝片和铜片相互刻画 D、将铝片放入稀盐酸中2. 2021年3月20日,在成都举行的“考古”中国重大项目工作进展会上通报,三星堆遗址新发现6座三星堆文化“祭祀坑”,出土了青铜面具、青铜神树、瓷器等重要文物,其中青铜是人类最早使用的铜、锡合金。下列有关这些文物的说法中,错误的是( )A、青铜耐腐蚀 B、青铜属于混合物 C、青铜的硬度大于铜或锡 D、青铜和氧化铜都属于金属材料3. 下列正确的实验操作是( )A、收集氧气
 B、处理废弃药品
B、处理废弃药品 C、塞紧橡皮塞
C、塞紧橡皮塞 D、过滤
D、过滤 4. 生活中处处有化学,下列说法错误的是( )A、山药中富含硒,这里的“硒”是指元素 B、洗涤剂去油污的原理是利用洗涤剂的乳化作用 C、将植物油与水混合振荡可以得到溶液 D、消毒用的碘酒中,碘是溶质、酒精是溶剂5. 有两瓶硝酸钾溶液,已知一瓶为饱和溶液,另一瓶为不饱和溶液。下列实验操作一定无法区分这两瓶溶液的是( )A、加入一定量的水 B、加入少量的硝酸钾晶体 C、略降低温度 D、恒温蒸发少量水6. 下列事实的结论或解释错误的是( )A、水银温度计可以测量温度一一温度升高,原子间的间隔变大 B、喝完汽水后会打嗝一一气体的溶解度随温度升高而增大 C、电解水生成氢气和氧气一一水由氢元素和氧元素组成 D、打开汽水瓶盖汽水自动喷出一一气体的溶解度随压强的减小而减小7. 使20g 20%的食盐水的质量分数变为一半,可采取的方法( )A、蒸发掉10g水 B、加入10g水 C、加入10g食盐 D、加入20g水8. 有X、Y、Z三种金属,将三种金属分别浸入稀硫酸中,Y溶解并放出氢气,X、Z不溶解;将X浸入Z的硫酸盐溶液中,在X的表面有Z析出。则三种金属的活动性由强到弱排列顺序正确的是( )A、X>Y>Z B、Y>X>Z C、Y>Z>X D、X>Z>Y9. 甲烷和水反应可以制水煤气(混合气体),其反应的微观示意图如图所示:
4. 生活中处处有化学,下列说法错误的是( )A、山药中富含硒,这里的“硒”是指元素 B、洗涤剂去油污的原理是利用洗涤剂的乳化作用 C、将植物油与水混合振荡可以得到溶液 D、消毒用的碘酒中,碘是溶质、酒精是溶剂5. 有两瓶硝酸钾溶液,已知一瓶为饱和溶液,另一瓶为不饱和溶液。下列实验操作一定无法区分这两瓶溶液的是( )A、加入一定量的水 B、加入少量的硝酸钾晶体 C、略降低温度 D、恒温蒸发少量水6. 下列事实的结论或解释错误的是( )A、水银温度计可以测量温度一一温度升高,原子间的间隔变大 B、喝完汽水后会打嗝一一气体的溶解度随温度升高而增大 C、电解水生成氢气和氧气一一水由氢元素和氧元素组成 D、打开汽水瓶盖汽水自动喷出一一气体的溶解度随压强的减小而减小7. 使20g 20%的食盐水的质量分数变为一半,可采取的方法( )A、蒸发掉10g水 B、加入10g水 C、加入10g食盐 D、加入20g水8. 有X、Y、Z三种金属,将三种金属分别浸入稀硫酸中,Y溶解并放出氢气,X、Z不溶解;将X浸入Z的硫酸盐溶液中,在X的表面有Z析出。则三种金属的活动性由强到弱排列顺序正确的是( )A、X>Y>Z B、Y>X>Z C、Y>Z>X D、X>Z>Y9. 甲烷和水反应可以制水煤气(混合气体),其反应的微观示意图如图所示:
根据以上微观示意图得出的结论中,正确的是( )
A、反应前后各元素的化合价均不变 B、该反应化学方程式中甲烷和水的计量数之比为1:1 C、该反应中含氢元素的化合物有3种 D、该反应属于置换反10. 利用如图所示实验装置模拟工业炼铁。下列说法错误的是( ) A、实验时应先通CO一段时间再点燃酒精灯 B、b处可用澄清石灰水检验生成的CO2 C、充分加热,a处固体由红棕色变为黑色 D、可用水吸收尾气中的CO11. 向如图试管里的水中加入下述某种物质后,原来U型管内在同一水平上的红墨水,右边液面降低了些,左边液面上升了些,则加入的物质是( )
A、实验时应先通CO一段时间再点燃酒精灯 B、b处可用澄清石灰水检验生成的CO2 C、充分加热,a处固体由红棕色变为黑色 D、可用水吸收尾气中的CO11. 向如图试管里的水中加入下述某种物质后,原来U型管内在同一水平上的红墨水,右边液面降低了些,左边液面上升了些,则加入的物质是( ) A、硝酸铵 B、生石灰 C、活性炭 D、氢氧化钠12. 三种固体物质a、b、c的溶解度曲线如图所示,则下列说法正确的是( )
A、硝酸铵 B、生石灰 C、活性炭 D、氢氧化钠12. 三种固体物质a、b、c的溶解度曲线如图所示,则下列说法正确的是( ) A、分别将三种物质的饱和溶液从t2℃降至t1℃时,所得溶液溶质的质量分数为b>a=c B、a、b、c三种物质的饱和溶液从t2℃降温到t1℃时都有晶体析出 C、t2℃时,将30ga物质加入到50g水中充分溶解后得到80g饱和溶液 D、a中混有少量b时可采取降温结晶的方法提纯得到a
A、分别将三种物质的饱和溶液从t2℃降至t1℃时,所得溶液溶质的质量分数为b>a=c B、a、b、c三种物质的饱和溶液从t2℃降温到t1℃时都有晶体析出 C、t2℃时,将30ga物质加入到50g水中充分溶解后得到80g饱和溶液 D、a中混有少量b时可采取降温结晶的方法提纯得到a二、填空题
-
13. 金属制品与我们的日常生活密不可分。(1)、用铜丝作导线利用了铜的延展性和性。(2)、通常在铁栏杆表面喷涂油漆,其防锈原理是。(3)、铝制品耐腐蚀是因其表面生成了致密的氧化铝薄膜,该反应的化学方程式为。(4)、将一定量的铝、铜粉末混合物加入硝酸银溶液中,充分反应后过滤,滤液为蓝色,滤渣中一定含有。
三、综合题
-
14. 现配制100g溶质质量分数为15%的氯化钠溶液,实验操作如下:
 (1)、写出图中标号a仪器的名称。(2)、配制100g溶质质量分数为15%的氯化钠溶液所需氯化钠的质量是g,应选用(10、50或100)mL量筒量取蒸馏水。(3)、正确的操作步骤是(填字母)。(4)、D操作中玻璃棒的作用是。(5)、下列不正确操作可能导致溶液溶质质量分数小于15%的是(填序号)。
(1)、写出图中标号a仪器的名称。(2)、配制100g溶质质量分数为15%的氯化钠溶液所需氯化钠的质量是g,应选用(10、50或100)mL量筒量取蒸馏水。(3)、正确的操作步骤是(填字母)。(4)、D操作中玻璃棒的作用是。(5)、下列不正确操作可能导致溶液溶质质量分数小于15%的是(填序号)。①B操作中砝码和食盐放置颠倒(该实验需用到游码)
②C操作中有少量蒸馏水洒出
③A操作中固体洒落
④用量筒量取蒸馏水时,俯视读数
15. 为了达到收旧利废节能减排的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下: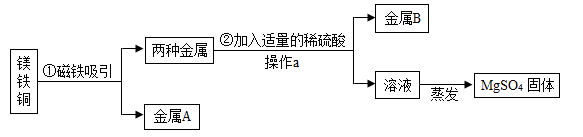
请回答:
(1)、金属A是(填化学式,下同):金属B是。(2)、操作a的名称是。(3)、写出步骤②中所涉及的化学方程式:。(4)、实验步骤②中除了加入稀硫酸外,还可选用下列试剂____(填标号)。A、硫酸铜溶液 B、氯化钠溶液 C、硝酸银溶液16. 某兴趣小组想通过实验对铁、铜、锌三种金属的活动性强弱进行探究,现提供的药品有:铁粉、铜丝、锌粒、20%稀硫酸、CuSO4溶液、ZnSO4溶液、FeSO4溶液。(1)、甲同学设计用铁粉、铜丝、锌粒分别与等质量20%稀硫酸进行实验,立刻有同学提出反对,理由。(2)、乙同学设计如下方案进行实验:实验步骤

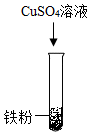
实验现象
无明显变化
。
实验结论
。
(3)、发生反应的化学方程式为。(4)、丙同学将两支试管中的物质倒在一个洁净的烧杯中,发现烧杯内的红色固体明显增多。充分反应后过滤,同学们分别对滤渣和滤液的成分展开了探究。【作出猜想】猜想一:滤渣中一定有铜,猜想二:。
(5)、【进行实验】实验步骤
实验现象
实验结论
向滤渣中加入20%稀硫酸
有气泡产生
猜想二正确
【交流讨论】
滤液中一定含有的溶质是(填化学式)。
(6)、丁同学掌握了比较金属活动性的正确方法后,他选择了另组试剂 , 进一步验证了三种金属的活动性强弱。四、计算题
-
17. 146g质量分数为10%的稀盐酸与足量的大理石完全反应,生成的二氧化碳的质量是多少克?
-