从巩固到提高 高考化学二轮微专题23 盐的水解及其应用
试卷更新日期:2023-01-23 类型:二轮复习
一、单选题
-
1. 2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法错误的是( )A、醋酸钠是强电解质 B、醋酸钠晶体与冰都是离子晶体 C、常温下,醋酸钠溶液的 D、该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出2. 下列属于水解反应的是( )A、HCOOH+H2O⇌H3O++HCOO- B、+OH-⇌H2O+ C、SO2+H2O⇌+H+ D、+H2O⇌H2CO3+OH-3. 下列说法正确的是( )A、将NaCl溶液从常温加热至80℃,溶液仍为呈中性,pH不变 B、向10mL pH=3醋酸溶液中加少量水,则的值变大 C、常温下,在等pH的盐酸和氯化铵溶液中,前者大于后者 D、常温下,在20mL 0.1醋酸钠溶液中滴加20mL 0.1 NaOH过程中,可能出现水电离出的浓度为的情况4. 下列说法错误的是( )A、任何水溶液的 B、25℃,1 ml pH=5的溶液稀释到 , 所得溶液的接近7 C、25℃时,与的电离平衡常数相等,某浓度的溶液的pH=4.3,则相同浓度的溶液的 D、25℃时,当和的物质的量之比为1∶2溶于水得到的溶液 , 则溶液中5. 常温下,用0.1000的盐酸滴定20.00mL 溶液,溶液中、、的分布分数随pH变化曲线及滴定曲线如图。下列说法正确的是( )

已知:
A、 B、的的值为 C、若将完全转变为 , 仅需用酚酞做指示剂 D、图中c点,6. 下列“类比”不合理的是( )A、丙醛能与发生加成反应,丙酮也可以与发生加成反应 B、乙烯中所有原子都在同一平面上,则2,3-二甲基-2-丁烯中所有碳也在同一平面上 C、往NaOH溶液通少量 , 生成 , 则往苯酚钠溶液中通入少量 , 也生成 D、溶液在空气中蒸干得到固体,则溶液在空气中蒸干也得到固体7. 某二元酸(H2A)在水中的电离方程式为:H2A=H++HA- , HA-H++A2- , 下列说法错误的是( )A、在0.1 mol/L的Na2A溶液中,c(A2-)+c(HA-)+2c(Na+)=0.5 mol/L B、25℃时,若测得0.1 mol/L的NaHA溶液pOH=a,升高温度,测得同浓度的NaHA溶液pOH=b,则b一定大于a C、25℃时,将同浓度的NaHA和Na2A溶液等体积混合,其pH一定小于7 D、0.1 mol/L的NaHA溶液中离子浓度为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)8. 常温下,向20mL0.1000mol·L-1NaB溶液中滴加等浓度的弱酸HA溶液,所得混合溶液中lg与1g的关系如图所示。已知Ka(HA)=1.77×10-4。下列说法正确的是( ) A、Ka(HB)>Ka(HA) B、pH=4时,的值比pH=3的大 C、滴入20mLHA溶液后存在关系:c(A-)>c(HB) D、pH=7时,混合溶液中一定存在关系:c(Na+)=c(B-)9. 氨基酸分子中含有-NH2和-COOH两种官能团,当调节溶液的pH使氨基酸所带正负电荷正好相等时,氨基酸所带的净电荷为零,在电场中不发生移动现象,此时溶液的pH叫等电点。常温下,0.001mol·L-1的甘氨酸(H2NCH2COOH)溶液中各物种浓度对数值与pH的关系如图所示,下列说法正确的是 ( )
A、Ka(HB)>Ka(HA) B、pH=4时,的值比pH=3的大 C、滴入20mLHA溶液后存在关系:c(A-)>c(HB) D、pH=7时,混合溶液中一定存在关系:c(Na+)=c(B-)9. 氨基酸分子中含有-NH2和-COOH两种官能团,当调节溶液的pH使氨基酸所带正负电荷正好相等时,氨基酸所带的净电荷为零,在电场中不发生移动现象,此时溶液的pH叫等电点。常温下,0.001mol·L-1的甘氨酸(H2NCH2COOH)溶液中各物种浓度对数值与pH的关系如图所示,下列说法正确的是 ( )已知:

 A、B点为等电点 B、pH=7时,c( H3N+CH2COO-) > c( H3N+CH2COOH) >c( H2NCH2COO- ) C、H3N+CH2COOH H3N+CH2COO- + H+平衡常数的数量级为10-10 D、C点溶液中满足:c(H+) + c( H3N+CH2COOH) =c(OH-) +c(H3N+ CH2COO- )10. 时,苯酚的 , 下列说法正确的是( )A、相同温度下,等的和溶液中, B、将浓度均为的和溶液加热,两种溶液的均变大 C、时,溶液与溶液混合,测得 , 则此时溶液中 D、时,的溶液中加少量固体,水的电离程度变小11. 某化学兴趣小组在学习完温度对盐类水解的影响后,测定了0.1mol·L-1Na2CO3溶液的pH随温度的变化,结果如下图所示。下列分析正确的是( )
A、B点为等电点 B、pH=7时,c( H3N+CH2COO-) > c( H3N+CH2COOH) >c( H2NCH2COO- ) C、H3N+CH2COOH H3N+CH2COO- + H+平衡常数的数量级为10-10 D、C点溶液中满足:c(H+) + c( H3N+CH2COOH) =c(OH-) +c(H3N+ CH2COO- )10. 时,苯酚的 , 下列说法正确的是( )A、相同温度下,等的和溶液中, B、将浓度均为的和溶液加热,两种溶液的均变大 C、时,溶液与溶液混合,测得 , 则此时溶液中 D、时,的溶液中加少量固体,水的电离程度变小11. 某化学兴趣小组在学习完温度对盐类水解的影响后,测定了0.1mol·L-1Na2CO3溶液的pH随温度的变化,结果如下图所示。下列分析正确的是( ) A、升温前溶液呈碱性的原因是:CO+2H2OH2CO3+2OH- B、常温下,0.1 mol·L-1Na2CO3溶液中:c(Na+)>2c(CO)+c(HCO) C、温度升高,Na2CO3水解程度增大,溶液pH增大,故图1实验数据一定不符合题意 D、降低温度,Na2CO3水解平衡移动和水的电离平衡移动对溶液pH的影响一致12. 根据实验目的,下列实验及现象、结论都正确的是( )
A、升温前溶液呈碱性的原因是:CO+2H2OH2CO3+2OH- B、常温下,0.1 mol·L-1Na2CO3溶液中:c(Na+)>2c(CO)+c(HCO) C、温度升高,Na2CO3水解程度增大,溶液pH增大,故图1实验数据一定不符合题意 D、降低温度,Na2CO3水解平衡移动和水的电离平衡移动对溶液pH的影响一致12. 根据实验目的,下列实验及现象、结论都正确的是( )选项
实验目的
实验及现象
结论
A
比较和的水解常数
分别测浓度均为的和溶液的 , 后者大于前者
B
检验铁锈中是否含有二价铁
将铁锈溶于浓盐酸,滴入KMnO4溶液,紫色褪去
铁绣中含有二价铁
C
探究氢离子浓度对、相互转化的影响
向溶液中缓慢滴加硫酸,黄色变为橙红色
增大氢离子浓度,转化平衡向生成的方向移动
D
检验乙醇中是否含有水
向乙醇中加入一小粒金属钠,产生无色气体
乙醇中含有水
A、A B、B C、C D、D13. 草酸亚铁晶体是生产感光材料的原料 , 制备流程如下:下列说法错误的是( )
A、可用溶液检验是否变质 B、步骤①酸化的目的是抑制的水解 C、步骤②反应为 D、步骤③为蒸发浓缩、冷却结晶、过滤、洗涤、干燥14. 水浴加热滴加酚酞的溶液,颜色及pH随温度变化如下(忽略水的挥发):实验
①
②
③
④
⑤
温度/℃
20
30
40
从40℃冷却到20℃
沸水浴后冷却到20℃
颜色变化
红色略加深
红色接近①
红色比③加深较多
pH
8.31
8.29
8.26
8.31
9.20
下列说法错误的是( )
A、溶液中: B、①→③的过程中,颜色加深的原因可能是水解程度增大 C、①→③的过程中,pH稍微下降说明升温过程中减小 D、⑤比①pH增大,推测是由于分解生成的的缘故15. 化学是一门以实验为基础的学科。下列所选试剂(或操作)和实验装置合理的是( )
选项
实验目的
选用试剂(或操作)
实验装置
A
验证Fe2+和Br-的还原性强弱
取适量FeBr2溶液,通入少量Cl2(不能与任何微粒完全反应),一段时间后,将溶液放入CCl4中摇匀、静置
甲
B
制备氢氧化亚铁
取新制FeSO4溶液,滴加NaOH溶液
乙
C
除去CO2中少量的SO2、H2O(g)
试剂a为饱和碳酸钠溶液
丙
D
制备AlCl3固体
蒸发AlCl3饱和溶液
丁
A、A B、B C、C D、D16. 常温下,用0.100 mol·L-1 NaOH(aq)滴定20.00 mL c mol·L-1二元酸H2A,滴定曲线如图所示,下列叙述正确的是( ) A、H2A电离:H2A→2H++A2- B、a点:c(HA-)>c(Na+)>c(H+)>c(A2-)>c(OH-) C、b点:c(H+)=c(A2-)+c(OH-) D、c点:c(Na+)<c(HA-)+2c(A2-)17. 类比pH,定义 , 已知琥珀酸(CH2COOH)2(以H2A表示)为二元弱酸,25℃时用HCl气体或者KOH固体调节1 L 0.1 mol/LH2A溶液的pH,混合溶液中的pH与pC(H2A、、)的关系如图所示(不考虑溶液体积和温度的变化),下列说法正确的是( )
A、H2A电离:H2A→2H++A2- B、a点:c(HA-)>c(Na+)>c(H+)>c(A2-)>c(OH-) C、b点:c(H+)=c(A2-)+c(OH-) D、c点:c(Na+)<c(HA-)+2c(A2-)17. 类比pH,定义 , 已知琥珀酸(CH2COOH)2(以H2A表示)为二元弱酸,25℃时用HCl气体或者KOH固体调节1 L 0.1 mol/LH2A溶液的pH,混合溶液中的pH与pC(H2A、、)的关系如图所示(不考虑溶液体积和温度的变化),下列说法正确的是( ) A、曲线I、II、III分别代表的粒子为、、H2A B、a、b、c三点水的电离程度大小为:b>a>c C、滴定过程中先增大再减小 D、c点溶液满足18. 下列溶液中微粒浓度关系一定正确的是( )A、氨水与氯化铵的pH=7的混合溶液中:[Cl-]=[NH] B、0.1mol·L-1的硫酸铵溶液中:[NH]>[SO]>[H+] C、0.01mol·L-1的一元酸和0.01mol·L-1的一元强碱等体积混合:[H+]=[OH-] D、0.1mol·L-1的硫化钠溶液中:[OH-]=[H+]+[HS-]+[H2S]19. 下列由实验现象所得结论正确的是( )A、取补铁口服液的上层清液,滴加酸性溶液,溶液紫色褪去,证明口服液中含有 B、向盛有的溶液的小试管中滴加酚酞溶液,溶液变红,再加入少量固体,溶液红色加深,证明水解程度增大 C、向滴有酚酞的NaOH溶液中加入 , 溶液红色褪去,可证明具有酸性 D、向溶液中通入 , 再通入X气体,有白色沉淀生成,则X可能为碱性气体20. 人体血液存在、等缓冲对。常温下,水溶液中部分缓冲对的微粒浓度之比的对数值表示或与pH的关系如图所示。已知碳酸、磷酸。则下列说法正确的是 ( )
A、曲线I、II、III分别代表的粒子为、、H2A B、a、b、c三点水的电离程度大小为:b>a>c C、滴定过程中先增大再减小 D、c点溶液满足18. 下列溶液中微粒浓度关系一定正确的是( )A、氨水与氯化铵的pH=7的混合溶液中:[Cl-]=[NH] B、0.1mol·L-1的硫酸铵溶液中:[NH]>[SO]>[H+] C、0.01mol·L-1的一元酸和0.01mol·L-1的一元强碱等体积混合:[H+]=[OH-] D、0.1mol·L-1的硫化钠溶液中:[OH-]=[H+]+[HS-]+[H2S]19. 下列由实验现象所得结论正确的是( )A、取补铁口服液的上层清液,滴加酸性溶液,溶液紫色褪去,证明口服液中含有 B、向盛有的溶液的小试管中滴加酚酞溶液,溶液变红,再加入少量固体,溶液红色加深,证明水解程度增大 C、向滴有酚酞的NaOH溶液中加入 , 溶液红色褪去,可证明具有酸性 D、向溶液中通入 , 再通入X气体,有白色沉淀生成,则X可能为碱性气体20. 人体血液存在、等缓冲对。常温下,水溶液中部分缓冲对的微粒浓度之比的对数值表示或与pH的关系如图所示。已知碳酸、磷酸。则下列说法正确的是 ( ) A、曲线Ⅰ表示与pH的变化关系 B、的过程中,水的电离程度逐渐减小 C、当时 D、当pH增大时,逐渐减小21. 常温下,Ka1(H2C2O4)=10-1.26、Ka2(H2C2O4)=10-4.27、Ksp(CaC2O4)=10-8.64 , 实验室进行多组实验测定某些酸、碱、盐性质,相关实验记录如表:
A、曲线Ⅰ表示与pH的变化关系 B、的过程中,水的电离程度逐渐减小 C、当时 D、当pH增大时,逐渐减小21. 常温下,Ka1(H2C2O4)=10-1.26、Ka2(H2C2O4)=10-4.27、Ksp(CaC2O4)=10-8.64 , 实验室进行多组实验测定某些酸、碱、盐性质,相关实验记录如表:实验
实验操作和现象
1
常温下,向4 mL 0.01 mol·L-1的KMnO4酸性溶液中加入2 mL 0.10 mol·L-1H2C2O4溶液,溶液褪色
2
常温下,测得0.10 mol·L-1NaHC2O4溶液的pH=a
3
常温下,向0.10 mol·L-1NaHC2O4溶液加入一定体积的等浓度CaCl2溶液产生白色沉淀,测得上层清液pH=4,c(Ca2+)=10-4 mol·L-1
4
常温下,向0.10 mol·L-1Na2C2O4溶液中滴加等浓度盐酸至溶液的pH=7
下列所得结论正确的是( )
A、实验1中H2C2O4溶液具有漂白性 B、实验2中a>7 C、实验3清液中c(HC2O)=10-4.37 mol·L-1 D、实验4溶液中c(Cl-)=c(H2C2O4)+c(HC2O)22. 下列说法正确的是( )A、室温下,某溶液中由水电离出的H+浓度为1×10-3mol·L-1 , 则该溶液一定显酸性 B、室温下,中和pH和体积均相等的氨水、NaOH溶液,后者所需盐酸的物质的量多 C、室温下,盐酸和氨水混合后,若溶液呈中性,则c(Cl-)>c(NH) D、相同温度下,pH相等的盐酸、醋酸溶液中,c(Cl-)=c(CH3COO-)二、综合题
-
23. 烟气脱硫脱硝技术是环境科学研究的热点。某小组模拟O3氧化结合(NH4)2SO3溶液吸收法同时脱除SO2和NO的过程示意图如下。
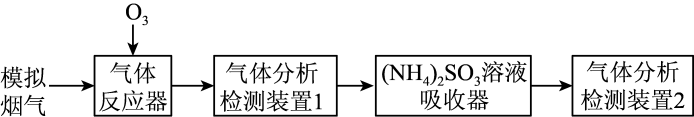 (1)、气体反应器中的主要反应原理及相关数据如下表。
(1)、气体反应器中的主要反应原理及相关数据如下表。反应
平衡常数(25℃)
活化能(kJ/mol)
a:
1.6×1057
3.17
b:
6.2×1034
3.17
c:
1.1×1041
58.17
①已知: , 则。
②其他条件不变,SO2和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内,SO2和NO的转化率随O3的浓度的变化如图。结合数据分析NO的转化率高于SO2的原因。
 (2)、其他条件不变,SO2和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,O3与NO的物质的量之比对SO2和NO脱除率的影响如图。
(2)、其他条件不变,SO2和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,O3与NO的物质的量之比对SO2和NO脱除率的影响如图。
①(NH4)2SO3溶液显碱性,用化学平衡原理解释:。
②O3的浓度很低时,SO2的脱除率超过97%,原因是。
③在吸收器中,SO与NO2反应生成和的离子方程式是。
④在吸收器中,随着吸收过程的进行,部分被转化为N2 , 反应中和N2的物质的量之比为1:1,该反应的离子方程式是。