从巩固到提高 高考化学二轮微专题22 pH及相关计算
试卷更新日期:2023-01-23 类型:二轮复习
一、单选题
-
1. 实验测得0.10mol/LNaHCO3溶液的pH随温度变化如图所示。下列说法正确的是( )
 A、OM段随温度升高溶液的pH减小,原因是水解被抑制 B、O点溶液和P点溶液的c(OH-)相等 C、将N点溶液恢复到25℃,pH=8.62 D、Q点、M点溶液均有c()+c()+c(H2CO3)=0.10mol/L2. 氯磺酸是一种易水解的一元强酸,能与甲酸、苯等有机物反应。其与甲酸发生的反应为。下列说法错误的是( )A、将物质的量相等的与HCl分别溶于水制成1L溶液,前者的pH小 B、可与苯在一定条件下发生取代反应生成苯磺酸 C、中和溶液需要 D、与甲酸反应中每生成1mol HCl,转移电子的物质的量为2mol3. 25℃时,某混合溶液中c(H2A)+c(HA-)+c(A2-)=0.01 mol·L-1 , 由水电离出的c水(H+)的对数1g c水(H+)与的关系如图所示。下列说法正确的是( )
A、OM段随温度升高溶液的pH减小,原因是水解被抑制 B、O点溶液和P点溶液的c(OH-)相等 C、将N点溶液恢复到25℃,pH=8.62 D、Q点、M点溶液均有c()+c()+c(H2CO3)=0.10mol/L2. 氯磺酸是一种易水解的一元强酸,能与甲酸、苯等有机物反应。其与甲酸发生的反应为。下列说法错误的是( )A、将物质的量相等的与HCl分别溶于水制成1L溶液,前者的pH小 B、可与苯在一定条件下发生取代反应生成苯磺酸 C、中和溶液需要 D、与甲酸反应中每生成1mol HCl,转移电子的物质的量为2mol3. 25℃时,某混合溶液中c(H2A)+c(HA-)+c(A2-)=0.01 mol·L-1 , 由水电离出的c水(H+)的对数1g c水(H+)与的关系如图所示。下列说法正确的是( ) A、曲线L1表示1g c水(H+)与的变化关系 B、Y点时存在c(H2A)=c(HA-)=c(A2-) C、X点时溶液的pH=5 D、Ka2(H2A)=10-84. 25℃时,向1L 0.01的溶液中滴加盐酸或NaOH溶液,溶液中、、的对数值()与pH的关系如图所示。下列说法错误的是( )
A、曲线L1表示1g c水(H+)与的变化关系 B、Y点时存在c(H2A)=c(HA-)=c(A2-) C、X点时溶液的pH=5 D、Ka2(H2A)=10-84. 25℃时,向1L 0.01的溶液中滴加盐酸或NaOH溶液,溶液中、、的对数值()与pH的关系如图所示。下列说法错误的是( ) A、适当升高温度﹐L点会右移 B、M点时, C、随pH增加,先增大后减小 D、N点时 , 则溶液中5. 硫酸工业尾气(主要含SO2、N2和O2),用Na2SO3溶液吸收可转化为NaHSO3 , 当c(HSO)∶c(SO)≈10时,吸收能力下降,需要加热再生为Na2SO3溶液。已知Ka1(H2SO3)=10-1.9 , Ka2(H2SO3)=10-7.2 , 下列说法错误的是( )A、Na2SO3溶液中存在:c(OH-)= c(H+) + c(HSO) +2c(H2SO3) B、Na2SO3溶液吸收SO2的离子方程式为:SO+SO2+H2O=2HSO C、当c(HSO):c(SO)=10时,此时吸收液的pH=6.2 D、与原Na2SO3溶液相比,吸收液充分分解放出SO2再生后吸收SO2能力几乎不变6. 下列实验合理的是( )A、用新制氢氧化铜悬浊液(必要时可加热)鉴别甲酸与乙酸 B、用澄清石灰水鉴别SO2与CO2 C、用淀粉-KI试纸鉴别碘水与FeCl3溶液 D、用湿润的pH试纸测定CH3COONa的pH7. 下列由实验现象所得结论正确的是( )A、用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔,在酒精灯上加热,铝箔熔化但不滴落,证明铝的熔点很高 B、用pH试纸测得 溶液的pH约为9, 溶液的pH约为8,证明 酸性大于醋酸 C、向 溶液中滴入硫酸酸化的 溶液,溶液由浅绿色变为棕黄色,证明 的氧化性强于 D、取三支试管各加入等量的己烷、苯、甲苯,再分别加入几滴等量的酸性 溶液,微热,仅盛有甲苯的试管中溶液褪色,证明苯环能使甲基更易被氧化8. 25℃时,下列说法正确的是( )A、N2H4的水溶液呈弱碱性,Kb1≈1.0×10-6 , 则0.01mol·L-1 N2H4水溶液的pH≈10 B、向NaHSO3溶液中加入少量的I2 , 则溶液中将减小 C、中和等pH的盐酸和醋酸时,醋酸消耗NaOH的物质的量更多 D、pH=7的某溶液,溶质对水的电离平衡肯定无影响9. 下列实验设计能够完成且结论合理的是( )A、可用玻璃棒蘸取氯水点在pH试纸上,待变色后和标准比色卡比较测出氯水的pH B、向饱和溶液中滴加AgCl悬独液,产生黑色沉淀,证明AgCl的溶解度大于 C、将50mL稀NaOH溶液缓慢倒入盛有等量盐酸的烧杯中,记录温度可测定中和热 D、将浓NaOH溶液和少量溴苯混合后振荡,仍有无色油状液体,证明常温下溴苯不易水解10. 下列说法错误的是( )A、相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH-)相等 B、常温下,将1 L0.1 mol/L的Ba(OH)2溶液稀释为2 L,pH=13 C、常温下,测定0.1mol/L醋酸溶液的pH可证明醋酸是弱电解质 D、相同温度下,中和相同pH、相同体积的盐酸和醋酸溶液,消耗NaOH物质的量不同11. 298K下,向20.00mL0.1mol·L-1的某弱酸(HR)溶液中逐滴加入pH=13的NaOH溶液,溶液申由水电离的H+浓度的负对数[-lgc(H+)水]与所加入NaOH溶液体积的关系如图所示(b点溶液pH<7)。下列说法正确的是( )
A、适当升高温度﹐L点会右移 B、M点时, C、随pH增加,先增大后减小 D、N点时 , 则溶液中5. 硫酸工业尾气(主要含SO2、N2和O2),用Na2SO3溶液吸收可转化为NaHSO3 , 当c(HSO)∶c(SO)≈10时,吸收能力下降,需要加热再生为Na2SO3溶液。已知Ka1(H2SO3)=10-1.9 , Ka2(H2SO3)=10-7.2 , 下列说法错误的是( )A、Na2SO3溶液中存在:c(OH-)= c(H+) + c(HSO) +2c(H2SO3) B、Na2SO3溶液吸收SO2的离子方程式为:SO+SO2+H2O=2HSO C、当c(HSO):c(SO)=10时,此时吸收液的pH=6.2 D、与原Na2SO3溶液相比,吸收液充分分解放出SO2再生后吸收SO2能力几乎不变6. 下列实验合理的是( )A、用新制氢氧化铜悬浊液(必要时可加热)鉴别甲酸与乙酸 B、用澄清石灰水鉴别SO2与CO2 C、用淀粉-KI试纸鉴别碘水与FeCl3溶液 D、用湿润的pH试纸测定CH3COONa的pH7. 下列由实验现象所得结论正确的是( )A、用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔,在酒精灯上加热,铝箔熔化但不滴落,证明铝的熔点很高 B、用pH试纸测得 溶液的pH约为9, 溶液的pH约为8,证明 酸性大于醋酸 C、向 溶液中滴入硫酸酸化的 溶液,溶液由浅绿色变为棕黄色,证明 的氧化性强于 D、取三支试管各加入等量的己烷、苯、甲苯,再分别加入几滴等量的酸性 溶液,微热,仅盛有甲苯的试管中溶液褪色,证明苯环能使甲基更易被氧化8. 25℃时,下列说法正确的是( )A、N2H4的水溶液呈弱碱性,Kb1≈1.0×10-6 , 则0.01mol·L-1 N2H4水溶液的pH≈10 B、向NaHSO3溶液中加入少量的I2 , 则溶液中将减小 C、中和等pH的盐酸和醋酸时,醋酸消耗NaOH的物质的量更多 D、pH=7的某溶液,溶质对水的电离平衡肯定无影响9. 下列实验设计能够完成且结论合理的是( )A、可用玻璃棒蘸取氯水点在pH试纸上,待变色后和标准比色卡比较测出氯水的pH B、向饱和溶液中滴加AgCl悬独液,产生黑色沉淀,证明AgCl的溶解度大于 C、将50mL稀NaOH溶液缓慢倒入盛有等量盐酸的烧杯中,记录温度可测定中和热 D、将浓NaOH溶液和少量溴苯混合后振荡,仍有无色油状液体,证明常温下溴苯不易水解10. 下列说法错误的是( )A、相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH-)相等 B、常温下,将1 L0.1 mol/L的Ba(OH)2溶液稀释为2 L,pH=13 C、常温下,测定0.1mol/L醋酸溶液的pH可证明醋酸是弱电解质 D、相同温度下,中和相同pH、相同体积的盐酸和醋酸溶液,消耗NaOH物质的量不同11. 298K下,向20.00mL0.1mol·L-1的某弱酸(HR)溶液中逐滴加入pH=13的NaOH溶液,溶液申由水电离的H+浓度的负对数[-lgc(H+)水]与所加入NaOH溶液体积的关系如图所示(b点溶液pH<7)。下列说法正确的是( ) A、在a、b、c、d四点中,d点水的电离程度最大 B、b点溶液中:c(HR)>c(R-)>c(Na+) C、c点溶液pH=7 D、d点溶液中:c(Na+)=2c(HR)+2c(R-)12. 设N A 为阿伏加德罗常数的值,下列有关叙述正确的是( )A、室温下pH =12的Na2CO3溶液中,由水电离出的OH-数目为0.01NA B、1.0 L1.0 mol/L的NaAlO2 溶液中含氧原子数为2NA C、0.2 mol SO 2与0.2 mol O2 在一定条件下充分反应生成SO3 分子数为0.2NA D、3.9gNa2O2 固体中含有阴阳离子的总数目为0.15NA13. 用0.1000mol/L的NaOH溶液分别滴定体积均为10.00mL、浓度均为0.1000mol/L的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率(电导率越大表示溶液导电性越强)变化如图所示.下列说法正确的是( )
A、在a、b、c、d四点中,d点水的电离程度最大 B、b点溶液中:c(HR)>c(R-)>c(Na+) C、c点溶液pH=7 D、d点溶液中:c(Na+)=2c(HR)+2c(R-)12. 设N A 为阿伏加德罗常数的值,下列有关叙述正确的是( )A、室温下pH =12的Na2CO3溶液中,由水电离出的OH-数目为0.01NA B、1.0 L1.0 mol/L的NaAlO2 溶液中含氧原子数为2NA C、0.2 mol SO 2与0.2 mol O2 在一定条件下充分反应生成SO3 分子数为0.2NA D、3.9gNa2O2 固体中含有阴阳离子的总数目为0.15NA13. 用0.1000mol/L的NaOH溶液分别滴定体积均为10.00mL、浓度均为0.1000mol/L的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率(电导率越大表示溶液导电性越强)变化如图所示.下列说法正确的是( ) A、曲线①代表向盐酸中滴加 B、A点溶液的小于C点溶液的 C、D点溶液中: D、随着溶液的加入,曲线①逐渐向②靠拢,说明电解质溶液的电导率只与离子浓度大小相关14. 室温下,某混合溶液中c(HAc)+c(Ac-)=0.01mol/L,部分微粒浓度的对数与pH的关系如图所示[已知Ka(HAc)=1.0×10-4.74 , 1g2=0.3,微粒加方括号表示该微粒的浓度]。下列说法不正确的是( )
A、曲线①代表向盐酸中滴加 B、A点溶液的小于C点溶液的 C、D点溶液中: D、随着溶液的加入,曲线①逐渐向②靠拢,说明电解质溶液的电导率只与离子浓度大小相关14. 室温下,某混合溶液中c(HAc)+c(Ac-)=0.01mol/L,部分微粒浓度的对数与pH的关系如图所示[已知Ka(HAc)=1.0×10-4.74 , 1g2=0.3,微粒加方括号表示该微粒的浓度]。下列说法不正确的是( ) A、P点对应溶液中微粒浓度关系:c(Ac-)>c(HAc)=c(OH-)>c(H+) B、M点对应的lg[c(HAc)]=-9.48 C、O点的坐标为(4.74,-2.3) D、[OH—]对应的直线和[H+]对应的直线的斜率分别为+1和-1,两者交点的横坐标为715. 在H2C2O4溶液中加入NaOH溶液,不断调整溶液pH,测绘H2C2O4、HC2O和C2O物质的量分数与pH关系图如图所示,[已知δ(X)=]。下列说法不正确的是( )
A、P点对应溶液中微粒浓度关系:c(Ac-)>c(HAc)=c(OH-)>c(H+) B、M点对应的lg[c(HAc)]=-9.48 C、O点的坐标为(4.74,-2.3) D、[OH—]对应的直线和[H+]对应的直线的斜率分别为+1和-1,两者交点的横坐标为715. 在H2C2O4溶液中加入NaOH溶液,不断调整溶液pH,测绘H2C2O4、HC2O和C2O物质的量分数与pH关系图如图所示,[已知δ(X)=]。下列说法不正确的是( ) A、D点c(C2O)=c(H2C2O4),pH=2.7 B、A点与B点纵坐标相同,δ(X)均为50% C、向草酸溶液中滴加氢氧化钠溶液至pH为4.2时:c(Na+)+c(H+)=3c(C2O)+c(OH-) D、0.1mol·L-1NaHC2O4(aq)中:c(HC2O)>c(C2O)>(H2C2O4)16. 已知25℃时二元酸H2A的Ka1=1.3×10-7 , Ka2=7.1×10-15。下列说法正确的是( )A、在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者 B、向0.1mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013% C、向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-) D、取pH=a的H2A溶液10mL,加蒸馏水稀释至100mL,则该溶液pH=a+117. 某同学拟用 计测定溶液 以探究某酸HR是否为弱电解质。下列说法正确的是( )A、25℃时,若测得 溶液 ,则HR是弱酸 B、25℃时,若测得 溶液 且 ,则HR是弱酸 C、25℃时,若测得HR溶液 ,取该溶液 ,加蒸馏水稀释至 ,测得 ,则HR是弱酸 D、25℃时,若测得NaR溶液 ,取该溶液 ,升温至50℃,测得 , ,则HR是弱酸18. 为达到下列实验目的,对应的实验方法以及相关解释均正确的是( )
A、D点c(C2O)=c(H2C2O4),pH=2.7 B、A点与B点纵坐标相同,δ(X)均为50% C、向草酸溶液中滴加氢氧化钠溶液至pH为4.2时:c(Na+)+c(H+)=3c(C2O)+c(OH-) D、0.1mol·L-1NaHC2O4(aq)中:c(HC2O)>c(C2O)>(H2C2O4)16. 已知25℃时二元酸H2A的Ka1=1.3×10-7 , Ka2=7.1×10-15。下列说法正确的是( )A、在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者 B、向0.1mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013% C、向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-) D、取pH=a的H2A溶液10mL,加蒸馏水稀释至100mL,则该溶液pH=a+117. 某同学拟用 计测定溶液 以探究某酸HR是否为弱电解质。下列说法正确的是( )A、25℃时,若测得 溶液 ,则HR是弱酸 B、25℃时,若测得 溶液 且 ,则HR是弱酸 C、25℃时,若测得HR溶液 ,取该溶液 ,加蒸馏水稀释至 ,测得 ,则HR是弱酸 D、25℃时,若测得NaR溶液 ,取该溶液 ,升温至50℃,测得 , ,则HR是弱酸18. 为达到下列实验目的,对应的实验方法以及相关解释均正确的是( )选项
实验目的
实验方法
相关解释
A
测量氯水的pH

pH试纸遇酸变红
B
测量锌粒和3mol/L硫酸反应生成 的体积

会与锌粒反应生成 ,使用恒压分液漏斗可以减小误差
C
探究正戊烷 催化裂解

裂解为分子较小的烷烃和烯烃,可以冷凝收集
D
用 溶液制备 晶体

沸点高于溶剂水
A、A B、B C、C D、D19. 下列说法错误的是( )A、升高HCl稀溶液温度,溶液中c(H+)不变 B、常温,向醋酸钠溶液中滴加少量醋酸使其pH=7,则混合液中:c(Na+)=c(CH3COO-) C、向AgCl、AgBr的饱和溶液中加入少量AgNO3固体,溶液中氯离子浓度和溴离子浓度比不变 D、25℃时,将0.1mol·L-1的NaOH溶液加水稀释100倍,所得溶液的pH=11.020. 下列说法正确的是( )A、体系的内能与温度等有关,只要温度不变,体系的内能不变 B、反应 能自发进行,它的 , C、室温下,pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合后,所得溶液的pH大于7 D、水与丙酮能完全互溶的原因是两种分子间能形成氢键二、多选题
-
21. 常温时,某浓度的二元弱酸溶液在不同pH下测得pc(M)变化如图所示[已知: , M代指或或],下列说法正确的是( )
 A、NaHB溶液中, B、X点的pH为4.06 C、时, D、的值为22. 化学上把由浓度相对较大的弱酸(弱碱)及其相应的盐组成的溶液,外加少量酸、碱而pH基本不变,称为缓冲溶液。弱酸及其盐组成的缓冲溶液的 。现有25℃时,浓度均为0.10mol·L-1的CH3COOH和CH3COONa的缓冲溶液 。下列有关说法正确的是( )A、将该缓冲溶液加水稀释100倍,溶液的pH基本不变 B、该缓冲溶液的pH=4.76 C、该缓冲溶液中离子浓度大小顺序是: D、人体血液存在H2CO3(CO2)和NaHCO3的缓冲溶液,可除掉人体代谢产生的酸、碱,保持pH基本不变23. 常温下,向 某一元碱 溶液中逐滴加入 的 溶液,溶液中 中和率的变化如图所示。 为 的电离常数, 下列说法正确的是( )
A、NaHB溶液中, B、X点的pH为4.06 C、时, D、的值为22. 化学上把由浓度相对较大的弱酸(弱碱)及其相应的盐组成的溶液,外加少量酸、碱而pH基本不变,称为缓冲溶液。弱酸及其盐组成的缓冲溶液的 。现有25℃时,浓度均为0.10mol·L-1的CH3COOH和CH3COONa的缓冲溶液 。下列有关说法正确的是( )A、将该缓冲溶液加水稀释100倍,溶液的pH基本不变 B、该缓冲溶液的pH=4.76 C、该缓冲溶液中离子浓度大小顺序是: D、人体血液存在H2CO3(CO2)和NaHCO3的缓冲溶液,可除掉人体代谢产生的酸、碱,保持pH基本不变23. 常温下,向 某一元碱 溶液中逐滴加入 的 溶液,溶液中 中和率的变化如图所示。 为 的电离常数, 下列说法正确的是( )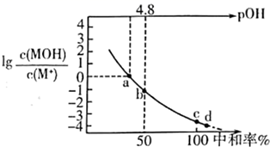 A、溶液中水的电离程度从a点到d点逐渐增大 B、a点时, C、b点时, D、c点时,
A、溶液中水的电离程度从a点到d点逐渐增大 B、a点时, C、b点时, D、c点时,三、综合题
-
24. 碲被誉为现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁。工业上从某电镀污泥(含有、以及少量的Au)中提取粗碲,同时获得副产品重铬酸钾、金属铜和金的工艺流程如图所示。

已知:①沉淀时与pH的关系
pH
开始沉淀
3.68
沉淀完全
5
②溶解度
溶解度
NaCl
100℃
95.1g
39.8g
25℃
4.6g
36g
回答下列问题:
(1)、“煅烧”时气体与固体原料逆流而行,目的是;“煅烧”时发生反应的化学方程式为。(2)、金在(填操作单元名称)过程中回收。已知浸出液中含有 , 每得到128g碲,理论上消耗溶液的体积为L。(3)、根据相关物质溶解度特点分析“操作a”的步骤:向溶液中加入KCl固体,(填操作名称,下同),使NaCl结晶析出后 , 再得到晶体。(4)、铬(VI)毒性很高,工业上常用铁和石墨作电极,处理含的酸性废水。通电后先转变为 , 一段时间后变成沉淀而被除去。其中铁电极的作用是电子导体和 , 当电解后溶液中浓度为时,其开始沉降时废水的pH为。25. 常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液时,当氢氧化钠溶液的体积从19.98mL变为20.02mL时,溶液的pH发生突变,请回答下列问题:(已知lg2=0.3,lg5=0.7)(1)、pH突跃范围是:;(2)、请写出上述结果的计算过程:。26. 纳米氧化锌是一种新型无机功能材料。以氧化锌烟灰(含ZnO及少量Fe2O3、FeO、MnO、CuO)为原料制备纳米氧化锌的工艺流程如图:
如表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol·L-1计算)。
金属离子
Fe3+
Fe2+
Cu2+
Zn2+
Mn2+
开始沉淀的pH
1.5
6.3
6.0
6.2
8.1
完全沉淀的pH
2.8
8.3
8.0
8.2
10.1
(1)、Cu2+基态核外电子排布式为。(2)、“浸取”过程中盐酸不宜过量太多,其可能原因是。(3)、“滤渣1”的成分是MnO2、Fe(OH)3。“氧化除杂”过程中KMnO4与Mn2+发生反应的离子方程式为 , 溶液pH范围应控制在。(4)、①“沉锌”得到碱式碳酸锌[化学式为2ZnCO3·3Zn(OH)2·2H2O],该反应的离子方程式为。②碱式碳酸锌加热升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体中含有(填化学式)。
 27. Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3 , 还含有少量Fe3O4、FeO、CoO、Al2O3)为原料制备Mn2O3的工艺流程如图。已知:
27. Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3 , 还含有少量Fe3O4、FeO、CoO、Al2O3)为原料制备Mn2O3的工艺流程如图。已知:
①25℃时相关物质的Ksp见下表。
物质
Fe(OH)2
Fe(OH)3
Al(OH)3
Mn(OH)2
Co(OH)2
Ksp
1×10-16.3
1×10-38.6
1×10-32.3
1×10-12.7
1.09×10-15
②氢氧化氧锰(MnOOH)难溶于水和碱性溶液;“沉淀池I”的条件下,Co2+不能被二氧化锰氧化。
(1)、Mn元素位于元素周期表第周期第族。(2)、向“沉淀池I”中加入MnO2 , MnO2的作用是;“滤渣2”的主要成分是(填化学式)。(3)、MnSO4转化为MnOOH的离子方程式为。(4)、MnSO4转化为MnOOH中“III.实验操作”包含过滤、洗涤、干燥。检验MnOOH是否洗涤干净,具体操作为。(5)、高纯度的MnOOH转化为Mn2O3的化学方程式为。(6)、在“沉淀池I”中,滴加氨水调节溶液的pH,使溶液中铝、铁元素完全沉淀,则理论上pH的最小值为(当溶液中某离子浓度c≤1.0×10-5mol·L-1时,可认为该离子沉淀完全)。28. 一种银铟矿主要成分为Au、Ag2S、CuS、ZnS、PbS、FeS、In2O3、Ga2O3等物质,从该矿获得稀有金属的工艺流程如图所示:
该工艺条件下,金属离子开始沉淀和完全沉淀的pH如表:
金属离子
Fe3+
In3+
Ga3+
Cu2+
Zn2+
Pb2+
开始沉淀的pH
2.2
2.1
2.6
4.6
6.24
7.1
完全沉淀(c=1.0×10-5mol·L-1)的pH
3.2
3.4
4.3
6.6
8.24
9.1
(1)、“浸出”过程中金、银分别转化为AuCl、AgCl进入溶液,同时生成硫,写出Ag2S发生反应的离子方程式。(2)、高温水蒸气除铁利用了FeCl3易水解的性质,写出该反应的化学方程式。(3)、“二次还原”得到的滤液中主要的阳离子有H+、Na+、Ca2+、Zn2+、Pb3+、In3+、。(4)、“二次中和”得到的滤渣除少量Fe(OH)3外,主要成分还有(写化学式)。(5)、“分铅锌”步骤中,维持H2S饱和水溶液的浓度为0.1mol·L-1 , 为使Zn2+沉淀完全,需控制溶液的pH不小于已知:lg3≈0.48;Ksp(ZnS)=3.0×10-25 , Ka1(H2S)=1.0×10-7 , Ka2(H2S)=1.0×10-13]。(6)、已知:氧化还原反应可看成由两个半反应组成,每个半反应具有一定的电极电势(用“φ”表示),φ越大则该物质的氧化性越强,φ越低则该物质的还原性越强。浸出步骤中金反应的两个半反应如下:HClO+H++2e-=Cl-+H2O φ=1.49+lg
AuCl4-+3e-=4Cl-+Au φ=0.994+lg
(φ与半反应式的系数无关,仅与浓度有关,cθ=1mol·L-1)
如图是Au的浸出率与NaCl溶液浓度的关系,请解释A点以后,金浸出率减小的原因是。
 29. 在剧烈运动中,因缺氧肌肉会产生乳酸(),而血液中,乳酸和碳酸氢盐发生中和反应。试通过如下计算来说明此过程。
29. 在剧烈运动中,因缺氧肌肉会产生乳酸(),而血液中,乳酸和碳酸氢盐发生中和反应。试通过如下计算来说明此过程。已知乳酸()是一元酸,。碳酸的电离平衡常数为: ,
(1)、的为。( , )(2)、计算乳酸和碳酸氢盐反应的反应平衡常数的数值,写出计算过程。30. 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和Na+内循环。工艺流程如图: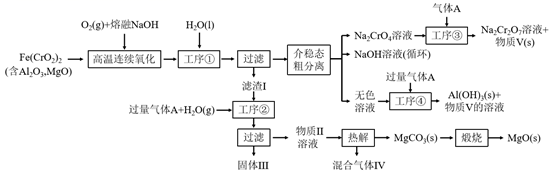
回答下列问题:
(1)、高温连续氧化工序中被氧化的元素是(填元素符号)。(2)、工序①的名称为 。(3)、滤渣的主要成分是 (填化学式)。(4)、工序③中发生反应的离子方程式为。(5)、物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为 , 可代替NaOH的化学试剂还有(填化学式)。(6)、热解工序产生的混合气体最适宜返回工序(填“①”或“②”或“③”或“④”)参与内循环。(7)、工序④溶液中的铝元素恰好完全转化为沉淀的pH为。(通常认为溶液中离子浓度小于10-5mol•L-1为沉淀完全;Al(OH)3+OH- Al(OH) :K=100.63 , Kw=10-14 , Ksp[Al(OH)3]=10-33)31. 磁选后的炼铁高钛炉渣,主要成分有 、 、 、MgO、CaO以及少量的 ,为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表:
金属离子
开始沉淀的pH
2.2
3.5
9.5
12.4
沉淀完全(c=1.0×10*mol-L')的pH
3.2
4.7
11.1
13.8
回答下列问题:
(1)、“焙烧”中, 、 几乎不发生反应, 、MgO、CaO、 转化为相应的硫酸盐,写出 转化为 的化学方程式。(2)、“水浸”后“滤液”的pH约为2.0,在“分步沉淀”氨水逐步调节pH至11.6,依次析出的金属离子是。(3)、“母液①”中 浓度为mol·(4)、”水浸渣”在160℃“酸溶”,最适合的酸是。“酸溶渣”的成分是、。(5)、“酸溶”后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是。(6)、将“母液①”和“母液②”混合,吸收尾气,经处理得 , 循环利用。32. Co3O4在工业上有重要应用。利用原钴矿(主要含有Co2O3 , 还含有少量Cr2O3、NiO等杂质)制备Co3O4的工艺流程如下: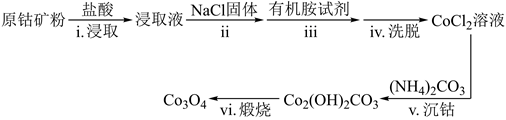
已知:①在含一定量Cl-的溶液中:Co2++4Cl-=CoCl
②CoCl 溶于有机胺试剂,Co2+、Cr3+和Ni2+不溶于有机胺试剂;有机胺试剂不溶于水。
③Ksp[Co(OH)2]=1.0×10-15
(1)、原钴矿需预先粉碎的目的是。(2)、步骤i中Co2O3溶解时发生反应的离子方程式为。(3)、步骤ii中加入NaCl固体的目的是。(4)、步骤v反应过程中无气体逸出,则沉钴时发生反应的离子方程式为;沉钴过程选择较高温度有利于沉淀生成,但加入等量(NH4)2CO3选择过高温度得到的沉淀质量反而会减少,减少的原因是。(5)、常温下,步骤v沉钴滤液中,Co2+含量为5.9×10-2g·L-1 , 此时溶液的pH=。(6)、步骤vi在空气中煅烧生成Co3O4的化学方程式是。33. 氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂等。一种用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:
已知:①BiOCl难溶于水;
②“浸铋”所得浸取液中含BiCl3、AsCl3等物质。
回答下列问题:
(1)、“浸铜”时有单质硫生成,发生反应的离子方程式为。(2)、“沉铋”时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为。“沉铋”所得滤液可导入到中使用(填流程中操作单元名称)。(3)、工业生产中还可采用铁盐氧化法除砷。向“浸铋”所得浸取液中加入 ,和H2O2 , 并调节pH,生成FeAsO4沉淀,发生反应的离子方程式是。欲使溶液中 且不产生 ,沉淀,应控制pH的范围为。(已知: ; 、 的Ksp分别 , ,计算结果保留2位小数)(4)、氯氧化铋(BiOCl)可用作钾离子电池(有机物作离子导体)的负极材料,充电时嵌入K+ , BiOCl被还原为Bi,电极反应式是。研究发现,充电过程中,除上述反应外,还包括 ,该反应的发生使得电池的储能(填“增大”“减小”或“不变”)。