从巩固到提高 高考化学二轮微专题17 催化剂
试卷更新日期:2023-01-23 类型:二轮复习
一、单选题
-
1. 光催化三氟甲基环丙烷甲酸与卤代芳烃反应,可能涉及能量转移驱动的催化循环机理如图(*表示激发态,t-Bu 代表一种烃基),下列说法不正确的是( )
 A、反应过程中发生了取代反应 B、反应过程中A是中间产物 C、物质A中存在配位键 D、总反应为:
A、反应过程中发生了取代反应 B、反应过程中A是中间产物 C、物质A中存在配位键 D、总反应为: 2. 钴(Co)使某析氧反应催化剂中流失Fe的自修复机理如图。下列说法错误的是( )
2. 钴(Co)使某析氧反应催化剂中流失Fe的自修复机理如图。下列说法错误的是( ) A、是自修复反应中的中间体 B、维持相对稳定的有助于催化析氧和自修复的进行 C、自修复反应的方程式为 D、图中所示物质之间的转化中有3种元素化合价发生变化3. 已知: , 选择500℃左右是因为催化剂(铁触媒)在此温度下活性最佳。最近我国研制出一种新型合成氨催化剂,其最佳活化温度为350℃左右。则使用该新型催化剂合成氨时,下列说法错误的是( )A、可提高反应物的平衡转化率 B、可改变合成氨反应的焓变 C、可减少合成氨的能耗 D、可降低合成氨的反应温度4. 关于反应4HCl(g)+O2(g)=2Cl2(g)+2H2O(g);ΔH=-116 kJ·mol-1 , 下列说法正确的是( )A、反应活化能:Ea(正)<Ea(逆) B、每生成22.4 L Cl2 , 放出58 kJ的热量 C、使用高效催化剂,可使平衡时的值增大 D、断裂4 mol H-Cl键的同时,有4 mol H-O键生成,说明该反应达到平衡状态5. 在溶液中用光照射Cu-PHI催化剂产生光电子和空穴h+ , 以水作弱氧化剂,可以在常温常压下使甲烷转化为甲醇和氢气,其部分反应机理如图所示,下列说法错误的是( )
A、是自修复反应中的中间体 B、维持相对稳定的有助于催化析氧和自修复的进行 C、自修复反应的方程式为 D、图中所示物质之间的转化中有3种元素化合价发生变化3. 已知: , 选择500℃左右是因为催化剂(铁触媒)在此温度下活性最佳。最近我国研制出一种新型合成氨催化剂,其最佳活化温度为350℃左右。则使用该新型催化剂合成氨时,下列说法错误的是( )A、可提高反应物的平衡转化率 B、可改变合成氨反应的焓变 C、可减少合成氨的能耗 D、可降低合成氨的反应温度4. 关于反应4HCl(g)+O2(g)=2Cl2(g)+2H2O(g);ΔH=-116 kJ·mol-1 , 下列说法正确的是( )A、反应活化能:Ea(正)<Ea(逆) B、每生成22.4 L Cl2 , 放出58 kJ的热量 C、使用高效催化剂,可使平衡时的值增大 D、断裂4 mol H-Cl键的同时,有4 mol H-O键生成,说明该反应达到平衡状态5. 在溶液中用光照射Cu-PHI催化剂产生光电子和空穴h+ , 以水作弱氧化剂,可以在常温常压下使甲烷转化为甲醇和氢气,其部分反应机理如图所示,下列说法错误的是( ) A、催化剂表面水转化为过氧化氢发生反应为2H2O+2h+=H2O2+2H+ B、增加少量H2O2可加快制备甲醇的速率 C、图中碳元素的化合价有两种 D、该反应的化学方程式为CH4+H2OCH3OH+H26. CH4超干重整CO2技术可得到富含CO的气体,该技术中的化学反应为:CH4(g)+3CO2(g)2H2O(g)+4CO(g) △H>0。图1表示初始投料比n(CH4):n(CO2)为1∶3或1∶4时,CH4的转化率与温度、压强的关系(投料比用a1、a2表示)。图2表示该反应的催化转化原理。下列说法正确的是( )
A、催化剂表面水转化为过氧化氢发生反应为2H2O+2h+=H2O2+2H+ B、增加少量H2O2可加快制备甲醇的速率 C、图中碳元素的化合价有两种 D、该反应的化学方程式为CH4+H2OCH3OH+H26. CH4超干重整CO2技术可得到富含CO的气体,该技术中的化学反应为:CH4(g)+3CO2(g)2H2O(g)+4CO(g) △H>0。图1表示初始投料比n(CH4):n(CO2)为1∶3或1∶4时,CH4的转化率与温度、压强的关系(投料比用a1、a2表示)。图2表示该反应的催化转化原理。下列说法正确的是( )
 A、其他条件不变,按照a2投料,产物CO的百分含量最高 B、a1=1:3,T2>T1 C、过程II的催化剂为CaO和Fe D、过程I和过程II中均只发生氧化还原反应7. 我国科学家研究了不同含金化合物催化乙烯加氢的反应历程如图所示,下列说法正确的是( )
A、其他条件不变,按照a2投料,产物CO的百分含量最高 B、a1=1:3,T2>T1 C、过程II的催化剂为CaO和Fe D、过程I和过程II中均只发生氧化还原反应7. 我国科学家研究了不同含金化合物催化乙烯加氢的反应历程如图所示,下列说法正确的是( ) A、过渡态1比过渡态2更稳定 B、若该反应生成液态 , 则反应的增大 C、催化剂AuF的催化效果比的好 D、该反应的热化学方程式为:8. H2和O2在钯的配合物离子[PdCl4]-的作用下合成H2O2 , 反应历程如图,下列说法不正确的是( )
A、过渡态1比过渡态2更稳定 B、若该反应生成液态 , 则反应的增大 C、催化剂AuF的催化效果比的好 D、该反应的热化学方程式为:8. H2和O2在钯的配合物离子[PdCl4]-的作用下合成H2O2 , 反应历程如图,下列说法不正确的是( ) A、[PdCl4]-在此过程中作为催化剂 B、该过程的总反应为H2+O2=H2O2 C、生成1molH2O2的过程中转移电子总数为4mol D、历程中发生了Pd+O2+2Cl-=[PdCl2O2]2-9. 羰基硫(COS)催化水解的反应为:COS(g)+H2O(g)CO2(g)+H2S(g) △H<0,在相同投料比、相同气流速度、相同时间内,测得不同温度及不同催化剂下COS水解反应的转化率如图所示,下列说法正确的是( )
A、[PdCl4]-在此过程中作为催化剂 B、该过程的总反应为H2+O2=H2O2 C、生成1molH2O2的过程中转移电子总数为4mol D、历程中发生了Pd+O2+2Cl-=[PdCl2O2]2-9. 羰基硫(COS)催化水解的反应为:COS(g)+H2O(g)CO2(g)+H2S(g) △H<0,在相同投料比、相同气流速度、相同时间内,测得不同温度及不同催化剂下COS水解反应的转化率如图所示,下列说法正确的是( ) A、该反应M点未达到平衡状态,N点已达到平衡状态 B、正反应的平均反应速率:P>N>M C、任何温度下,γ-Al2O3的催化效果都比TiO2好 D、150℃,用γ-Al2O3做催化剂达到平衡时CO2的体积分数最大10. 以钒化合物作催化剂制备高纯度次氯酸的机理如图,已知钒元素V最高化合价为+5价,N(His404)、 N(His496)为氨基酸,下列说法错误的是( )
A、该反应M点未达到平衡状态,N点已达到平衡状态 B、正反应的平均反应速率:P>N>M C、任何温度下,γ-Al2O3的催化效果都比TiO2好 D、150℃,用γ-Al2O3做催化剂达到平衡时CO2的体积分数最大10. 以钒化合物作催化剂制备高纯度次氯酸的机理如图,已知钒元素V最高化合价为+5价,N(His404)、 N(His496)为氨基酸,下列说法错误的是( ) A、反应①④中,都形成配位键,都有氢氧键的断裂和形成 B、反应过程中,钒化合物甲是催化剂,乙、丙、丁、戊是中间产物 C、在该催化循环过程中,中心原子V的化合价和VSEPR模型发生了改变 D、此图钒化合物的每一次循环使无机物发生的净反应:H2O2+Cl-+H+=HOCl+H2O11. 催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图1所示;有氧条件下,催化还原NO的反应历程如图2所示。下列说法正确的是( )
A、反应①④中,都形成配位键,都有氢氧键的断裂和形成 B、反应过程中,钒化合物甲是催化剂,乙、丙、丁、戊是中间产物 C、在该催化循环过程中,中心原子V的化合价和VSEPR模型发生了改变 D、此图钒化合物的每一次循环使无机物发生的净反应:H2O2+Cl-+H+=HOCl+H2O11. 催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图1所示;有氧条件下,催化还原NO的反应历程如图2所示。下列说法正确的是( ) A、图1所示热化学方程式为 B、图2所示催化脱硝过程中既有极性共价键的断裂和形成,也有非极性共价键的断裂和形成 C、图2所示反应①中氧化剂与还原剂物质的量之比为2:1 D、脱硝过程中使用催化剂的目的是改变反应的焓变12. 自由基是化学键断裂时产生的含未成对电子的中间体,活泼自由基与氧气的反应一直是科研人员的关注点。HNO自由基与O2反应过程的能量变化如图所示,下列说法正确的是( )
A、图1所示热化学方程式为 B、图2所示催化脱硝过程中既有极性共价键的断裂和形成,也有非极性共价键的断裂和形成 C、图2所示反应①中氧化剂与还原剂物质的量之比为2:1 D、脱硝过程中使用催化剂的目的是改变反应的焓变12. 自由基是化学键断裂时产生的含未成对电子的中间体,活泼自由基与氧气的反应一直是科研人员的关注点。HNO自由基与O2反应过程的能量变化如图所示,下列说法正确的是( ) A、反应物的键能总和大于生成物的键能总和 B、该历程中最大正反应的活化能E正=186.19 kJ∙mol-1 C、两种产物中P2更稳定,相同条件下Z转化为产物的速率:v(P1)<v(P2) D、使用催化剂能提高产物P2的平衡产率13. 在相同条件下研究催化剂I、II对反应的影响,各物质浓度c随反应时间t的部分变化曲线如图,下列说法错误的是( )
A、反应物的键能总和大于生成物的键能总和 B、该历程中最大正反应的活化能E正=186.19 kJ∙mol-1 C、两种产物中P2更稳定,相同条件下Z转化为产物的速率:v(P1)<v(P2) D、使用催化剂能提高产物P2的平衡产率13. 在相同条件下研究催化剂I、II对反应的影响,各物质浓度c随反应时间t的部分变化曲线如图,下列说法错误的是( ) A、无催化剂时,反应也能进行 B、与催化剂II相比,I使反应活化能更低 C、a曲线表示使用催化剂II时X的浓度随t的变化 D、使用催化剂I时,内,14. 在一定的温度和压强下,将按一定比例混合的和通过装有催化剂的反应器可得到甲烷。已知:
A、无催化剂时,反应也能进行 B、与催化剂II相比,I使反应活化能更低 C、a曲线表示使用催化剂II时X的浓度随t的变化 D、使用催化剂I时,内,14. 在一定的温度和压强下,将按一定比例混合的和通过装有催化剂的反应器可得到甲烷。已知:催化剂的选择是甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测得温度对转化率和生成选择性的影响如图所示。

选择性=×100%
下列有关说法正确的是( )
A、在260℃~320℃间,以为催化剂,升高温度的产率增大 B、延长W点的反应时间,一定能提高的转化率 C、选择合适的催化剂,有利于提高的平衡转化率 D、高于320℃后,以Ni为催化剂,随温度的升高转化率上升的原因是平衡正向移动15. 化学与人类生活、科技、社会密切相关。下列新闻事件的化学解读科学无误的是( )选项
新闻事件
化学解读
A
中科院制备出铜基纳米催化剂,该催化剂可高效电催化二氧化碳还原反应
高效催化剂能提高电解效率、提高目标产物的选择性
B
四川甘孜全球最大水光互补电站开工建设
建设过程需要大量光电转换材料——二氧化硅
C
美国科学家发现多层魔角石墨烯形成稳健超导性
石墨烯是一种有机高分子材料
D
质检机构从某品牌液态奶中检测出违禁添加物丙二醇
丙二醇是乙醇的同系物
A、A B、B C、C D、D16. 侯氏制碱法以氯化钠、二氧化碳、氨和水为原料,发生反应NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵,通过以下两步反应可实现NH4Cl分解产物的分离:NH4Cl(s)+MgO(s)NH3(g)+Mg(OH)Cl(s)ΔH=+61.34kJ·mol-1
Mg(OH)Cl(s)HCl(g)+MgO(s)ΔH=+97.50kJ·mol-1
下列说法错误的是( )
A、反应NH4Cl(s)=NH3(g)+HCl(g)的ΔH=+158.84kJ·mol-1 B、两步反应的ΔS均大于0 C、MgO是NH4Cl分解反应的催化剂 D、5.35gNH4Cl理论上可获得标准状况下的HCl约2.24L17. 关于反应CH3COOH(l)+C2H5OH(l)CH3COOC2H5(l)+H2O(l) ΔH<0,下列说法不正确的是( )A、反应体系中硫酸有催化作用 B、因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零 C、因为反应的ΔH接近于零,所以温度变化对平衡转化率的影响小 D、因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计18. H2S是种高毒性 、高腐蚀性的气体污染物。 最新研究表明,在多孔炭材料上搭载活性组分催化氧化脱硫效果明显优于传统的吸附法,其反应机理如图所示。下列有关说法错误的是( )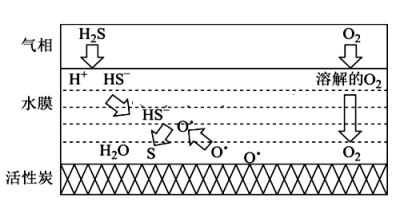 A、活性炭的作用为吸附剂和作催化剂的载体 B、温度越高,多孔炭材料催化氧化脱硫的效果越好 C、增加水膜的酸性会降低反应的速率 D、该反应的总反应方程式为:2H2S+O2=2S↓ +2H2O19. CO与气体均会造成环境污染,研究表明二者可在表面转化为无害气体,其反应进程及能量变化过程如图所示。下列说法正确的是( )
A、活性炭的作用为吸附剂和作催化剂的载体 B、温度越高,多孔炭材料催化氧化脱硫的效果越好 C、增加水膜的酸性会降低反应的速率 D、该反应的总反应方程式为:2H2S+O2=2S↓ +2H2O19. CO与气体均会造成环境污染,研究表明二者可在表面转化为无害气体,其反应进程及能量变化过程如图所示。下列说法正确的是( )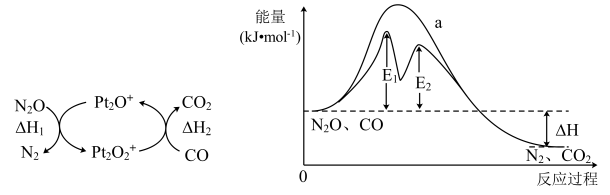 A、使用催化剂可降低反应活化能,但不改变反应历程 B、有催化剂条件下,E1时的反应速率比E2快 C、 D、为中间体、为催化剂20. 2021年诺贝尔化学奖授予德国本杰明·李斯特和英国戴维·麦克米兰发明的不对称有机催化成果,全世界催化剂贡献GDP约占35%。下列有关催化剂的说法错误的是( )A、催化剂不只是含金属元素的物质 B、催化剂能降低反应所需的活化能 C、催化剂能改变化学反应的平衡常数 D、催化剂能加快正逆反应速率并降低能耗21. 在相同条件下研究催化剂I、Ⅱ对反应 的影响,各物质浓度c随反应时间t的部分变化曲线如图,则( )
A、使用催化剂可降低反应活化能,但不改变反应历程 B、有催化剂条件下,E1时的反应速率比E2快 C、 D、为中间体、为催化剂20. 2021年诺贝尔化学奖授予德国本杰明·李斯特和英国戴维·麦克米兰发明的不对称有机催化成果,全世界催化剂贡献GDP约占35%。下列有关催化剂的说法错误的是( )A、催化剂不只是含金属元素的物质 B、催化剂能降低反应所需的活化能 C、催化剂能改变化学反应的平衡常数 D、催化剂能加快正逆反应速率并降低能耗21. 在相同条件下研究催化剂I、Ⅱ对反应 的影响,各物质浓度c随反应时间t的部分变化曲线如图,则( ) A、无催化剂时,反应不能进行 B、与催化剂Ⅰ相比,Ⅱ使反应活化能更低 C、a曲线表示使用催化剂Ⅱ时X的浓度随t的变化 D、使用催化剂Ⅰ时, 内,22. 汽车尾气中的、、碳氢化合物通过排气系统的净化装置(催化剂主要由、、等物质和稀土材料组成)转化为无害气体,净化原理如下。下列分析错误的是( )
A、无催化剂时,反应不能进行 B、与催化剂Ⅰ相比,Ⅱ使反应活化能更低 C、a曲线表示使用催化剂Ⅱ时X的浓度随t的变化 D、使用催化剂Ⅰ时, 内,22. 汽车尾气中的、、碳氢化合物通过排气系统的净化装置(催化剂主要由、、等物质和稀土材料组成)转化为无害气体,净化原理如下。下列分析错误的是( )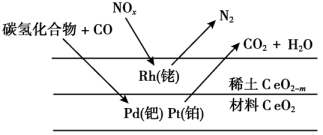 A、催化剂能提高反应速率 B、、均发生了氧化反应 C、转化为时,转化为 D、催化剂对化学反应有选择性23. SCR技术是针对柴油车尾气排放中NOx的一项处理工艺,其原理为NH3和NO在催化剂(MnO2)表面转化为N2和H2O,反应进程中的相对能量变化如图所示。下列说法错误的是( )
A、催化剂能提高反应速率 B、、均发生了氧化反应 C、转化为时,转化为 D、催化剂对化学反应有选择性23. SCR技术是针对柴油车尾气排放中NOx的一项处理工艺,其原理为NH3和NO在催化剂(MnO2)表面转化为N2和H2O,反应进程中的相对能量变化如图所示。下列说法错误的是( )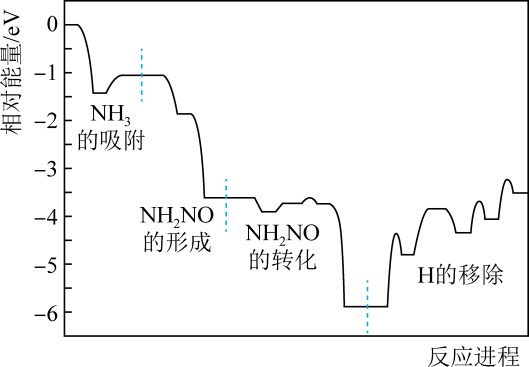 A、总反应方程式为6NO+4NH35N2+6H2O B、NH2NO是脱硝反应的活性中间体 C、催化剂的应用可降低反应焓变 D、决定反应速率的步骤是“H的移除”24. 在催化剂作用下,乙基格氏试剂(C2H5MgBr)与酯反应可生成环丙醇衍生物(
A、总反应方程式为6NO+4NH35N2+6H2O B、NH2NO是脱硝反应的活性中间体 C、催化剂的应用可降低反应焓变 D、决定反应速率的步骤是“H的移除”24. 在催化剂作用下,乙基格氏试剂(C2H5MgBr)与酯反应可生成环丙醇衍生物( )。反应过程如图所示。
)。反应过程如图所示。
下列叙述错误的是( )
A、化合物1直接催化乙基格氏试剂(C2H5MgBr)与酯反应的进行 B、反应过程中Ti的成键数目保持不变。 C、化合物4和5互为同分异构体 D、乙基格氏试剂(C2H5MgBr)与乙酸甲酯的反应为CH3COOCH3 + 2C2H5MgBr C2H6+ + CH3OMgBr
+ CH3OMgBr
二、多选题
-
25. 可以催化加氢制取 , 该加氢过程中发生的反应有
反应Ⅰ:
反应Ⅱ:
一定压强下,将和以物质的量之比为1:3的比例充入装有催化剂的反应器中,反应相同时间,测得的转化率、的选择性、CO的选择性与温度的关系如图所示。

的选择性
下列说法正确的是( )
A、曲线Ⅰ表示的转化率 B、从220℃~280℃,温度越高,生成的越少 C、从220℃~280℃,温度升高对催化剂的活性增强作用明显 D、其他条件不变,增大压强有利于提高的平衡产率26. 伯醇(记为)和叔醇(记为R3COH)发生酯化反应的机理如图所示。下列说法错误的是( ) A、两种酯化反应生成H2O中的*OH均来源于羧酸 B、两个历程中H+均作催化剂 C、两个历程中碳的成键数目均保持不变 D、两种酯化反应的总反应均属于取代反应
A、两种酯化反应生成H2O中的*OH均来源于羧酸 B、两个历程中H+均作催化剂 C、两个历程中碳的成键数目均保持不变 D、两种酯化反应的总反应均属于取代反应三、综合题
-
27. 我国公布了碳达峰、碳中和的时间节点。降低空气中二氧化碳的含量、研发二氧化碳的利用技术、将二氧化碳转化为能源是缓解环境和能源问题的方案之一。回答下列问题:(1)、以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=-49.5kJ•mol-1
II.CO(g)+2H2(g) CH3OH(g) △H2=-90.4kJ•mol-1
III.CO2(g)+H2(g) CO(g)+H2O(g) △H3
△H3=kJ•mol-1。
(2)、科学家采用金属钌等做催化剂,将从空气中捕获的CO2直接转化为甲醇燃料,其转化原理如图所示。下列说法错误的是____(填标号)。 A、第2步反应的产物是离子化合物 B、第4步反应中有σ键和π键的断裂和形成 C、
A、第2步反应的产物是离子化合物 B、第4步反应中有σ键和π键的断裂和形成 C、 是该反应的催化剂
D、该过程的总反应为CO2+3H2CH3OH+H2O
(3)、一定温度下,在容积为2L的恒容密闭容器中,加入2molCO2和3molH2以及催化剂,发生反应I。能说明该反应达到化学平衡状态的是____(填标号)。A、v正(H2)=v逆(CH3OH) B、c(CH3OH):c(H2O)=1:1 C、混合气体的总压强不再变化 D、混合气体的密度不再变化 E、混合气体的平均相对分子质量不再变化 F、H2O(g)的体积分数不再变化(4)、在一定条件下,选择合适的催化剂只进行反应III,调整CO2和H2初始投料比,测得在一定投料比和一定温度下,CO2的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。
是该反应的催化剂
D、该过程的总反应为CO2+3H2CH3OH+H2O
(3)、一定温度下,在容积为2L的恒容密闭容器中,加入2molCO2和3molH2以及催化剂,发生反应I。能说明该反应达到化学平衡状态的是____(填标号)。A、v正(H2)=v逆(CH3OH) B、c(CH3OH):c(H2O)=1:1 C、混合气体的总压强不再变化 D、混合气体的密度不再变化 E、混合气体的平均相对分子质量不再变化 F、H2O(g)的体积分数不再变化(4)、在一定条件下,选择合适的催化剂只进行反应III,调整CO2和H2初始投料比,测得在一定投料比和一定温度下,CO2的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。
①若A、B两点的起始浓度相同,则A、B两点对应的反应速率大小:vAvB(填“<”“>”或“=”)。
②已知反应速率v= v正-v逆=k正•x(CO2)•x(H2)-k逆•x(CO)•x(H2O),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,D点为平衡状态,计算D点所示的投料比在从起始到平衡的过程中,当CO2的转化率达到40%时,=。
③图中A、E、G三点对应的反应温度TA、TE、TG的关系是。
(5)、电催化CO2制备燃料可实现资源综合利用。如图所示装置工作时,阳极的电极反应式为。 28. 氢气是一种理想的能源,探索绿色化制氢是化学界一个热门话题。(本题反应中涉及△H、△S、△G均为298K条件值)。(1)、传统制备氢气方法之一为水煤气法:C(s)+H2O(g)=CO(g)+H2(g) △H=+132kJ·mol-1 , 该反应自发进行的条件是。(2)、利用生物质可再生资源乙醇制备氢气具有良好的开发前景。乙醇在Ni-MgO催化下,制取氢气有如下方法:
28. 氢气是一种理想的能源,探索绿色化制氢是化学界一个热门话题。(本题反应中涉及△H、△S、△G均为298K条件值)。(1)、传统制备氢气方法之一为水煤气法:C(s)+H2O(g)=CO(g)+H2(g) △H=+132kJ·mol-1 , 该反应自发进行的条件是。(2)、利用生物质可再生资源乙醇制备氢气具有良好的开发前景。乙醇在Ni-MgO催化下,制取氢气有如下方法:方法a:水蒸气催化重整CH3CH2OH(g)+H2O(g)4H2(g)+2CO(g) △H1=+257kJ·mol-1△S1=+459J·mol-1·K-1△G1=+122.9kJ·mol-1
方法b:部分催化重整CH3CH2OH(g)+O2(g)3H2(g)+2CO(g) △H2△S2=+400J·mol-1·K-1△G2
已知:298K时,相关物质的相对能量如图1。

①依据图1数据,计算方法b反应的△H2=kJ·mol-1。
②已知体系自由能变化:△G=△H-T△S,△G<0时反应自发进行。请从△G的角度分析方法a、b哪个更有利?。
③在某恒温和恒压(p0)体系中,CH3CH2OH和H2O以系数比投料进行方法a制氢,若平衡时H2的产率为50%,该条件下方法a反应的平衡常数Kp=。[如H2的平衡压强p(H2)= χ(H2)×p,χ(H2)为平衡系统中H2的物质的量分数,p为平衡时总压]
(3)、有化学工作者提出,在Ni-MgO催化剂中添加纳米CaO强化,开展“催化氧化重整”制氢,是一种优化的制氢方法。方法c:CH3CH2OH(g)+2H2O(g)+O2(g)5H2(g)+2CO2(g) △H=-67kJ·mol-1
①下列有关说法正确的是。
A.方法c制氢时,充分提高廉价原料O2的浓度,一定能增加氢气产率
B.方法c与a比,相同条件下方法c能耗更低,制氢速率更快
C.乙醇制氢的三种方法中原子利用率(期望产物的总质量与生成物总质量之比)大小关系为:c>a>b
D.方法c相当于方法b与水煤气变换CO(g)+H2O(g)CO2(g)+H2(g)的优化组合水醇比对乙醇平衡转化率有较大影响
②已知:常压、800K,反应在Ni-MgO催化下,测得乙醇平衡转化率与水醇比关系如图。请在图2中画出相同条件下,添加纳米CaO强化下的乙醇平衡转化率曲线。
